
ЛБ экология / л.р. №6 Шатихина
.doc
Лабораторная работа № 6
ИССЛЕДОВАНИЕ ОРГАНИЧЕСКИХ ЗАГРЯЗНЕНИЙ СТОЧНОЙ ВОДЫ
Цель работы
Изучение методов определения содержания органических примесей в воде и путей их поступления в природные и сточные воды.
Основные теоретические положения
Органические и минеральные вещества, содержащиеся в воде, при определенных условиях подвергаются окислению. В роли окислителя могут выступать: растворенный в ней кислород, КМnO4, КJ, К2Cr2О7. В зависимости от вида окислителя рассматривают перманганатную, йодатную и бихроматную окисляемость. Количество атомарного кислорода, эквивалентное расходу окислителя, характеризует величину окисляемости и выражается в мг О/дм3.
В
природных водах содержание легкоокисляемых
неорганических веществ (Fe2+,
Mn2+,
![]() ,
H2S
и др.) незначительно и почти вся
окисляемость приходится на долю
органических примесей, поступающих с
водосборных площадок, образующихся в
самом водном объекте или поступающих
из подземных водоносных горизонтов.
Содержание органических примесей в
сточных водах есть результат
жизнедеятельности человека и животных.
Кроме того, органические примеси
появляются в сточных водах предприятий
перерабатывающей промышленности.
,
H2S
и др.) незначительно и почти вся
окисляемость приходится на долю
органических примесей, поступающих с
водосборных площадок, образующихся в
самом водном объекте или поступающих
из подземных водоносных горизонтов.
Содержание органических примесей в
сточных водах есть результат
жизнедеятельности человека и животных.
Кроме того, органические примеси
появляются в сточных водах предприятий
перерабатывающей промышленности.
В сточных водах определяют бихроматную окисляемость, называемую ХПК – химическим потреблением кислорода.
ХПК – это количество кислорода, расходуемого на окисление содержащихся в воде органических и неорганических веществ в кипящем растворе бихромата калия, содержащем катализатор (сульфат серебра).
Определение ХПК основано на окислении органических веществ избытком бихромата калия в растворе серной кислоты при нагревании в присутствии катализатора. Остаток бихромата калия устанавливают титрованием соли Мора и, исходя из этого, находят количество К2Cr2O7, израсходованного на окисление органических веществ.
В природных и сточных водах окисление органических примесей может осуществляться за счет жизнедеятельности специальных микроорганизмов.
Количество кислорода, израсходованного в определенный промежуток времени в процессе биохимического окисления содержащихся в воде органических веществ в аэробных условиях, называется биохимическим потреблением кислорода (БПК). Полное биохимическое потребление кислорода происходит за 20 суток, т.е. БПКполн = БПК20. Если продолжительность инкубации составляет 5 суток, то говорят о БПК5.
Обычно при расчете концентрации органических примесей в сточных водах предприятий учитывают, что
![]() ;
(1)
;
(1)
![]() .
(2)
.
(2)
Описание лабораторной установки
Лабораторная установка для изучения ХПК (химической потребности в кислороде) воды изображена на рис. 6.1 и представляет собой круглодонную колбу 1 на 250 см3 с пришлифованным обратным холодильником 2.
Кроме того, необходимо иметь набор стеклянных капилляров, песчаную баню, мерные цилиндры на 50 см3, конические колбы на 0,5 дм3, пипетки на 1; 10; 20 см3, бюретки на 25 см3, промывалку с дистиллированной водой, а также растворы бихромата калия с концентрацией 0,025 моль/дм3, соли Мора с концентрацией 0,025 моль/дм3, сульфата серебра (0,5 г Ag2SO4 в 1 дм3 концентрированной серной кислоты) и индикатора N – финилантраниловой кислоты.
Порядок выполнения работы
20 см3 анализируемой пробы пипеткой помещают в круглодонную колбу со шлифтом, представленную на рис. 6.1.
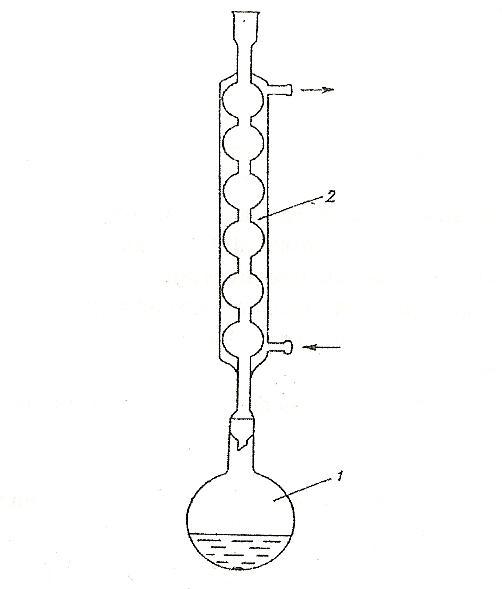
Рис. 6.1. Прибор для определения ХПК:
1 – круглодонная колба для кипячения; 2 – обратный холодильник
В колбу 1 для равномерного кипячения опускают 3–4 капилляра.
Далее в колбу 1 последовательно добавляют 10 см3 раствора К2Cr2О7, 30 см3 раствора сульфата серебра в концентрированной H2SO4.
К колбе 1 присоединяют обратный холодильник 2 и смесь кипятят на песчаной бане в течение двух часов.
После охлаждения промывают холодильник дистиллированной водой (~60 см3), отсоединяют его, обмывают стенки колбы еще 50 см3 дистиллированной водой и вновь охлаждают.
Переносят охлажденную пробу в коническую колбу и в нее же сливают промывные воды после двукратного ополаскивания круглодонной колбы дистиллированной водой (по 20–30 см3).
Добавляют к пробе 10 капель раствора N – фенилантраниловой кислоты (индикатор) и титруют избыток непрореагировавшего К2Cr2О7 раствором соли Мора до перехода окраски индикатора из красно-фиолетовой в синевато-зеленую.
Аналогично проводят холостой опыт с 20 см3 дистиллированной воды.
Определяют величину ХПК по формуле
![]() ,
,
где
![]() – величина ХПК, мгО/дм3;
– величина ХПК, мгО/дм3;
WМХ – объем раствора соли Мора, израсходованный на титрование в холостом опыте, см3;
WM – объем раствора соли Мора, израсходованный на титрование пробы, см3;
С![]() – концентрация раствора соли Мора,
равная 0,025 моль/дм3;
– концентрация раствора соли Мора,
равная 0,025 моль/дм3;
W – объем пробы воды, взятой для определения, см3;
8 – масса миллиграмм-эквивалента кислорода, мг/моль.
Результаты определений представляют в виде
сх ± Δ, мгО/дм3,
где Δ – абсолютная погрешность определения ХПК, по табл. 6.1.
Таблица 6.1
|
Диапазон определяемых величин ХПК, с, мгО/дм3 |
Абсолютная погрешность Δ, мг/дм3 |
|
4,0 ÷ 80,0 |
1,3 + 0,057 сx |
Далее, пользуясь соотношением (2), находят БПКполн:
![]() .
.
Результаты всех определений сводят в табл. 6.2.
Таблица 6.2
Определение концентрации органических примесей в воде
|
Объем раствора соли Мора, см3 |
Объем исходной пробы, W, см3 |
Концентрация |
Абсолютная погрешность Δ, мг/дм3 |
БПКп, мгО/дм3 |
||
|
В холостом опыте, WMX |
На титрование пробы, WM |
Раствора соли Мора, моль/дм3 |
ХПК, мгО/дм3 |
|||
|
|
|
|
|
|
|
|
Контрольные вопросы
1 Что называется химическим потреблением кислорода (ХПК)?
2 Что называется биохимическим потреблением кислорода (БПК)?
3 Какая связь между этими показателями качества воды?
4 Назовите источники поступления органических примесей в природные и сточные воды?
5 Каково соотношение БПК5 и БПКполное?
6 Какая величина больше ХПК или БПК и почему?
Литература
1 Савенкова М.А., Шатихина Т.А. Примеси в гидросфере и методы их анализа : учеб. пособие. – Ростов н/Д : РГУПС, 2002. – 81 с.
