
- •Первый закон термодинамики
- •2. Второй и третий законы термодинамики
- •3. Термодинамические потенциалы
- •4. Химическое равновесие
- •5. Гетерогенное равновесие в однокомпонентных системах
- •6. Растворы
- •7. Электрохимия
- •8. Химическая кинетика
- •Термодинамические величины для некоторых веществ
- •Органические соединения
- •Криоскопические /к/ и эбуллиоскопические /е/ константы
- •Константы диссоциации некоторых слабых электролитов
7. Электрохимия
Что называется удельной электропроводностью раствора? Мольной электропроводностью?
Как изменяются удельная и мольная электропроводности с изменением концентрации раствора?
Как измеряют электропроводность раствора? Что такое ”постоянная ячейки” ?
Как рассчитать степень диссоциации электролита в растворе по значению электропроводности раствора?
Что такое ионные проводимости в растворах? Закон Кольрауша.
Объясните, почему ион лития в водном растворе наименее подвижен по сравнению с другими ионами щелочных металлов, хотя он имеет наименьший диаметр?
Что такое эстафетная проводимость?
Чем определяется заряд металлической пластинки в растворе соли данного металла? Как изменить этот потенциал?
Что такое стандартный электродный потенциал?
Как рассчитать электродный потенциал при температуре, отличающейся от 298°К?
Объясните, почему железо растворяется в разбавленной серной кислоте, а медь не растворяется?
Серебро не растворяется в разбавленной серной кислоте, но растворяется в разбавленных азотной и йодистоводородной кислотах. Объясните это.
При какой концентрации ионов железа /+2/ в растворе потенциал железной пластинки, опущенной в этот раствор, будет равным 0?
Что такое стеклянный электрод? Дня чего он применяется?
Что такое хлорсеребряный электрод? Как рассчитывают его потенциал?
Как устроен каломельный электрод? От чего зависит его потенциал?
Что такое водородный электрод?
Что такое мембранный потенциал? Какое значение он имеет в биологии?
Определите направление процессов в таких системах /A=1/:
а)
![]() ,
,![]() ,
,![]() ,
,![]()
б)
![]() ,
,![]() ,
,![]() ,
,![]()
в)
![]() ,
,![]() ,
,![]() ,
,![]()
г)
![]() ,
,![]() ,
,![]() ,
,![]()
Сконструируйте элементы, в которых реализуется следующиепроцессы:
а)
![]()
б)
![]()
в)
![]()
г)
![]()
д)
![]()
е)
![]()
ж)
![]()
Что такое концентрационный элемент? Рассмотрите термодинамику его работы.

По значениям стандартных потенциалов рассчитайте константуравновесия для реакции
 .
Какими будут равновесные концентрации,
если исходные концентрации
.
Какими будут равновесные концентрации,
если исходные концентрации и
и равны 1 М?
равны 1 М?
Могут ли идти реакции дисмутации:
а)
![]()
б)
![]()
Рассчитайте ЭДС элемента:
![]()
Цифры под символами ионов означают активность соответствующих ионов.
Вычислите ЭДС гальванического элемента:
![]()
0,5 М 0,05 М
Цифры
под символами веществ означают молярные
концентрации
веществ
в растворе. Эквивалентная электропроводность
0,05 М раствора составляет 99,5![]() ,
а 0,5 М – 77,5
,
а 0,5 М – 77,5![]() .
.
8. Химическая кинетика
Что такое порядок химической реакции? Какие вы знаете способы определения?
Как найти константу скорости химической реакции?
Почему порядок химической реакции отличается от
стехиометрических коэффициентов в уравнении реакции?
Что такое последовательные реакции? Как оценить скорость реакции, которая проходит в несколько этапов?
Что такое цепные реакции?
В некоторых случаях скорость реакции зависит от объема реакционной смеси. Как это можно объяснить?
Для реакции
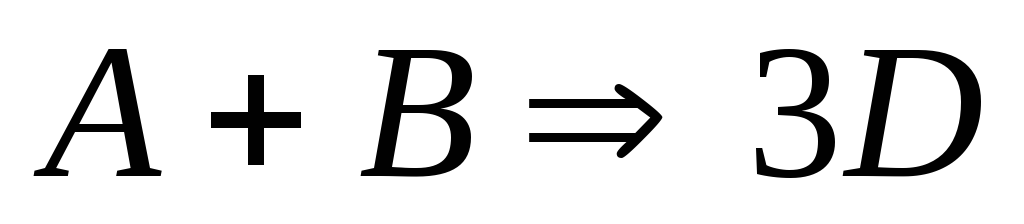 начальные концентрацииА
и В
равны соответственно 0,8 и 2,0 моль/л.
Через 20 мин. концентрация А
стала равной 0,6 моль/л. Найти концентрации
В
и D
в это время и среднюю скорость реакции.
начальные концентрацииА
и В
равны соответственно 0,8 и 2,0 моль/л.
Через 20 мин. концентрация А
стала равной 0,6 моль/л. Найти концентрации
В
и D
в это время и среднюю скорость реакции.Как изменится скорость реакции
 ,
если в систему ввести некоторое
количество аргона при
,
если в систему ввести некоторое
количество аргона при
 ?
При
?
При ?
?
Период полураспада трития - около 12 лет. Рассчитайте время, необходимое для распада 90% трития, 99% трития. Сколько трития распадется через 120 лет?
Растворение
 в
растворе уксусной кислоты происходит
скорее,
чем в растворе серной кислоты, хотя
серная
кислота
является сильной, а уксусная слабой.
Объясните
это
явление.
в
растворе уксусной кислоты происходит
скорее,
чем в растворе серной кислоты, хотя
серная
кислота
является сильной, а уксусная слабой.
Объясните
это
явление.Уравнения некоторых реакций можно зависать с разным соотношением количеств исходных веществ и продуктов реакции, например:
![]()
![]()
Как вы могли бы объяснить это явление?
По энтальпийной диаграмме реакции и уравнению Аррениуса для зависимости скорости реакции от температуры покажите справедливость принципа Ле-Шателье.
При повышении температуре на 30°К скорость реакции выросла в 8 раз. Рассчитайте температурный коэффициент реакции и энергию активации при 300°К.
Рассчитайте энергии активации реакций, если их температурные коэффициенте при 300°К равны
0,5; 1; 2; 4.
Константы скорости некоторой реакции при 273°К и 373°К равны, соответственно, 3,4 и 27,6. Найдете значение константы скорости этой реакции при 298°К.
Термическое разложение уксусного альдегида проходит по уравнению
 .
При 800°К
получены следующие данные по зависимости
скорости разложения от концентрации
альдегида
.
При 800°К
получены следующие данные по зависимости
скорости разложения от концентрации
альдегида
-
С м/л
0,2
0,4
0,6
0,8
υ м/л∙сек
1,8
7,2
16,2
28,8
Напишите кинетическое уравнение реакции. Каков порядок реакции? Рассчитайте константу скорости реакции. Рассчитайте скорость разложения при начальной концентрации альдегида 0,1 м/л и 1,0 м/л.
Скорость реакции
 можно
определить по общему давлению в системе.
При 328°К
были получены следующие данные:
можно
определить по общему давлению в системе.
При 328°К
были получены следующие данные:
|
Время реакции мин. |
3 |
4 |
5 |
6 |
7 |
10 |
16 |
30 |
∞ |
|
Давление мм.рт.ст. |
73 |
95 |
116 |
136 |
152 |
196 |
252 |
309 |
331 |
Определите константу скорости реакции, порядок реакции, период полураспада давление в системе через 20 мин.после начала реакции.
Рассмотрите с точки зрения химической кинетики процессы разжигания и горения костра:
а) почему для разжигания костра используют тонкие веточки или бересту?
б) почему ветер гасит горящую спичку, но раздувает костер?
в) почему плохо горит костер из сырых дров?
Справочные таблицы
