
Лекция_Феремнтативный катализ
.pdf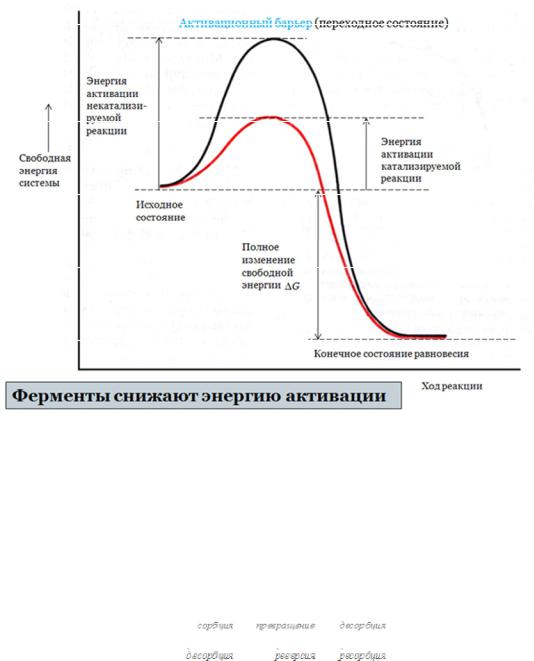
Лекция
МЕХАНИЗМЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Ферменты играют ключевую роль в метаболизме. Они не создают новые реакции и не меняют их направление, они только ускоряют реакции, увеличивая константы их скоростей. Ускоряя порой их в миллионы миллионов раз, в миллионы раз сильнее, чем очень сильные химические катализаторы. Рассмотрим энергетический профиль обычной реакции (рис.1), проходящей в растворе по механизму столкновений А+В →Р, и реакции с участием фермента.
Рис. 1 Энергетический профиль ферментативной реакции
Образование продукта Р происходит, если энергия сталкивающихся молекул исходных веществ А и В превышает величину энергетического барьера. Очевидно, можно ускорить эту реакцию, если каким-то образом уменьшить величину энергии активации. Именно эту задачу – снижение активационного барьера – решает фермент. В общем виде механизм ферментативного катализа представлен несколькими стадиями:















 .
.

Таким образом, общая схема включает, как известно, образование единого фермент-субстратного комплекса, в активном центре которого и происходит разрыв старых и образование новых связей с появлением продукта (рис 2).
С физико-химических позиций каталитическое действие ферментов обеспечивается эффектами:
•сближения фермента и субстрата, что эквивалентно увеличению их концентрации;
•ориентации участников реакции в пространстве относительно друг друга;
•индуцированного соответствия фермента и субстрата
•поляризации и перераспределения электронной плотности субстрата;;
•стабилизации промежуточного продукта реакции.
Рис. 2 Этапы ферментативного катализа
В ферментативном катализе многостадийный характер превращений субстрата, маловероятный в растворе, обеспечивается за счет синхронного кооперативного их протекания в единой полифункциональной системе. Замена малоэффективных последовательных активационных стадий скоординированным процессом приводит формально к снижению энергии активации всей реакции. Заметим еще раз, что, строго говоря, физический смысл понятия «энергия активации» в ферментативных процессах не соответствует таковому для реакций в растворах, идущих по механизму активных столкновений свободных молекул.
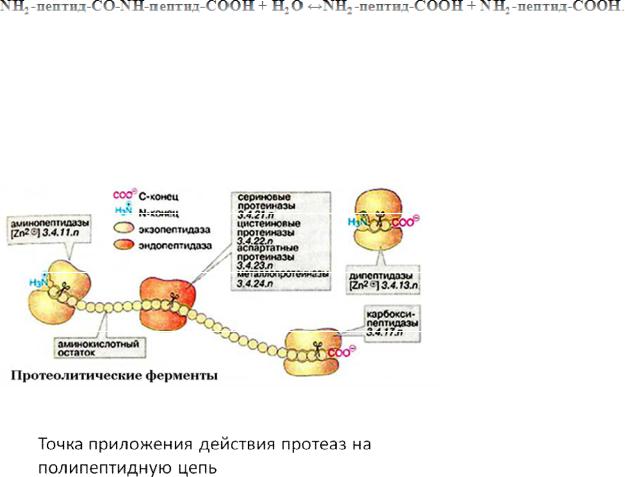
Рассмотрим механизм ферментативного катализа на примере сериновых протеаз. Сериновые протеазы разрезают полипептидную цепь, т.е. проводят реакцию (рис 3)
Реакция гидролиза пептидной цепи идёт, когда в среде достаточно много воды, и сама по себе, но очень медленно, за многие годы, поскольку гидролиз при наличии воды термодинамически выгоден, но требует преодоления высокого энергетического барьера. Если же свободной воды в среде нет – реакция идёт в другую сторону, в сторону синтеза полипептида и выделения воды, но также очень медленно.
Рис. 3. Действие протеаз
Активный центр сериновых протеаз, равно и других ферментов включает каталитический центр, ответственный за проведение химической трансформации и субстрат-связывающий центр. Функция последнего заключается в точной взаимной ориентации субстрата и каталитического центра.
Катализ – в сериновых протеазах – непосредственно осуществляется боковой цепью одного определенного серина (называемого «Ser195» – по его расположению в цепи химотрипсина – во всех белках семейства трипсина). Химическая формула боковой группы серина: –СН2-ОН. Однако для того, чтобы серин мог катализировать гидролиз, он (серин) должен быть подготовлен. Пока кислород находится в форме -ОН-группы, он не активен, а активным он становится после утери Н+ и перехода в форму –О- . Этим отрывом атома Н от Ser195 занимаются два остальных члена «триады переноса заряда» – His57 (он принимает оторванный атом Н+) и
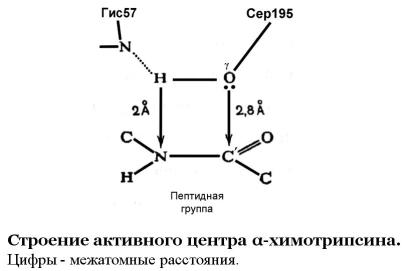
«вспомогательный» Asp102. Мутации обоих этих остатков – не говоря уже о мутации или химической модификации каталитического серина – практически губят каталитическую активность трипсиновых протеаз.
Активированный атом О боковой группы Ser195 совершает основное каталитическое действо. Он атакует С-атом расщепляемой пептидной группы (рис. 4), завязывая с ним временную ковалентную связь (правда, более длинную и менее прочную, чем обычные С-O-связи), переводя тем самым этот С-атом в тетраэдрическую форму. Особенность тетраэдрической формы в том, что он ковалентно связан уже не с тремя, а с четырьмя другими атомами; «дополнительный» атом – это О боковой группы Ser195. А последующий распад этого комплекса ведет к разрыву C–N связи и последующему разрыву обрабатываемой цепи.
Рис.4 Активный центр химотрипсина
Субстрат-связывающий центр состоит (рис 5) из оксианионовой дыры, связывающей кислород расщепляемой пептидной группы, из неспецифической пептид-связывающей площадки (отвечающей – вместе с оксианионовой дырой – за то, что расщепляемая пептидная группа займет правильное положение относительно активированного O-атома боковой группы Ser195), и из специфического субстрат-связывающего кармана, отвечающего за распознавание той аминокислоты, после карбоксила которой производится расщепление пептида.
Общий ход реакции иллюстрируется рис 5. Эта схема была получена ценой многолетних исследований многих групп. Для ее построения привлекались разнообразные данные. Во-первых, по катализу расщепления разных субстратов, и по химическим модификациям фермента. Во-вторых, белково-инженерные исследования, показавшие, какие точки фермента вовлечены в катализ. В-третьих, исследования ферментов в комплексе с
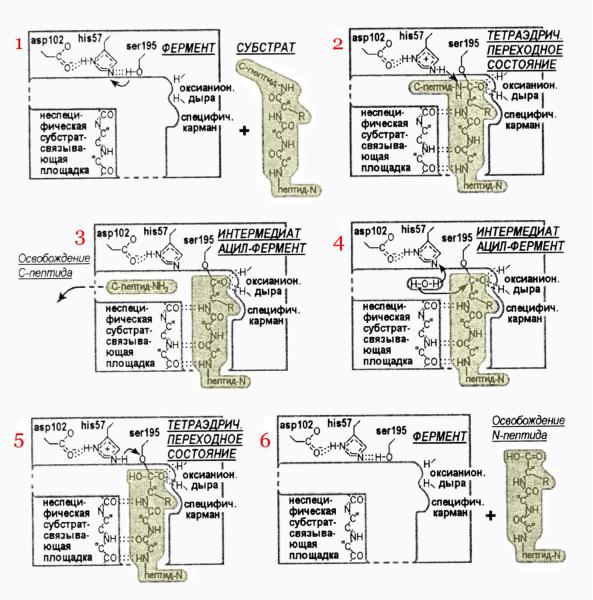
нерасщепляемыми аналогами субстратов. В-четвертых, рентгеноструктурные работы, показавшие, где образуются водородные связи. В-пятых, и исследования другого характера.
С физико-химической и термодинамической позиции ускорение реакции происходит вследствие того активированный комплекс (или, что то же самое «переходное состояние») менее нестабилен, чем активированный комплекс спонтанного не ферментативного гидролиза в воде. В итоге происходит облегчённый сбор всех составляющих активированного комплекса, это понижает его свободную энергию на ферменте по сравнению со свободной энергией комплекса в не ферментативной реакции и приводит к так называемому энтропийному катализу.
Рис.5 Схема гидролиза пептида сериновой протеазой
