
Билет №21.
Число степеней свободы молекулы. Закон распределения по степеням свободы. Степень свободы - это число независимых координат, полностью определяющих положение системы в пространстве. Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения
![]()
Атомы
всегда находятся в движении и чем выше
температура, тем интенсивнее движение.
 –
поступательная
энергия.
–
поступательная
энергия.
Однако наряду с поступательным движением возможны также вращательные движения и колебательные. Оба этих движения связаны с запасом энергии. Определить которую позволяет «закон о равнораспределении энергии по степеням свободы»
Числом степени свободы механической системы называется – количество независимых величин с помощью которых может быть задано положение системы. У материальной точки ч.с.с.=3, у 2-х материальных точек = 6, если они связаны, то ч.с.с.=5.
Закон Больцмана о распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится среднекинетическая энергия, равная kT/2, а на каждую колебательную степень свободы - в среднем энергия, равная kT.

Постоянное ускорение эквивалентно псевдо силе, в чем градиент концентрации есть множество. Тогда...
Билет №22.
Модель идеального газа. Термодинамический и статистический методы. Число Авагадро – число атомов или молекул содержащихся в 1 моле вещества. NA=6.022*1023 моль-1
Идеальный
газ
– газ, состоящий из молекул, взаимодействие
между которыми пренебрежимо мало.
Средняя кинетическая энергия молекул
идеального газа во много раз больше
потенциальной энергии взаимодействия.
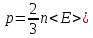 - основное
уравнение для МКТ.
- основное
уравнение для МКТ.
Методы: а) динамический метод n=2,7*1019 см-3 Этот метод не пригоден теоретически и практически.
б) Термодинамический метод. Теория здесь базируется на законах начала.
в) Статистический. Основан на модельных атомно-молекулярных представлениях. Задача: зная законы поведения частиц, из которых состоит система установить закон поведения макроскопического вещества.
А так же газ, удовлетворяющий этим 6 условиям, называется идеальным: 1) Закон Авагадро: При одинаковых p и T молярные объемы газов одинаковы. 2) Закон Бойля-Мариотта: При T=const pV=const 3) Закон Гей-Люссака: При p=const V/T = const 4) Закон Шарля: При V=const p/T=const 5) Закон Дальтона: общее давление равно сумме парциальных давлений. 6) Закон Джоуля: U=CT

Тогда




Билет №23.
Основное
уравнение молекулярно-кинетической
теории идеальных газов
ДЛя
вывода основного уравнения
молекулярно-кинетической теории
рассмотрим одноатомный идеальный газ.
Предположим, что молекулы газа движутся
хаотически, число взаимных столкновений
между молекулами газа пренебрежимо
мало по сравнению с числом ударов о
стенки сосуда, а соударения молекул со
стенками сосуда абсолютно упругие.
Выделим на стенке сосуда некоторую
элементарную площадку S
и вычислим давление, оказываемое на эту
площадку. При каждом соударении молекула,
движущаяся перпендикулярно площадке
передает ей импульс m0v-(-m0v)=2m0v,
где m0
- масса молекулы, v - ее скорость. За время
t
площадки S
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
S
и высотой vt.
Число этих молекул равно nSvt.
Так как молекулы движутся хаотично
вдоль 3-х осей, по 6-ти направлениям, то
число ударов молекул вдоль данного
направления о площадку S
будет nSvt/6.
При столкновении с площадкой эти молекулы
передадут ей импульс
![]()
Тогда
давление газа, оказываемое им на стенку
сосуда,
![]()
Подставив
вместо
![]() среднее
квадратичное значение скорости получим
основное
уравнение молекулярно - кинетической
теории идеальных газов.
среднее
квадратичное значение скорости получим
основное
уравнение молекулярно - кинетической
теории идеальных газов.

Согласно закону Бойля…таким образом.
Билет №24.
Второе начало термодинамики. Неравенство Клаузиуса.
Термодинамика – раздел физики, в котором изучается условие превращения одного вида энергии в другое и количественное отношение при этих превращениях.
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии DU=0. Тогда, согласно первому началу термодинамики, A=Q, т.е. вечный двигатель первого рода - периодически действующий двигатель, который совершал бы работу большую. чем сообщенная ему из вне энергия, - невозможен.
Используя понятие энтропии и неравенство Клаузиуса (DS>=0), второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
![]() Функция
состояния,
дифференциалом которой является dQ/T,
называется энтропией
и обозначается S.
Для обратимых процессов
изменение энтропии dS=0.
Энтропия системы, совершающей необратимый
цикл, возрастает: dS>0
Эти выражения относятся только к
замкнутым
системам,
если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом. Данные отношения
можно представить в виде неравенства
Клаузиуса: В
Функция
состояния,
дифференциалом которой является dQ/T,
называется энтропией
и обозначается S.
Для обратимых процессов
изменение энтропии dS=0.
Энтропия системы, совершающей необратимый
цикл, возрастает: dS>0
Эти выражения относятся только к
замкнутым
системам,
если же система обменивается теплотой
с внешней средой, то ее энтропия может
вести себя любым образом. Данные отношения
можно представить в виде неравенства
Клаузиуса: В
![]() , т.е. энтропия
замкнутой системы
может либо
возрастать
(в случае необратимого процесса), либо
оставаться постоянной
(в случае обратимых процессов).
, т.е. энтропия
замкнутой системы
может либо
возрастать
(в случае необратимого процесса), либо
оставаться постоянной
(в случае обратимых процессов).
Задачи нет!
Билет №25.
Явление на границах между средами.
Твердые тела, как и жидкие, по тем же причинам обладают поверхностной энергией и натяжением. При этом, если речь идет о границе раздела 2-х сред, следует иметь ввиду, что поверхностная энергия на границе раздела зависит от свойств обоих сред. Другими словами, надо рассматривать суммарную поверхностную энергию α12 двух сред.
Рассмотрим
каплю жидкости на поверхности твердого
тела. Для равновесия необходимо, чтобы
все силы, действующие на элемент контура,
 рисунку в точке О, уравновесились. Эти
силы состоят из сил поверхностного
натяжения α12,
α23,
α13,
действующих
вдоль границ раздела между средами.
Равнодействующая этих сил: α12
+ α23
+ α13
уравновешена
молекулярным силам твердого тела,
которая направлена вниз. Поэтому
равновесие обеспечивающее равновесие
равно нулю суммарной проекции сил на
горизонтальном направлении. α13=
α12
рисунку в точке О, уравновесились. Эти
силы состоят из сил поверхностного
натяжения α12,
α23,
α13,
действующих
вдоль границ раздела между средами.
Равнодействующая этих сил: α12
+ α23
+ α13
уравновешена
молекулярным силам твердого тела,
которая направлена вниз. Поэтому
равновесие обеспечивающее равновесие
равно нулю суммарной проекции сил на
горизонтальном направлении. α13=
α12 +
α23
+
α23
 где
где
 - краевой угол,
- краевой угол,
 – жидкость
смачивает;
– жидкость
смачивает;
 - полное смачивание.
- полное смачивание.
 – жидкость
не смачивает;
– жидкость
не смачивает;
 - полное не смачивание.
- полное не смачивание.
