
Электролитическая диссоциация
.docЭлектролитическая диссоциация. Водородный показатель
Введение
Вода является весьма слабым электролитом. Диссоциация воды может быть выражена уравнением
Н2О « Н++ОН- .
Константа диссоциации определяется уравнением
K = [H+]×[OH-] /[H2O].
Поскольку в разбавленных растворах концентрация воды практически постоянна, то
Kw = K×[H2O] =[H+]×[OH-] = const.
Величина, обозначаемая Kw, называется ионным произведением воды. Она зависит только от температуры. При 25оС
Kw = [H+]×[OH-] = 1× 10-14.
Постоянство Kw означает, что в любом водном растворе (нейтральном, кислом или щелочном) представлены оба вида ионов, т.е. ионы водорода и гидроксильные ионы. Характер среды определяется теми ионами, концентрация которых больше. Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл:
если [H+]=[OH-]=Ö1× 10-14 = 10 - 7 моль/л - среда нейтральная;
если [H+] > 10-7 моль/л - среда кислая;
если [H+] < 10-7 моль/л - среда щелочная.
Для характеристики среды удобнее пользоваться не значениями концентраций, а их логарифмами, взятыми с обратным знаком. Эти величины называются соответственно водородным и гидроксильным показателями и обозначаются символами рН и рОН:
рН = - lg[H+]; pOH = - lg[OH-]
соответственно
рН + рОН = 14.
Для экспериментального определения кислотности или основности среды используют слабые органические кислоты и основания, которые называются индикаторами. Окраска индикаторов в недиссоциированном состоянии отличается от окраски их ионов. Диссоциацию на ионы такого индикатора, например, метилового оранжевого, можно представить в общем виде следующим образом:
RH « H++R-
красный желтый
При увеличении [H+] равновесие сместится влево, в сторону красной окраски, при уменьшении [H+], т.е. при добавлении [OH-] - соответственно вправо, в сторону желтой окраски.
Интервалы перехода окраски некоторых индикаторов
-
Индикатор
Интервал перехода рН
Изменение цвета
Метиловый оранжевый
Метиловый красный
Лакмус
Фенол-фталеин
3,2-4,4
4,4-6,2
5,0-8,0
8,2-10,0
От красного до желтого
От красного до желтого
От красного до синег
От бесцветного до малинового
На основе свойств кислотно-основных индикаторов создан универсальный индикатор. Смесь простых индикаторов подобрана так, что окраска раствора с каплей такой смеси изменяется непрерывно с изменением рН в широком интервале. Промышленность выпускает универсальную бумагу. По изменению окраски такой индикаторной бумаги с помощью цветовой шкалы определяют рН раствора. Для измерения рН наряду с химическими индикаторами используется специальный прибор - рН-метр. РН-метр состоит из милливольтметра и двух электродов. В исследуемый раствор опускают два электрода - стандартный и индикаторный. Потенциал стандартного электрода jстанд. постоянен в любом растворе, потенциал индикаторного электрода jинд. зависит от рН раствора. Милливольтметр рН-метра отградуирован не в вольтах, а в единицах рН. Поэтому при измерении разности потенциалов (jстанд. - jинд.) по шкале милливольтметра определяется рН раствора.
Лабораторная работа
Реактивы:
1. Соляная кислота - 0.2 N
2. Гидроксид калия - 0.2 N
3. Метиловый оранжевый
4. Фенолфталеин
5. Метиловый красный
6. Лакмус
7. Уксусная кислота - конц.
8. Уксусная кислота разной концентрации: 0.1 М; 0.2 М; 1 М и т.д.
9. Гидроксид аммония разной концентрации : 0.1 М; 0.2 М; 1 М и т.д.
Опыт 1.
В 3 пробирки налить по 1 мл дистиллированной воды. Во вторую пробирку добавить 2 - 3 капли соляной кислоты, а в третью 2 - 3 капли гидроксида калия. С помощью универсальной бумаги определить рН растворов в каждой пробирке, затем в каждую пробирку добавить по 1-2 капли раствора метилового оранжевого. Отметить в таблице (см. следующую страницу) цвет индикатора и рН по универсальной бумаге. Повторить опыт для индикаторов, указанных в таблице.
.
|
|
|
Реакция раствора |
||||
|
Индикатор |
рН< 7 |
рН = 7 |
рН>7 |
|||
|
|
цвет |
универ. РН |
цвет |
унвер. РН |
цвет |
универ. РН |
|
1.Метиловый оранжевый 2.Метиловый красный 3.Фенолфталеин 4. Лакмус |
|
|
|
|
|
|
Опыт 2.
Получить стаканчик с раствором уксусной кислоты. Вместе с лаборантом определить рН раствора с помощью рН-метра. Рассчитать концентрацию ионов водорода, степень и константу диссоциации вещества. Концентрацию вещества узнать у преподавателя. Заполнить таблицу.
|
Конц-ция СН3СООН,г/л |
См , Моль/л |
рН |
[H+] |
|
Кд |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1. Можно ли с помощью фенолфталеина отличить кислую среду от нейтральной?
2. Почему кислотно-основные индикаторы при изменении рН меняют окраску раствора ?
3. С помощью какого способа можно точно оределить рН : универсальный индикатор, основно-кислотный индикатор, рН-метр ?
4. При какой концентрации бромноватистой кислоты (К = 2,5 × 10-9) рН ее раствора равен 5?
-
Определить в каком растворе больше рН : 0,01 М растворе НС1 или 0.1 М растворе НCN? КHCN= 7.9 × 10-10.
Буферные растворы.
Введение.
В лабораторной практике по химии, в медицине, в биологии встречается необходимость проведения работ в растворах, способных сохранять рН практически постоянным, не изменяющимся от разбавления раствора и от добавления к нему некоторых количеств сильных кислот и оснований. Такие растворы существуют и получили название буферных растворов (смесей).
Наиболее часто применяемые буферные растворы представляют собой смесь слабой кислоты с солью, образованной этой кислотой и сильным основанием, например (СН3СООН + СН3СООNa)-ацетатная буферная смесь, а также смесь слабого основания с солью, образованной этим основанием и сильной кислотой, например (NH4OH + NH4Cl)-аммиачный буферный раствор. Буферные растворы слабых кислот имеют рН<7, в буферных растворах слабых оснований рН>7.
Способность буферных смесей поддерживать практически постоянный рН основана на том, что входящие в них компоненты связывают Н+ ионы кислот или ОН- ионы оснований, вводимых в раствор или образующихся в результате реакции, протекающей в этом растворе. Например, если к ацетатной буферной смеси добавлять сильную кислоту, то Н+ ионы добавляемой кислоты будут соединяться с СН3СОО- ионами соли в малодиссоциированные молекулы СН3СООН, а не увеличивать концентрацию Н+ ионов в растворе. При добавлении щелочи добавляемые ОН- ионы будут связывать Н+ ионы буферной кислоты в малодиссоциированные молекулы воды, но концентрация Н+ ионов будет тут же восстанавливаться вследствие смещения равновесия в сторону увеличения диссоциации уксусной кислоты СН3СООН ↔ СН3СОО- + Н+ . Таким образом рН среды в обоих случаях остается практически постоянным. Аналогичный механизм буферного действия имеет место в аммиачной буферной смеси.
Опыт 1 Приготовление ацетатного(СН3СООН + СН3СООNa) и аммиачного(NH4OH + NH4Cl) буферных растворов.
В небольшой стаканчик взять по 5 мл 0,1М растворов уксусной кислоты и ацетата натрия и перемешать их стеклянной палочкой.
Во втором стаканчике приготовить таким же образом аммонийную буферную смесь из 0,1М растворов аммиака и хлорида аммония.
Определить рН приготовленных растворов с помощью универсального индикатора и при помощи вычисления. Растворы сохранить для следующих опытов.
Вычислить рН ацетатной смеси, исходя из следующих соображений. Соль СН3СООNa как сильный электролит можно считать полностью диссоциированной на ионы. Высокая концентрация СН3СОО-онов соли практически нацело подавляет диссоциацию уксусной кислоты. Вследствие этого равновесную концентрацию недиссоциированных молекул уксусной кислоты можно считать равной ее исходной молярной концентрации, а концентрацию СН3СОО- ионов равной молярной концентрации соли:
[СН3СООNa]равн. = Ск-ты
[СН3СОО-]р-р = Ссоли
Тогда константа диссоциации уксусной кислоты в буферном растворе будет иметь вид:
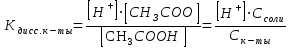
Откуда:
![]()
Логарифмируя полученное выражение и меняя знаки на обратные, получим формулу, позволяющую вычислить рН в буферных смесях из слабых кислот и их солей:
![]()
Где рКк-ты = -lg Кдисс.к-ты
В
нашем случае концентрации соли и кислоты
одинаковы, Ск-ты
=Ссоли
, поэтому
![]() и, следовательно, рН = -lg
Кдисс.к-ты
(Значение Кдисс
см. в табл.).
и, следовательно, рН = -lg
Кдисс.к-ты
(Значение Кдисс
см. в табл.).
Вычислить по полученной формуле рН ацетатной буферной смеси и сравнить его с экспериментально определенным значением.
Аналогичными рассуждениями можно показать, что рН в аммиачной буферной смеси будет определяться формулой:
![]()
где рКосн. = -lg Кдисс.осн.
Вычислить по этой формуле рН в приготовленном аммиачном буферном растворе и сравнить с найденным по универсальному индикатору.
Опыт 2а. Исследование буферных свойств ацетатного буферного раствора.
При помощи универсального индикатора определить рН дистиллированной воды. Поместить в 2 пробирки по 10 капель дистиллированной воды, в одну добавить одну каплю 0,1 н. р-ра HCl, в другую-одну каплю 0,1 н. р-ра NaOH .Перемешать растворы чистыми палочками и вновь определить рН растворов.
В 2 другие пробирки поместить по 10 капель ацетатной буферной смеси, приготовленной в опыте1. Прибавить в одну каплю 0,1 н. р-ра HCl, в другую-одну каплю 0,1 н. р-ра NaOH, перемешать палочкой растворы и вновь определить в них рН. Как повлияло на величину рН добавление HCl и NaOH к дист. воде? К буферному раствору?
Опыт 2б. Исследование буферных свойств аммонийного буферного раствора.
Поместить в 2 пробирки по 10 капель приготовленной в опыте 1 аммонийной буферной смеси с измеренным рН. В одну пробирку добавить одну каплю 0,1 н. р-ра HCl, в другую-одну каплю 0,1 н. р-ра NaOH и определить в них значения рН, пользуясь универсальным индикатором. Сделать вывод о влиянии добавок HCl и NaOH к дистиллированной воде и к буферному раствору.
Опыт 3. Влияние разбавления на рН буф. растворов.
В мерную колбу вместимостью 100 мл внести 1 мл ацетатной буферной смеси, приготовленной в опыте 1 и разбавить ее водой примерно в 50 раз (т.е. добавить дистиллированную воду на глаз до половины колбы и перемешать раствор). Определить рН этого раствора. После этого добавить дистиллированную воду до метки, т.е. разбавить уже в 100 раз, перемешать и определить вновь рН. Наблюдается ли изменение рН буферного раствора при разбавлении в 50 и 100 раз? Проделать аналогичный опыт с аммонийным буферным раствором.
Контрольные вопросы.
1.Дайте определение понятия — буферная система.
2.В чем заключается буферное действие? Разберите на примере фосфатного буфера механизм его действия при добавлении к нему небольших количеств HСl и NaOH.
3.Что называется буферной емкостью раствора? От каких факторов она зависит?
4.Концентрация аммиака в буферном растворе равна 0,2 моль/л, а сульфата аммония — 0,05 моль/л. Рассчитайте буферную емкость этого раствора по кислоте и по основанию. Сравните значения и дайте необходимые пояснения.
