
Адсорбция из раствора на твердом адсорбенте
.docАдсорбция из раствора на твердом адсорбенте.
Цель занятия:
1. Проводить качественные опыты по адсорбции.
2. Количественно характеризовать зависимость степени адсорбции от концентрации адсорбтива.
3. Обрабатывать результаты опытов, делая обобщения и выводы.
Воспитательная цель:
привить умение пользоваться справочной литературой, аккуратное и экономное отношение к химическим реактивам и посуде.
Значение темы:
Адсорбция в широком смысле этого слова- это процесс самопроизвольного изменения концентрации веществ на поверхности раздела фаз. Гетерогенные системы чрезвычайно широко распространены в природе, промышленности и, естественно, их существованию сопутствуют процессы адсорбции. Так, например, процесс любого гетерогенного катализа начинается с адсорбции субстрата на активных центрах фермента. Это в одинаковой степени относится как к промышленному, так и к ферментативному катализу. Достаточно сказать, что фотосинтез начинается с адсорбции углекислого газа. Адсорбция лежит в основе таких промышленных процессов, как улавливание ценных паров и газов; осветления вин, сахара, глюкозы, фармакологических препаратов, нефтепродуктов; крашение волокон; флотационное обогащение руд, препаративная хроматография.
Трудно переоценить биологическую роль адсорбционных процессов. В качестве примеров можно назвать следующие явления: различная адсорбируемость токсинов, сопровождающая избирательным поражением органов; абсолютная избирательность взаимодействия «антитело-антиген», поражение ядами активных ферментов (например, отравление тяжелыми металлами, цианидами, монооксидами углерода); транспорт белками крови адсорбированных ими витаминов, гормонов, металлов, перенос кислорода гемоглобином, аминокислот эритроцитами и т.д. Действие ряда фармакологических препаратов связано с явлением адсорбции. Это, например, карболен (активированный уголь), применяющийся при отравлениях; гемодез и полиглюкин (кровезаменитель и дезинтоксикационный препарат).
Необходимый исходный уровень знаний и умений студентов.
Студенты должны знать:
1. Второй закон термодинамики и его следствия.
2. Полярные и неполярные группы.
3. Межмолекулярное взаимодействие.
4. Основы метода нейтрализации.
Студенты должны уметь:
1. Определять концентрацию кислоты методом нейтрализации.
2. Производить необходимые расчеты.
3. Делать выводы на основании полученных результатов.
Учебно-целевые вопросы.
1. Поверхностная энергия.
2. Следствие второго начала термодинамики о самопроизвольном уменьшении системой поверхностной энергии.
3. Возникновение поверхностного натяжения.
4. Поверхностно-активные вещества (ПАВ). Моющее действие ПАВ и биологическая роль. Правило Траубе. Закон Гиббса.
5. Адсорбция. Теория адсорбции (Ленгмюра, Поляни, БЭТ).
6. Избирательная и ионообменная адсорбция.
7. Биологическое значение адсорбции и ее практическое применение.
Практическая часть.
Адсорбцией называется изменение концентрации какого-либо вещества в поверхностном слое по сравнению с объемной фазой, отнесенной к единице поверхности этого слоя. Адсорбция наблюдается на поверхности раздела фаз: твердое вещество- жидкость, твердое вещество- газ, жидкость – жидкость.
адсорбирующего вещества можно использовать уравнение Гиббса, устанавливающее связь между величиной адсорбции Г, концентрацией С и уменьшением поверхностного с ростом концентрации адсорбтива:
Г=- С/RT∙ dG/dс (1)
График Г=f(с) при Т=const (изотерма адсорбции) имеет вид кривой, которая выходит из начала координат и возрастает с увеличением концентрации сначала быстро, а затем всё медленнее и медленнее, так что кривая асимптотически приближается к некоторой прямой, параллельной оси абсцисс:
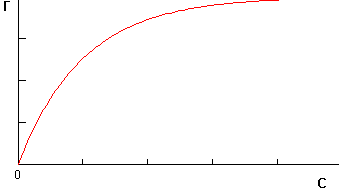
Рис.1
Уравнение Гиббса в принципе применимо ко всем случаям адсорбции; однако на практике оно применимо лишь к системам жидкость-газ, в которых поверхностное натяжение G легко поддается измерению. Когда же дело имеет с практически важной адсорбцией на твердых поверхностях, для которых отсутствуют методы непосредственного определения G, пользуются другими уравнениями, например, уравнением Ленгмюра:
Г=Г∞∙ КС/1+КС (2)
где Г- величина адсорбции ;
Г∞- предельное количество адсорбирующего вещества;
С- равновесная концентрация растворенного вещества после адсорбции, моль/л;
к – константа равновесия, равная отношению констант скоростей адсорбции и десорбции.
Некоторые случаи адсорбции на твердых, особенно пористых поверхностях, которые не могут быть описаны ни уравнением Гиббса, ни уравнением Фрейндлиха:
Г=βxсα (3)
где Г- количество вещества в миллимолях, адсорбированного граммом твердого адсорбтива;
С- равновесная концентрация растворенного вещества после адсорбции, моль/л;
β и α – константы, причем α всегда меньше единицы.
Построенная по уравнению (3) кривая Г=f(с) отличается от изотермы Гиббса и Ленгмюра тем, что лишена начального участка и не дает предельного значения адсорбции. Другими словами, уравнение Фрейндлиха справедливо только в интервале средних концентраций.
Лабораторная работа.
Адсорбция уксусной кислоты на угле.
Реактивы и оборудование:
Растворы: уксусная кислота – 0,4н; 0,5 н;
Оборудование: кол-во штук из расчета на двух студентов:
Колбы плоскодонные конические 100мл – 10 шт;
Фильтры- 10 шт;
Пробирки- 10шт;
Воронки- 2 шт;
Штативы с бюретками- 6 шт;
Пипетки на 10мл - 6 шт.
Цель работы:
1. Изучить адсорбцию уксусной кислоты на твердом адсорбенте-угле. Построить изотерму адсорбции по данным опыта.
2. Определить предельное значение удельной адсорбции, используя уравнение Ленгмюра и постоянную «К» этого уравнения.
3. Вычислить удельную поверхность твердого адсорбента.
Ход работы.
Разбавлением 0,4 н раствора уксусной кислоты приготовить растворы концентраций, указанных в таблице №1.
Приготовление исходных растворов.
|
№ колб |
1 |
2 |
3 |
4 |
|
Концентрация кислоты |
0,4н |
0,2н |
0,1н |
0,05н |
|
Объем растворов, мл |
20 |
10 |
5 |
2,5 |
|
Объем воды, мл |
0 |
10 |
15 |
17,5 |
Для определения точных значений полученных концентраций кислоты Со из каждой колбы отбирают пипеткой по 5 мл полученного раствора и титруют 0,1н раствором NаОН в присутствии фенолфталеина до устойчивой розовой окраски.
Концентрация кислоты определяется по формуле:
С=СNаОН∙ VNаОН / Vк-ты = 0,1 ∙ VNаОН / 5, (1)
Где СNаОН – концентрация щелочи;
VNаОН - объем щелочи, пошедший на титрование;
Vк-ты - Объем кислоты, взятой на титрование, в нашем случае 5 мл.
Для определения величины адсорбции в 4 пробирки, в которых находится по 15 мл полученных растворов кислоты, вносят по 0,5 г адсорбента активированного угля, встряхивают в течении 10-15 минут. Затем раствор отфильтровывают через складчатый фильтр. Определяют точную концентрацию кислоты после адсорбции (С) титрованием 0,1н раствором NаОН.
По данным опыта рассчитывают удельную адсорбцию:
Г ' = x/m= (Со-С)∙V/m (г)
где Г ' = x/m – удельная адсорбция из опыта;
Со - концентрация кислоты до адсорбции;
С - равновесная концентрация кислоты после адсорбции;
V – объем кислоты (в нашем случае 15 мл);
m – навеска угля 0,5 г.
Полученные экспериментальные данные, а также результаты вычислений внести в таблицу №2
Результаты эксперимента.
Таблица №2
|
№ колб |
Со |
Vср (из 3-х) |
С |
Г ' = x/m |
С/ Г ' |
Г '∞ |
К |
S, см2 |
|
|
|
|
|
|
|
|
|
|
Обработка результатов эксперимента:
1. Используя полученные данные, построить изотерму адсорбции Г=f(с),
где С- равновесная концентрация кислоты после адсорбции (рис.1).
2. По уравнению Ленгмюра
Г=Г∞∙ КС/1+КС
Рассчитать значение предельной удельной адсорбции и константу «К». Для этого можно применить графический метод.
Преобразовав уравнение Ленгмюра в уравнение прямой:
С/Г=С/Г∞ + 1/КГ∞
где 1/Г∞ = const; 1/КГ∞ = const;
Построим график С/Г= f(с), откладывая на оси абсцисс значения концентраций С, а на оси ординат величины С/Г (рис2).

Рис2.
Котангенс угла α, образуемого этой прямой с осью абсцисс, равен Г∞, отрезок оа = 1/КГ∞ , откуда можно найти значение «К», подставляя сюда значение Г∞, Котангенс угла находят из графика как отношение прилежащего катета к противолежащему, взяв величины катетов с учетом масштабов.
3. Зная Г∞, вычисляем удельную поверхность адсорбента, выражая ее в см2/г по формуле:
Sуд.= Г∞∙Nа ∙q
где Nа – число Авогадро (6,02 ∙1023);
q – площадь поперечного сечения молекул ПАВ (q= 25∙ 10-16 см2)
