
- •48.Закон кирхгофа и его следствия.
- •49.Инфракрасное и ультрафиолетовое излучения, их свойства и применение в медицинской практике.
- •Обеззараживание ультрафиолетовым (уф) излучен стерилизация воздуха и твёрдых поверхностей, дезинфекция питьевой воды
- •50.Элементы квантовой механики. Волновые свойства движущихся микрочастиц. Длина волны де Бройля. Дифракция электронов.
- •51.Оптические спектры атомов. Спектр атома водорода. Молекулярные спектры.
- •52.Понятие об индуцированном излучении света. Оптические квантовые генераторы (лазеры) и их применение в медицине
- •53.Люминесценция. Виды люминесценции. Флюоресценция, фосфоресценция. Правило Стокса. Квантовый выход люминесценции. Закон Вавилова.
- •54.Люминесценция биологических систем. Безизлучательный переход. Люминесцентный анализ. Люминесцентные метки и зонды и их применение.
- •55.Рентгеновские лучи и их свойства. Простейшая рентгеновская трубка. Тормозное рентгеновское излучение и его спектр.
- •Характеристическое рентгеновское излучение
- •56. Рентгеновские лучи и их свойства. Простейшая рентгеновская трубка. Характеристическое рентгеновское излучение и его спектр.
- •57.Взаимодействие рентгеновского излучения с веществом. Применение рентгеновского излучения в медицине. Понятие о рентгеноструктурном анализе.
- •6. Использование рентгеновского излучения в медицине
- •58.Радиоактивность. Закон радиоактивного распада. Активность радиоактивных препаратов.
- •59.Виды радиоактивного распада.
- •60-61А . Взаимодействие радиоактивного излучения с веществом. Его ионизирующая и проникающая способность. Ослабление радиоактивного излучения при прохождении через вещество.
- •В медицине
- •Для получения картины внутренних органов и скелета используют рентгенография, рентгеноскопия, компьютерная томография.
- •62.Дозиметрия. Поглощенная, экспозиционная, эквивалентная и эффективная эквивалентная дозы. Мощность дозы.
- •63.Детекторы ионизирующего излучения. Дозиметры.
- •64.Структура и основные функции биомембран. Модельные липидные мембраны.
- •65.Физическое состояние липидов в мембране и методы исследования мембран (ямр, эпр, метод флюоресцентых и спиновых зондов, электронная микроскопия, ик – спектроскопия, рентгеноструктурный анализ).
- •66.Транспорт веществ через биологические мембраны. Явление переноса. Общее уравнение переноса.
- •67. Пассивный транспорт. Диффузия. Простая и облегченная диффузия, осмос, фильтрация.
- •68.Физические методы изучения переноса веществ через мембраны
- •69.Активный транспорт. Молекулярная организация мембранной системы активного транспорта на примере натрий-калиевого насоса.
- •70.Биопотенциалы покоя. Механизм их возникновения.
- •71. Биопотенциал действия. Механизм его возникновения.
Обеззараживание ультрафиолетовым (уф) излучен стерилизация воздуха и твёрдых поверхностей, дезинфекция питьевой воды
50.Элементы квантовой механики. Волновые свойства движущихся микрочастиц. Длина волны де Бройля. Дифракция электронов.
Применение модели строения атомов, предложенной в 1913 году Н. Бором (датч.), к многоэлектронным атомам, показало, что эта теория несостоятельна и требуется новый, отличный от законов классической механики подход к изучению условий движения электронов в атоме. Первый шаг в этом направлении сделал в 1924 году французский физик Луи де Бройль. Развивая принцип корпускулярно-волнового дуализма, де Бройль утверждал: не только фотоны, но и любые другие частицы материи, в том числе и электроны, наряду с корпускулярными обладают также и волновыми свойствами.
Согласно
де Бройлю с каждым микрообъектом
связываются, с одной стороны, корпускулярные
характеристики (энергия ε и импульс
р), а с другой – волновые параметры
(частота νБ
и длина волны λБ).
Количественные соотношения, связывающие
эти величины, такие же, как и для
фотонов: р =
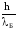 (1) и ε = hνБ
(1) и ε = hνБ
Т.о.
любой частице, обладающей импульсом
р = mυ,
соответствует
волновой процесс с длиной волны. 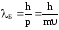 .
(2)
.
(2)
Найдём зависимость дебройлевской длины волны электрона ускоренного электрическим полем от величины ускоряющего напряжения U. Изменение кинетической энергии электрона равно работе электростатических сил:
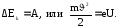 (3)
(3)
Выразим отсюда скорость υ и подставим в (2), получим:
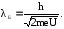 (4)
(4)
Например, электронам ускоренным электрическим полем с разностью потенциалов от 1 до 104 В, что имеет место в электровакуумных приборах (электроннолучевая трубка), соответствуют дебройлевские длины волн от 1 до 0,01 нм. По шкале электромагнитных волн это диапазон рентгеновского излучения. Следовательно, если пучок таких электронов направить на кристалл, то он должен дифрагировать подобно рентгеновскому излучению. И действительно, проверяя гипотезу де Бройля, в 1927 году американские физики К. Девиссон и Л. Джермер направили на кристалл никеля пучок электронов, который после рассеяния дал четкую дифракционную картину (рис.1а). Расчет длины волны по положениям дифракционных максимумов дал значение, совпадающее с длинной волны, вычисленной по формуле (2). На рис 1б приведена полученная в аналогичных условиях рентгенограмма. Сходство обеих картин очевидно.
Волны де Бройля не связаны с каким-либо колебательным процессом. Они только лишь характеризуют волновые свойства движущихся частиц, в том числе и макроскопических тел. Однако для тел большой массы длина волны де Бройля настолько мала, что ее невозможно обнаружить никакими современными приборами.
51.Оптические спектры атомов. Спектр атома водорода. Молекулярные спектры.
Атомные спектры – спектры испускания и поглощения, которые возникают при квантовых переходах между уровнями свободных или слабо взаимодействующих атомов. Под оптическими атомными спектрами будем понимать те, которые обусловлены переходами между уровнями внешних электронов с энергией фотонов порядка нескольких электрон-вольт. Сюда относятся ультрафиолетовая, видимая и близкая инфракрасная области спектров. В спектре можно выделить группы линий, называемые спектральными сериями.В УФ обл. расположена серия Лаймана, которая обр. при переходе верхних энергетических уровней на самый нижний, основной.
В видимой и близкой УФ областях спектра расположена серия Бальмера, кот. возникает в рез. Перехода с верхних энерг. уровней на второй.(n=2)
В ИК обл. расп. серия Пашена, кот. возник. при переходах с верхн. энерг. уровн. на третий.(n=3)
Может показаться, что спектр атомарного водорода не ограничен со стороны малых частот,т.к. энергетич. ур. По мере увеличения n становятся сколь угодно близкими. Однако вероятность перехода между такими уровнями столь мала, что практически эти переходы не наблюдаются.
Молекулярные спектры возникают при квантовых переходах молекул с одного энергетического уровня на другой и состоят из совокупности более или менее широких полос, которые представляют собой тесно расположенные линии. Сложность молекулярных спектров по сравнению с атомными обусловлена большим разнообразием движений и, следовательно, энергетич. переходов в молекуле, чем в атоме.
Для объяснения молек. спектров необх. Представить полную энергию молекулы как сумму значний энергии, присущих движению электронов в атомах, колебаниям атомов и вращению молекулы как целого:
Е= Еэл+Екол+Евр.
