- •2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот по химическому строению радикалов
- •3. Классификация аминокислот по растворимости их радикалов в воде
- •2.Характеристика пептидной связи
- •4. Вторичная структура белков. Связи стабилизирующие вторичную структуру.
- •1. Классификации шаперонов (ш)
- •2. Роль шаперонов в фолдинге белков
- •8 . Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, гидротация и ионизация. Денатурация, признаки и факторы ее вызывающие.
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и
- •13. Классификация и номенклатура ферментов, примеры
- •1. Оксидоредукпшзы
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр, в2 на примере трансаминаз и дегидрогеназ.
- •17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное)
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов.
- •21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц. Инициация процесса. Элонгация, терминация, транскрипция.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •34. Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-рнк синтетазы т-рнк, рибосомы, источник энергии, белковые факторы, ферменты.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •40. Всасывание продуктов переваривания. Транспорт ак в клетки кишечника. Особенности транспорта ак в гепатоцитах. Y-глутамильный цикл. Нарушение переваривания и всасывания ак.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •43. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная ассиметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Трансмембранная асимметрия липидов
- •3. Жидкостностъ мембран
- •4. Функции мембранных липидов
- •45. Механизм переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •46. Эндергонические и экзергонические реакции живой клетки. Макроэргические соединения, определение, пример.
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Цепь переноса электронов от nadh и fadh2 на кислород
- •50. Образование активных форм кислорода(синглетный кислород, пероксид водорода, гидроксильный радикал). Место образоваия, схемы реакций. Физиологическая роль афк.
- •51. Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1. Строение пируватдегидрогеназного комплекса
- •2. Окислительное декарбоксилирование пирувата
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1. Реакции анаэробного гликолиза
- •60. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена. Обмен гликогена в анте- и неонатальном периоде.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов, эссенциальная фруктоземия. Гликогенозы и агликогенозы.
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы.
- •65. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метобализма жира.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •1. Синтез и биологическая роль серотонина
- •1. Окислительное дезаминирование
- •2. Непрямое дезаминирование (трансдезаминирование)
- •3. Неокислительное дезамитровате
- •1. Метаболизм феиилаланина
- •2. Особенности обмена тирозина в разных тканях
- •3. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормони фолликулостимулирующий гормон
- •3. Группа гормонов, образующихсяиз проопиомеланокортина
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Изменения метаболизма в печени в абсорбтивном периоде
- •2. Изменения метаболизма в адипоцитах
- •3. Изменение метаболизма в мышцах в абсорбтивном периоде
- •1. Изменения метаболизма в печени
- •2. Изменения метаболизма в жировой ткани
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
- •3. Энзимодиагностика при инфаркте миокарда
- •1. Простые белки
- •1. Безмиелиновое волокно
- •2. Миелиновое волокно
3. Энзимодиагностика при инфаркте миокарда
Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови - основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение
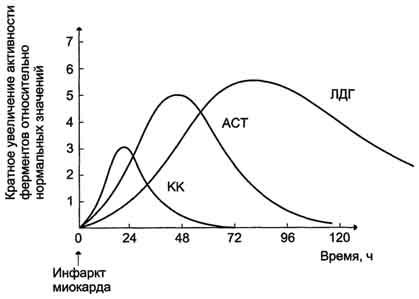
Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда.
122
2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена.
Коллаген - основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме, т.е. -6% массы тела. Название "коллаген" объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани. Например, в пластинчатой костной ткани, из которой построено большинство плоских и трубчатых костей скелета, коллагеновые волокна имеют строго ориентированное направление:
687
продольное - в центральной части пластинок, поперечное и под углом - в периферической. Это способствует тому, что даже при расслоении пластинок фибриллы одной пластинки могут продолжаться в соседние, создавая таким образом единую волокнистую структуру кости. Поперечно ориентированные коллагеновые волокна могут вплетаться в промежуточные слои между костными пластинками, благодаря чему достигается прочность костной ткани. В сухожилиях коллаген образует плотные параллельные волокна, которые дают возможность этим структурам выдерживать большие механические нагрузки. В хрящевом матриксе коллаген образует фибриллярную сеть, которая придаёт хрящу прочность, а в роговице глаза коллаген участвует в образовании гексагональных решёток десцеметовых мембран, что обеспечивает прозрачность роговицы, а также участие этих структур в преломлении световых лучей. В дерме фибриллы коллагена ориентированы таким образом, что формируют сеть, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней), а в заживающей ране они агрегированы весьма хаотично. Аминокислотный состав и конформация коллагена описаны в подразделе "Фибриллярные белки" раздела 1.
Здесь будут разобраны синтез и созревание коллагена, структуры, которые он образует, и их функции, а также заболевания, связанные с нарушением этих процессов.
Полиморфизм коллагена
Коллаген - ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определённой формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными α-цепями, их формулы, соответственно [α1(II)]3 и [α1(III)]3; коллагены I и IV типов являются гетеротримерами и образуются обычно двумя разными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей. Распределение коллагенов по органам и тканям представлено в табл. 15-1.
Гены коллагена называются соответственно типам коллагена и записываются арабскими цифрами, например COL1 - ген коллагена I типа, COL2 - ген коллагена II типа, COL7 - ген коллагена VII типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид a-цепи). Например, COL1A1 и COL1A2 кодируют, соответственно, α1 и α2-цепи коллагена I типа.
А. Этапы синтеза и созревания коллагена
Синтез и созревание коллагена - сложный многоэтапный процесс, начинающийся в клетке, а завершающийся в межклеточном матриксе. Синтез и созревание коллагена включают в себя целый ряд посттрансляционных изменений (рис. 15-1):
гидроксилирование пролина и лизина с образованием гидроксипролина (Hyp) и гидроксилизина (Hyl);
гликозилирование гидроксилизина;
частичный протеолиз - отщепление "сигнального" пептида, а также N- и С-конце-вых пропептидов;
образование тройной спирали.
Синтез полипептидных цепей коллагена
Полипептидные цепи коллагена синтезируются на полирибосомах, связанных с мембранами ЭР, в виде более длинных, чем зрелые цепи, предшественников - препро-α-цепей. У этих предшественников имеется гидрофобный "сигнальный" пептид на N-конце, содержащий около 100 аминокислот.
Основная функция сигнального пептида - ориентация синтеза пептидных цепей в полость ЭР. После выполнения этой функции сигнальный пептид сразу же отщепляется. Синтезированная молекула проколлагена содержит дополнительные участки - N- и С-концевые пропептиды, имеющие около 100 и 250 аминокислот, соответственно. В состав пропептидов входят остатки цистеина, которые образуют внутри- и межцепочечные (только в С-пептидах) S-S-связи. Концевые пропептиды не образуют тройную спираль, а формируют глобулярные домены. Отсутствие N- и С-
688
Таблица 15-1. Распределение коллагена в тканях и органах
|
Типы |
Гены |
Ткани и органы |
|
I |
COL1A1, COL1A2 |
Кожа, сухожилия, кости, роговица, плацента, артерии, печень, дентин |
|
II |
COL2A1 |
Хрящи, межпозвоночные диски, стекловидное тело, роговица |
|
III |
COL3A1 |
Артерии, матка, кожа плода, строма паренхиматозных органов |
|
IV |
COL4A1-COL4A6 |
Базальные мембраны |
|
V |
COL5A1-COL5A3 |
Минорный компонент тканей, содержащих коллаген I и II типов (кожа, роговица, кости, хрящи, межпозвоночные диски, плацента) |
|
VI |
COL6A1-COL6A3 |
Хрящи, кровеносные сосуды, связки, кожа, матка, лёгкие, почки |
|
VII |
COL7A1 |
Амнион, кожа, пищевод, роговица, хорион |
|
VIII |
COL8A1-COL8A2 |
Роговица, кровеносные сосуды, культуральная среда эндотелия |
|
IX |
COL9A1-COL9A3 |
Ткани, содержащие коллаген II типа (хрящи, межпозвоночные диски, стекловидное тело) |
|
X |
COL10A1 |
Хрящи (гипертрофированные) |
|
XI |
COL11A1-COL11A2 |
Ткани, содержащие коллаген II типа (хрящи, межпозвоночные диски, стекловидное тело) |
|
XII |
COL12A1 |
Ткани, содержащие коллаген I типа (кожа, кости, сухожилия и др.) |
|
XIII |
COL13A1 |
Многие ткани |
|
XIV |
COL14A1 |
Ткани, содержащие коллаген I типа (кожа, кости, сухожилия и др.) |
|
XV |
COL15A1 |
Многие ткани |
|
XVI |
COL16A1 |
Многие ткани |
|
XVII |
COL17A1 |
Гемидесмосомы кожи |
|
XVIII |
COL18A1 |
Многие ткани, например печень, почки |
|
XIX |
COL19A1 |
Клетки рабдомиосаркомы |
концевых пептидов в структуре проколлагена нарушает правильное формирование тройной спирали.
Посттрансляционные модификации коллагена
Гидрокслирование пролина и лизина. Роль витамина С
Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют ок-сигеназы, связанные с мембранами микросом. Пролиловые и лизиловые остатки в Y-положении пептида (Гли-х-у)n подвергаются действию, соответственно, пролил-4-гидроксилазы и лизил-5-гидроксилазы. Пролил-3-гидроксилаза действует на некоторые остатки пролина в Х-положениях. Необходимыми компонентами этой реакции являются оскетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2, второй атом О2 включается в сукцинат, который образуется при декарбоксилировании α-кетоглутарата, а из карбоксильной группы а-кетоглутарата образуется СО2 (см. схему А на с. 691).
Гидроксилазы пролина и лизина содержат в активном центре атом железа Fe2+. Для сохранения атома железа в ферроформе необходим восстанавливающий агент. Роль этого агента выполняет кофермент гидроксилаз - аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту. Обратное превращение происходит в ферментативном процессе за счёт восстановленного глутатиона (см. схему Б на с. 691).
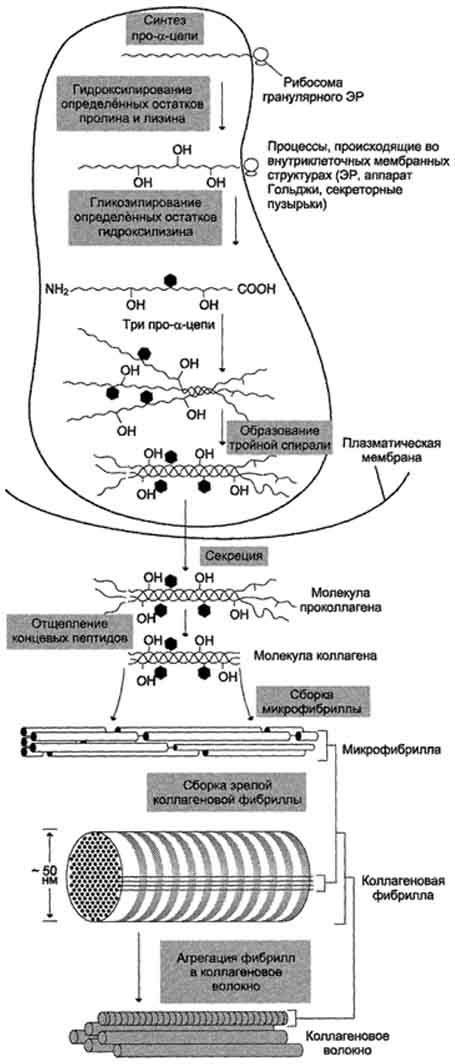
Рис. 15-1. Синтез и созревание коллагена.
690
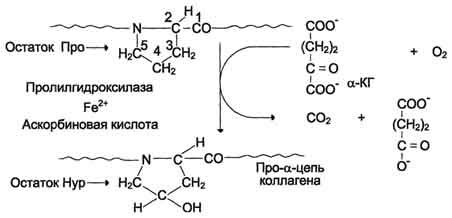
Схема А

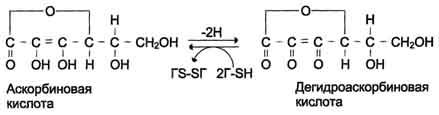
Схема Б

Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина (Hyp) участвуют в образовании водородных связей. А гидроксилирование лизина очень важно для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл. При цинге - заболевании, вызванном недостатком витамина С, нарушается гидроксилирование остатков пролина и лизина. В результате этого образуются менее прочные и стабильные коллагеновые волокна, что приводит к большой хрупкости и ломкости кровеносных сосудов с развитием цинги. Клиническая картина цинги характеризуется возникновением множественных точечных кровоизлияний под кожу и слизистые оболочки, кровоточивостью дёсен, выпадением зубов, анемией.
Гликозилирование гидроксилизина
После завершения гидроксилирования при участии специфических гликозилтрансфераз в состав молекулы проколлагена вводятся углеводные группы. Чаще всего этими углеводами служат галактоза или дисахарид галактозилглюкоза (рис. 15-2).
Они образуют ковалентную О-гликозидную связь с 5-ОН-группой гидроксилизина. Гликозилирование гидроксилизина происходит в коллагене, ещё не претерпевшем спирализации, и завершается после образования тройной спирали. Число углеводных единиц в молекуле коллагена зависит от вида ткани. Так, например, в коллагене сухожилий (тип I) это число равно 6, а в коллагене капсулы хрусталика (тип IV) - НО. Роль этих углеводных групп неясна; известно только, что при наследственном заболевании, причиной которого является дефицит лизилгидроксилазы (синдром Элерса - Данло-Русакова, тип VI), содержание гидроксилизина и углеводов в образующемся коллагене снижено; возможно, это является причиной ухудшения механических свойств кожи и связок у людей с этим заболеванием.
Образование проколлагена и его секреция в межклеточное пространство
После гидроксилирования и гликозилирования каждая про-α-цепь соединяется водородными связями с двумя другими про-α-цепями, образуя тройную спираль проколлагена. Эти процессы происходят ещё в просвете ЭР и начинаются
691

Рис. 15-2. Углеводные компоненты коллагена.
после образования межцепочечных дисульфидных мостиков в области С-концевых пропептидов. Из ЭР молекулы проколлагена перемещаются в аппарат Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство.
Образование тропоколлагена. Болезни, связанные с нарушениями этого процесса
В межклеточном матриксе концевые пропептиды коллагенов I, II и III типов отщепляются специфическими проколлагенпептидазами, в результате чего образуются молекулы тропоколлагена, которые и являются структурной единицей коллагеновых фибрилл. При снижении активности этих ферментов (синдром Элерса - Данло - Русакова, тип VII) концевые пропептиды проколлагена не отщепляются, вследствие чего нарушается образование тропоколлагена и далее нарушается образование нормальных коллагеновых фибрилл. Нити коллагена видны под микроскопом в виде дезорганизованных пучков. Клинически это проявляется малым ростом, искривлением позвоночника, привычными вывихами суставов, высокой растяжимостью кожи.
У коллагенов некоторых типов (IV, VIII, X) концевые пропептиды не отщепляются. Это связано с тем, что такие коллагены образуют не фибриллы, а сетеподобные структуры, в формировании которых важную роль играют концевые N- и С-пептиды.
100. Структурная организация межклеточного матрикса. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Строение и функции гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфатов, гепарина). Структура протеогликанов.
Как уже говорилось, межклеточный матрикс представляет собой супрамолекулярный комплекс, образованный сложной сетью связанных между собой макромолекул. В организме человека межклеточный матрикс формирует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, а также (при вторичном отложении фосфата кальция) кости и зубы.
Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса.
Aдгезивные белки
К первой группе белков с выраженными адгезивными свойствами относят фибронектин, ламинин, нидоген, фибриллярные коллагены и коллаген IV типа; их относят к белкам "зрелой" соединительной ткани.
Фибронектин
Фибронектин - один из ключевых белков межклеточного матрикса, неколлагеновый структурный гликопротеин, синтезируемый и выделяемый в межклеточное пространство многими клетками. Он построен из двух идентичных полипептидных цепей, соединённых дисульфидными мостиками у своих С-концов (рис. 15-19).
Полипептидная цепь фибронектина содержит 7-8 доменов, на каждом из которых расположены специфические центры для связывания разных веществ. Фибронектин может связывать
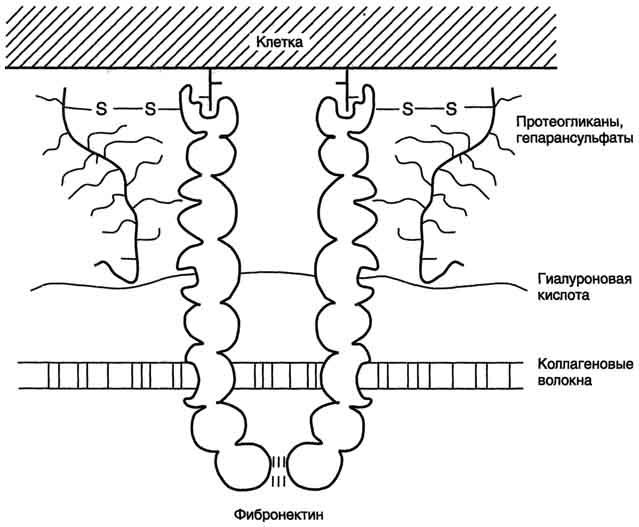
Рис. 15-19. Строение фибронектина.
коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин, фермент трансглутаминазу. Благодаря своей структуре фибронектин может выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток.
Существует несколько форм фибронектина, которые синтезируются разными клетками. Растворимый, или плазменный, фибронектин синтезируется гепатоцитами. Нерастворимый, или тканевый фибронектин синтезируется в основном фибробластами или эндотелиоцитами, глиоцитами и эпителиальными клетками.
Обе формы фибронектина вовлекаются в разнообразные процессы: способствуют адгезии и распространению эпителиальных и мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах. Это связано с тем, что каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления (от англ. attach - прикреплять proteins): талин, винкулин, α-актинин (рис. 15-20).
С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного
713
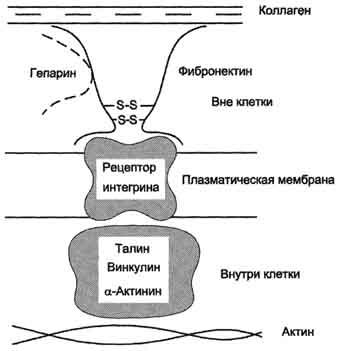
Рис. 15-20. Схема взаимодействия фибронектина с интегрином.
матрикса внутрь клетки, а также в обратном направлении - из клетки наружу, таким образом влияя на протекающие в клетке процессы.
Известно также, что фибронектин участвует в миграции клеток, которые могут присоединяться к его RGD-участкам, и, таким образом, фибронектин как бы помогает им перемещаться в межклеточном матриксе.
В межклеточном матриксе, окружающем трансформированные (или опухолевые) клетки, количество фибронектина заметно снижено, что может быть одной из причин появления метастазов.
Ламинин - наиболее распространённый некол-лагеновый гликопротеин базальных мембран. Он состоит из трёх полипетидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трёхцепочечной ветвью (рис. 15-21). Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры связывания для различных веществ. Ламинин взаимодействует со всеми структурными компонентами базальных мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Кроме того, молекула ламинина имеет несколько центров связывания с клетками. Главные функции ламинина определяются его способностью связывать клетки и модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток.
Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
Гликозаминогликаны - линейные отрицательно заряженные гетерополисахариды. РаНbше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны - высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Протеогликаны отличаются от большой группы белков, которые называют гликопротеинами. Эти белки тоже содержат олигосахаридные цепи разной длины, ковалентно
Рис. 15-13. Разрушение лёгочных альвеол эластазой нейтрофилов.
703
присоединённые к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков - ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов - коллаген и эластин, иммуноглобулины, ангиотензиноген, трансферрин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон.
Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие функции:
они являются структурными компонентами межклеточного матрикса;
протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na+, K+, Са2+) и таким образом участвовать в формировании тургора различных тканей;
протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов;
гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах;
гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
гепарин - антикоагулянт;
гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.
А. Строение и классы гликозаминогликатов
Гликозаминогликаны представляют собой длинные неразветвлённые цепи гетерополиса-харидов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), вторым мономером - производное аминосахара (глюкоз- или галактозамина). NH2-rpynna аминосахаров обычно ацетилирована, что приводит к исчезновению присущего им положительного заряда. Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата.
В настоящее время известна структура шести основных классов гликозаминогликанов, которые представлены в табл. 15-4.
Гиалуроновая кислота находится во многих органах и тканях. В хряще она связана с белком и участвует в образовании протеогликановых агрегатов, в некоторых органах (стекловидное тело глаза, пупочный канатик, суставная жидкость) встречается и в свободном виде. Предполагается, что в суставной жидкости гиалуроновая кислота выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.
Повторяющаяся дисахаридная единица в гиалуроновой кислоте имеет следующую структуру:

704
Таблица 15-4. Структура различных классов гликозаминогликанов
|
Класс гликозаминогликанов |
Компоненты, входящие в состав дисахаридных единиц |
Структура гликозаминогликанов |
|
Гиалуроновая кислота |
1. D-глюкуроновая кислота 2. К-ацетил-D-глюкозамин |
D-глюкуроновая кислота (β1→3) |
|
|
|
N-ацетилглюкозамин ( β1 → 4) |
|
|
|
D-глюкуроновая кислота (β1 → 3) |
|
|
|
N-ацетилглюкозамин (β1 → 4) |
|
Хондроитин-4-сульфат (хондроитинсульфат А) |
1. D-глюкуроновая кислота 2. К-ацетил-В-галактозамин-4- сульфат |
D-глюкуроновая кислота (β1 → 3) |
|
|
|
N-ацетил-галактозамин-4-сульфат (β1 → 4) |
|
|
|
D-глюкуроновая кислота (β1 → 3) |
|
|
|
N-ацетилгалактозамин-4-сульфат (β1 → 4) |
|
Хондроитин-6-сульфат (хондроитинсульфат С) |
1 . D-глюкуроновая кислота 2. М-ацетил-D-галактозамин-6-сульфат |
D-глюкуроновая кислота (β1→ 3) |
|
|
|
N-ацетилгалактозамин-6-сульфат (βl → 4) |
|
|
|
D-глюкуроновая кислота (βl → 3) |
|
|
|
N-ацетилгалактозамин-6-сульфат (β1 → 4) |
|
Дерматансульфат1 |
1 . L-идуроновая кислота 2. N-ацетил-D-галактозамин-4-сульфат |
L-идуроновая кислота (β1 → 3) N-ацетилгалактозамин-4-сульфат (β1 → 4) |
|
|
|
L-идуроновая кислота (β1 → 3) |
|
|
|
N-ацетилгалактозамин-4-сульфат (β1 → 4) |
|
Кератансульфат |
1. D-галактоза 2. N-ацетил-В-галактозамин-6-сульфат |
D-галактоза (β1 → 4) N-ацетилглюкозамин (β1 → 3) |
|
|
|
D-галактоза (βl → 4) |
|
|
|
N-ацетилглюкозамин-6-сульфат (β1 → 3) |
|
Гепарансульфат2 |
1. D-глюкуронат-2-сульфат 2. К-ацетил-0-галактозамин-6-сульфат |
D-глюкуронат-2-сульфат (αl → 4) N-ацетилглюкозамин-6-сульфат (αl → 4) |
|
|
|
D-глюкуронат-2-сульфат (βl → 4) N-ацетилглюкозамин-6-сульфат (α1 → 4) |
1 В состав дисахаридной единицы может входить D-глюкуроновая кислота.
2 Может содержать N-сульфопроизводное глюкозамина вместо N-ацетилглюкозамина и различное количество идуроновой и глюкуроновой кислот.
705
Гиалуроновая кислота содержит несколько тысяч дисахаридных единиц, молекулярная масса её достигает 105 - 107 Д.
Хондроитинсульфаты - самые распространённые гликозаминогликаны в организме человека; они содержатся в хряще, коже, сухожилиях, связках, артериях, роговице глаза. Хондроитинсульфаты являются важным составным компонентом агрекана - основного протеогликана хрящевого матрикса. В организме человека встречаются 2 вида хондроитинсульфатов: хондроитин-4-сульфат и хондроитин-6-сульфат. Они построены одинаковым образом, отличие касается только положения сульфатной группы в молекуле N-ацетилгалактозамина (см. схему А).
Одна полисахаридная цепь хондроитинсульфата содержит около 40 повторяющихся дисахаридных единиц и имеет молекулярную массу 104 - 106 Д.
Кератансульфагы - наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. Кератансульфат I находится в роговице глаза и содержит кроме повторяющейся дисахаридной единицы L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат II был обнаружен в хрящевой ткани, костях, межпозвоночных дисках. В его состав помимо Сахаров дисахаридной единицы входят N-ацетилгалактозамин, L-фукоза, D-манноза и сиаловая кислота. Кератансульфат II входит в состав агрекана и некоторых малых протеогликанов хрящевого матрикса. В отличие от других гликозаминогликанов, кератансульфаты вместо гексуроновой кислоты содержат остаток галактозы (см. схему Б).
Молекулярная масса одной цепи кератансуль-фата колеблется от 4 × 103 до 20 × 103 Д.
Дерматансульфат широко распространён в тканях животных, особенно он характерен для кожи, кровеносных сосудов, сердечных клапанов.
В составе малых протеогликанов (бигликана и декорина) дерматансульфат содержится в межклеточном
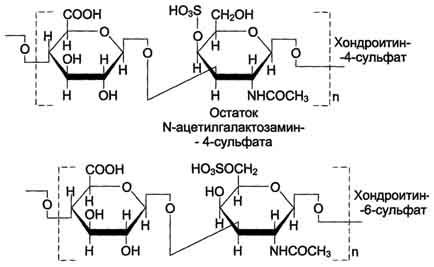
Схема А

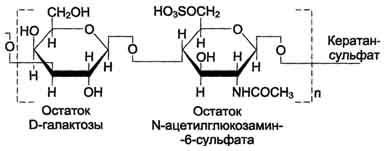
Схема Б

706
веществе хрящей, межпозвоночных дисков, менисков. Повторяющаяся дисахаридная единица дерматансульфата имеет следующую структуру (см. схему А).
Молекулярная масса одной цепи дерматансульфата колеблется от 15 × 103 до 40 × 103 Д.
Гепарин - важный компонент противосвёртывающей системы крови (его применяют как антикоагулянт при лечении тромбозов). Он синтезируется тучными клетками и находится в гранулах внутри этих клеток. Наибольшие количества гепарина обнаруживаются в лёгких, печени и коже. Дисахаридная единица гепарина похожа на дисахаридную единицу гепарансульфата. Отличие этих гликозаминогликанов заключается в том, что в гепарине больше N-сульфатных групп, а в гепарансульфате больше N-ацетильных групп. Молекулярная масса гепарина колеблется от 6 × 103 до 25 × 103 Д (см. схему Б).
Гепарансульфат находится во многих органах и тканях. Он входит в состав протеогликанов базальных мембран. Гепарансульфат является постоянным компонентом клеточной поверхности. Структура дисахаридной единицы гепарансульфата такая же, как у гепарина. Молекулярная масса цепи гепарансульфата колеблется от 5 × 103 до 12 × 103 Д.
101. Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина.
В мышечной клетке имеются миофибриллы — особым образом организованные пучки белков, располагающиеся вдоль клетки. Миофибриллы, в свою очередь, построены из белковых нитей
(филаментов) двух типов — толстых и тонких. Основным белком толстых нитей является миозин, а тонких — актин. Миозиновые и актиновые нити — главный компонент всех сократительных систем.
Электронно-микроскопическое изучение поперечных и продольных срезов мышц обнаружило строго упорядоченное расположение миоэиновых и актиновых нитей в миофибрилле. Функциональной единицей миофибриллы является саркомер — участок миофибриллы (длиной 2,5 мкм) между двумя Z-пластинками.
Саркомер включает пучок миозиновых нитей, серединой прикрепленных к М-пластинке (М-линия), и пучки актиновых нитей, прикрепленных к Z-пластинкам. Многие сотни саркомеров образуют миофибриллу.
Чередование в миофибрилле участков, содержащих толстые нити, с участками, содержащими тонкие нити (A-диски и I-диски), создает поперечную полосатость мышц.
Саркоплазма, вмещающая миофибриллы, пронизана между ними сетью цистерн и трубочек
эндоплазматического (саркоплазматического) ретикулума, а также системой поперечных трубочек, которые тесно контактируют с саркоплазматическим ретикулумом, но не сообщаются с ним.
СТРОЕНИЕ МИОЗИНОВЫХ НИТЕИ
Миозиновые нити образованы белком миозином. Миозин составляет почти половину всех белков скелетной мышцы. Молекула миозина содержит две идентичные тяжелые полипептидные цепи (молекулярная масса каждой 200 ООО) и четыре легкие цепи (молекулярная масса около 20 ООО). Каждая тяжелая цепь на большой части длины с С-конца имеет конформацию а-спирали, и обе спирали скручены друг с другом; эта часть молекулы имеет форму палочки. Противоположные концы каждой цепи (N-концы) имеют глобулярную форму, образуя ≪головки≫ молекулы. К каждой из головок нековалентно
присоединены по две легкие цепи.
Миозин катализирует гидролиз АТФ; это было установлено Энгельгардтом и Любимовой в 1939 г. Энергия гидролиза используется для сокращения мышцы. Значительно позднее выяснилось, что каталитический активный центр локализован в головках молекулы миозина. Открытие АТФазной активности миозина в высокой степени стимулировало исследования мышечного сокращения, поскольку
было первым прямым указанием на источник энергии для сокращения и на роль миозина в использовании этой энергии.
Палочкообразные хвосты молекул миозина могут соединяться друг с другом продольно, образуя пучки; головки выступают на поверхности пучка, выстраиваясь вокруг него по спирали. В области М-линии пучки стыкуются ≪хвост к хвосту≫. Так получаются миозиновые нити саркомера, каждая из которых содержит около 400 молекул миозина.
СТРОЕНИЕ АКТИНОВЫХ НИТЕЙ
В состав актиновых нитей входят белки актин, тропомиозин и тропонин. Основу нитей составляют молекулы актина. Актин — это глобулярный белок с молекулярной массой 43 ООО и шарообразными молекулами диаметром около 5 нм; такая форма актина называется G-актин (глобулярный актин). G-актин содержится и во многих немышечных клетках.
Молекулы G-актина могут нековалентно соединяться, образуя фибриллярный актин — F-актин. Форма молекул F-актина напоминает две нитки бус, скрученные друг с другом. В мышечных клетках весь актин находится в форме F-актина.
К F-актину могут присоединяться головки миозина, причем на каждой молекуле G-актина в F-актине есть центр связывания миозина. В результате такого взаимодействия в сотни раз увеличивается АТФазная активность миозина. Соединение F-актина с миозином называют актомиозином. Образование связей между миозиновыми и актиновыми нитями в саркомере имеет важное значение в процессе сокращения мышцы.
Молекулы другого белка актиновых нитей — тропомиозина — имеют форму палочек длиной 40 нм. Они располагаются вблизи желобков спиральной ленты F-актина, вдоль нее, причем каждая молекула тропомиозина соединена с семью молекулам G-актина, а концами примыкает к соседним молекулам тропомиозина.
Третий белок актиновых нитей — тропонин — имеет глобулярную форму; он построен из трех разных субъединиц. Тропонин нековалентно связан с тропомиозином и с актином; на каждую молекулу тропомиозина приходится одна молекула тропонина. Одна из субъединиц тропонина содержит Са-связывающие центры: эта субъединица по строению сходна с кальмодулином.
Тонкие нити прикреплены к Z-пластинкам, которые тоже представляют собой белковые структуры. Содержание миозина, актина, тропомиозина и тропонина в миофибриллах равно примерно 55, 25, 15 и 5 % соответственно.
102. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения. Особенности энергетического обмена в мышцах; роль креатинфосфата.
Механизм сокращения поперечнополосатой мышечной ткани
1. Разряд мотонейрона. До сокращения мышцы концентрация ионов кальция в саркоплазме составляет 10-8 –10-7 моль/л.
2. Высвобождение нейромедиатора : из нервных окончаний ® ацетилхолин
3.Связывание АХ : связывается с холинорецепторами = никотинрецепторами (одновременно являются Nа-каналами, которые открываются) ® в цитоплазму ток ионов Nа (по градиенту концентрации и градиенту заряда)® потенциал ПМ от -80 мВ до +40 мВ =деполяризация мембраны : а)-активация потенциалзависимых Nа-каналов-®---потенциал действия по трубочкам Т-системы ---мышечное сокращение; б) активация потенциалчувствительных К-каналов (ионы К+ наружу) и потенциал покоя восстанавливается.
4. Генерация потенциала действия в мышечном волокне. Меняют конформацию медленные потенциалчувствительные Са-каналы ПМ = дигидропиридинчувствительные (a1-субъединица) ®Са каналы СР (=рианодиновые RyR): 4 п/п цепи с М.м.> 2 200 кДа,
активаторы: низкие (микромолярные) концентрации Са2+, АТФ. ЖК, кофеин, полиамины, ионы тяжелых Ме,
ингибиторы: рианодин, ионы Mg 2+, Са2+ в мили/М концентрации
5. Распространение деполяризации внутрь волокна по Т-трубочкам.
6. Высвобождение ионов Са из концевых цистерн СР и их диффузия к толстым и тонким филаментам. Передача сигнала от ПМ к мембране СР реализуется в разных типах мышц через химический тип и через конформационный тип передачи сигнала. Мембраны СР содержат Са-каналы и Са-АТФ-азу, которая активируется тем кальцием, что освобождается из ретикулума через Са-каналы и взаимодействует с регуляторными белками (ТнС, кальмодулин).
7. Связывание Са с ТнС, открывающее миозин-связывающие участки актина. Концентрация Са+2 10-6 - 10-5 моль/л необходима и достаточна для образования I комплекса ТнС- Са+2.
Связывание Са+2 изменяет пространственную структуру тропонина и комплекс реагирует с ТнI и ТнТ влияя на их взаимодействие с Тм, образуя II комплекс ТнС- 4Са+2- Тм
При изменении конформации Тн открываются активные центры F-актина, который взаимодействует с «головками» миозина, образует актомиозин, обладающий АТФ-азной активностью.
8. Образование поперечных связей между актином и миозином и скольжение тонких филаментов относительно толстых, сопровождающееся укорочением волокна. Актомиозин, гидролизуя АТФ, высвобождает энергию для мышечного сокращения, что обеспечивает продвижение актина по миозину. Каждая из головок генерирует маленькое тянущее усилие (несколько пиконьютонов) ® -усилия суммируются – мышца может развивать достаточно большие напряжения.
Расслабление
Для процесса расслабления требуется энергия в виде АТФ, Mg+2-Ca+2 - АТФ-аза, находящаяся в мембране СР, активируясь под действием карнозина и анзерина, используя энергию АТФ, начинают перекачивать ионы кальция из саркоплазмы в полость цистерн.
Вследствие этого: содержание Са+2 в саркоплазме падает ниже 10-7 моль/л ; что ведёт к распаду комплексов I, II;
комплекс ТнС-4Са+2 утрачивает свой Са+2; тропонин I, реагируя с тропомиозином, подавляет дальнейшее взаимодействие миозиновой головки с F-актином; блокировка активных центров F-актина приводит к распаду актомиозина.
мышца расслабляется и её длина достигает исходной.
Особенности энергетического обмена в мышцах
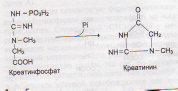
Источником АТФ служит гликолиз, ß- окисление, ЦТК и ЦПЭ В мышцах постоянно протекает ресинтез АТФ по двум основным путям: миокиназный (аденилаткиназный); креатинкиназный: (реакция Ломана, 1934)
Изоферменты КК не только в разных органах, но и в одной и той же клетке. В мышечных клетках 4 : в митохондриях, миофибриллах, мембранах саркоплазматического ретикулума, в комплексе с мембранными транспортными белками -. ®-в МТХ происходит реакция превращения АТФ в КФ, а в местах использования энергии – синтез АТФ.
Работами С. Гудбьярнассона и соавт. (1970) установлено, что при ишемии сокращения сердца останавливаются через 1-2 мин, когда запасы АТФ снижаются всего лишь на 20%, а содержание КФ более значительно.
Синтез
креатинина: в
почках, метилирование в печени, транспорт
в мышцы и клетки мозга. Нефермен КФ®
креатинин, выводится с мочой

103.
Химический
состав нервной ткани. Миелиновые
мембраны: особенности состава и структуры.
Энергетический обмен в нервной ткани.
Значение аэробного распада глюкозы.
Медиаторы нервной системы. Физиологически
активные пептиды мозга.
Функции нервной системы:
Хранит, воспринимает и перерабатывает информацию из внешней и внутренней среды;
Генерирует сигналы, обеспечивающие ответные реакции, адекватные действующим раздражителям – осуществляет адаптацию и сохранение гомеостаза
|
НС
координирует взаимодействие организма
с внешней средой, координирует функции
различных органов и тканей и осуществляет
интеграцию частей организма в единое
целое, является центральным органом
поддержания гомеостаза. |
ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ
В связи с различием строения, серое и белое вещество нервной ткани отличаются по химическому составу.
Химический состав серого и белого вещества головного мозга человека
|
Компонент |
Серое вещество (%) |
Белое вещество (%) |
|
Вода |
84,0 |
70,0 |
|
Сухой остаток |
16,0 |
30,0 |
|
Белки |
8,0 |
9,0 |
|
Липиды |
5,0 |
17,0 |
|
Минеральные вещества |
1,0 |
2,0 |
Белки нервной ткани
В головном мозге на белки приходиться 40% сухой массы. Методами хроматографии, электрофореза и экстракции буферными растворами. выделено более 100 белковых фракций нервной ткани
В нервной ткани содержатся простые и сложные белки.