
634-nmf
.pdfВ. Регуляция ионами кальция
•В расслабленной скелетной мышце комплекс тропонина
(субъединицы = Т, С, I) с тропомиозином препятствует взаимодействию миозиновых головок с актином.
•Быстрое увеличение в цитоплазме концентрации ионов кальция в результате открывания каналов СР приводит к связыванию Са2+ с С-субъединицей тропонина. Последняя по свойствам близка кальмодулину. Связывание ионов Са2+ вызывает конформационную перестройку в тропонине, тропонинтропомиозиновый комплекс разрушается и освобождает на молекуле актина участок связывания с миозином (на схеме выделен красным цветом). Это инициирует цикл мышечного сокращения.
•В отсутствие последующего стимулирования АТФ-зависимые кальциевые насосы мембраны СР быстро снижают концентрацию ионов Ca2+ до исходного уровня. Как следствие, комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, место связывания миозина на актине блокируется и мышца расслабляется.
Последовательность событий при сокращении мышечного волокна скелетных мышц
•При поступлении сигнала от двигательного нейрона мембрана мышечной клетки деполяризуется, сигнал передается на Сa2+-каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает. Ионы Сa2+ связывается с тропонином С, вызывая конформационную перестройку в тропонине, что влечет за собой разрушение комплекса тропонин-тропомиозин и дает возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.
•По завершении сокращения уровень ионов Са2+ снижается за счет активного обратного транспорта Са2+ в СР, тропонин С отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекуле актина, блокируя актин-миозиновый цикл. Результатом является
расслабление мышцы.
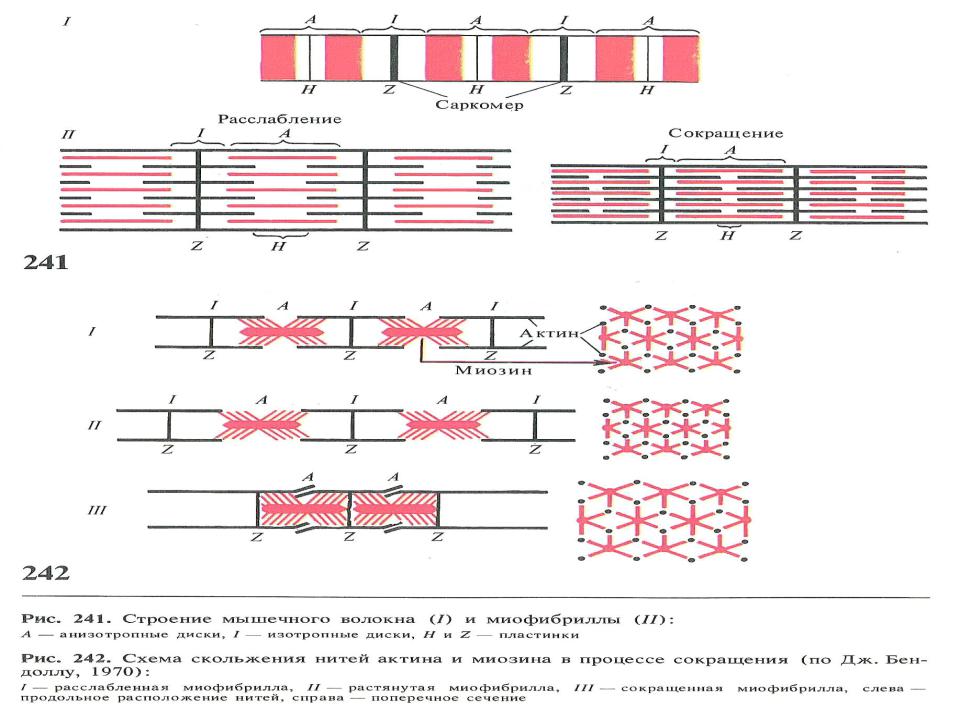
•Микростроение скелетного мышечного волокна. Молекулярные механизмы сокращения. Теория скользящих нитей.
•Сократительные белки актин и миозин образуют в миофибриллах тонкие и толстые мионити. Нити располагаются параллельно мышечной клетки. Миофибриллы представляют собой способные к сокращению пучки нитей d ≈ 1 мкм. Перегородки, называемые Z – пластинками, разделяют их на несколько компартментов длиной = 2,5 мкм, которые называются саркомерами.
Сопряжение возбуждения с сокращением в гладкомышечных клетках
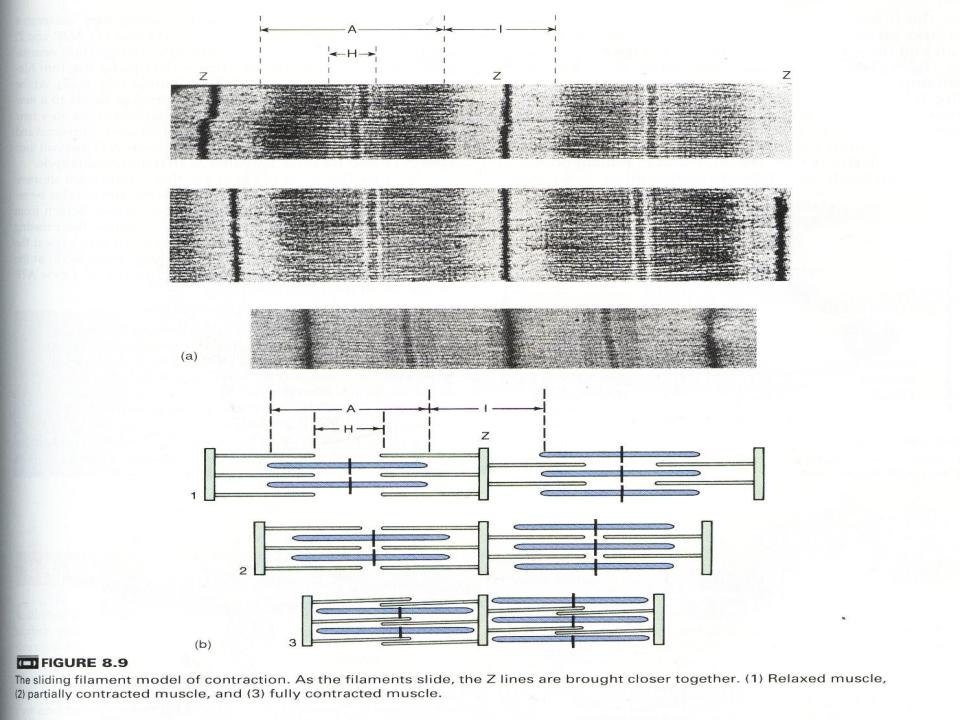
•Теория скользящих нитей (Хаксли, Хансон) объясняет способность мышечных волокон к сокращению. Основной особенностью мышечного волокна является наличие в протоплазме массы тонких миофибрилл, представляющих собой беспорядочно расположенные сократимые пучки нитей (филаментов) диаметром около 1 мкм (поэтому гладкая мышца не имеет поперечной исчерченности). Пучки нитей миофибрилл представлены сократительными белками - актином и миозином. Последние образуют в миофибриллах тонкие и толстые миофиламенты. Середину каждого саркомера занимают несколько тысяч "толстых" нитей миозина диаметром примерно 10 нм. На обоих концах саркомера находится около 2000 "тонких" (толщиной до 5 нм) нитей актина, прикрепленных к Z-пластинкам наподобие щетинок в щетке.
Впокоящейся мышце
•на уровне саркомера концы толстых и тонких филаментов обычно лишь слабо перекрываются.
•В основе сокращения лежит скольжение актина по отношению к миозину. Во время сокращения тонкие актиновые филаменты скользят вдоль толстых миозиновых нитей, двигаясь между ними к середине их пучка и саркомера
•(рис. Организация миозиновых и актиновых нитей в
расслабленном и сократившемся саркомере).
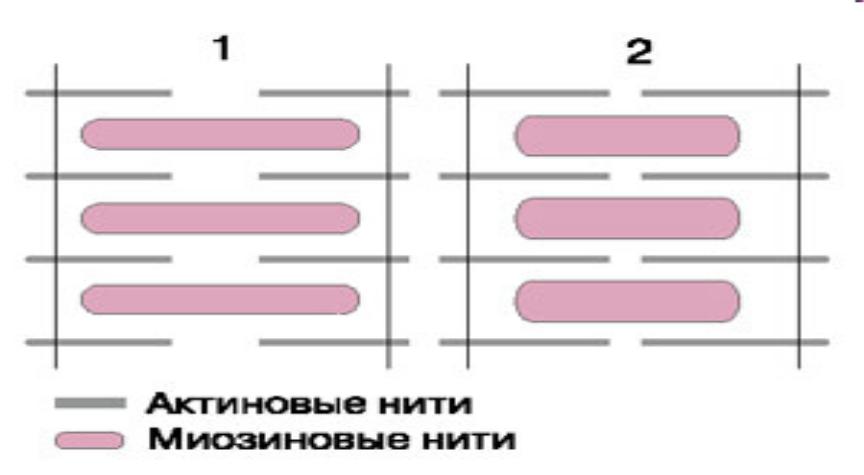
Организация миозиновых и актиновых нитей в расслабленном и сократившемся саркомере
•Разнонаправленное скольжение актиновых нитей в двух половинах саркомера происходит за счет биполярной организации молекул миозина. Миозиновые нити несут поперечные, отходящие биполярно, выступы длиной около 20 нм с "головками" примерно из 150 молекул миозина. Во время сокращения каждая "головка" (поперечный мостик) может связывать миозиновую нить с соседними актиновыми. Движение "головок" создает объединенное усилие, как бы "гребок", продвигающий актиновые нити к середине саркомера. В результате однократного движения поперечных мостиков вдоль актиновой нити саркомер укорачивается примерно на 1% своей длины.
Механизм фосфорилирования
•Для повышения АТФ-азной активности миозина необходимо его фосфорилирование.
•Механизм фосфорилирования
осуществляется следующим образом. Са2+ соединяется с кальмодулином (кальмодулин - рецептивный белок для ионов кальция).
•Возникающий комплекс активирует фермент киназу легкой цепи миозина, который, в свою очередь, катализирует фосфорилирование миозина. Затем идет процесс скольжения актина по отношению к миозину, составляющий основу сокращения
( рис. Модель механизма сокращения 4).
