
Геохімія
.pdf
131
Розглянемо, наскільки вдалою буде спроба описати силікатний розплав уявляючи його у вигляді суміші полімерних вузлів та блоків (що складаються переважно з атомів кремнію та кисню), катіонів (здатних видозмінювати полімери) та вільних іонів кисню. Для здійснення такої побудови корисною є інформація щодо розмірів полімерних блоків, їх просторового розташування та характеру взаємодії між ними та сіткомодифікаторами. Прямих інструментальних методів визначення співвідношень полімерних блоків різного розміру не існує. Впевнено ми можемо говорити про два крайні випадки: 1) розплав чистого кремнезему, як єдиний полімерний каркас з безкінечним ступенем полімеризації; 2) розплав чистого олівіну, в якому відсутні будь-які полімери крім мономірів ( Si-O-) - SiO44- (роз’єднані тетраедри кремнезему, в яких відсутні кисневі місткові з’єднання, рис. 8.4b).
Між цими крайніми випадками, найімовірніше, існує безперервний ряд сумішей з різним ступенем полімеризації та різноманітними співвідношеннями між полімерними блоками. Застосовуючи теоретичні аспекти хімії полімерів та термодинамічний опис звичайних рівноважних реакцій можна отримати наближену інформацію щодо довжини та маси молекулярних ланцюжків, в’язкості розплавів та активності іонних часток у відносно простих розплавах (в подвійних та потрійних системах). (Однак при цьому природа зайнятих чи вільних катіонних позицій в розплаві залишиться нез’ясованою.)
При інтерпретації термодинамічних властивостей силікатних розплавів необхідно враховувати полімеризацію кременекисневих тетраедрів в рівновагах типу:
Si-O-Si + O2- 2( Si-O-) |
8.3 |
Використання статистичної теорії полімерів дозволяє розраховувати відносні пропорції різних полімерних часток (SiO44-, Si2O76-, Si3O108- тощо) які присутні в будь-якому розплаві, а також частку вільних іонів кисню - O2-. Основним постулатом цієї теорії є наступне припущення: реакційна спроможність функціональної групи не залежить від розмірів полімерної молекули, до якої належить дана група. Цей "принцип рівної реакційної спроможності" дозволяє застосовувати прості методи статистичної обробки при визначенні розподілу зв’язків між блоками в полімеризованому середовищі. Понад те, згідно всіх наявних експериментальних даних цей принцип є справедливим для всіх (обмеження в використанні рекомендуються лише для самих маленьких), полімерних молекул.
Деякі з можливих полімерних молекул зображені на рис. 8.4.(b).
Два тетраедри, які поєднуються одним атомом кисню називаються димірами і відповідають формулі Si2O76-. Тетраедри також можуть бути поєднані двома атомами кисню і утворювати триміри - Si3O108-, якщо в одного з атомів кремнію три місткові атоми кисню - розгалужені тетраміри - Si4O1310-, тощо.
Загальна схема визначення ступеню полімеризації розплаву наступна. Нехай є повнотою (завершеністю) реакції полімеризації, і визначається як частка (від вихідної кількості атомів кисню) тих атомів кисню, які стали спільними для більш ніж одного тетраедру ( =NOм/NOt). Тоді
(згідно Whiteway S.G., Smith I.B., Masson C.R. Theory of molecular size distribution in multichain polymers. Can. J. Chem. 48, 33-45, 1970) мольна частка x-міру, який присутній в силікатному розплаві, становитиме:
Nx |
|
2 x 1 |
|
2 2x 1 |
8.4 |
||
x |
|
|
1 |
|
|
|
|
|
|
|
|||||
|
|
3 |
|
3 |
|
||
де
3xx (2x 1)!x!
Наведені в табл. 8.1 вирішення цього рівняння демонструють, що за всіх значень , до 0,5
131
132
включно, найпоширенішою полімерною часткою залишається мономір. Крім того очевидним є приуроченість максимальної поширеності конкретних полімерів до певних величин : чим більшим є полімер, тим за більшої величини досягається його максимальний вміст. При цьому не слід забувати що в димері вдвічі, а в тримері - втричі більше атомів кремнію ніж в мономірі, тому загальне число атомів кремнію в високо полімеризованих блоках може бути вищим ніж в мономірах.
Табл. 8.1 - Мольна частка полімерних компонентів в залежності від завершеності полімеризації.
|
Мономір |
Димір |
Тримір |
Тетрамір |
Інші |
0,1 |
0,813 |
0,142 |
0,033 |
0,009 |
0,003 |
0,2 |
0,651 |
0,196 |
0,078 |
0,026 |
0,039 |
0,3 |
0,512 |
0,197 |
0,101 |
0,059 |
0,131 |
0,4 |
0,394 |
0,170 |
0,123 |
0,064 |
0,249 |
0,5 |
0,296 |
0,132 |
0,078 |
0,053 |
0,441 |
Теорію полімерів (і, відповідно, рівняння (8.4)) в чистому вигляді можна застосовувати лише до
значень 0,5, оскільки за більшої |
величини суттєве значення матимуть вже процеси |
міжмолекулярної конденсації, наприклад (8.3), чи: |
|
SiO44-+ SiO44- Si2O76-+O2- |
8.5 |
При цьому утворюється вільний іон кисню, а теорія полімерів не передбачає утворення інших, крім полімерів, продуктів.
Тому рівняння (8.4) слід модифікувати, ввівши поправку на іонну долю вільних іонів кисню (NO2-):
|
|
|
|
2α x 1 |
2α |
2x 1 |
|
8.6 |
|||
N |
x |
ω |
|
|
|
1 |
|
|
1 N |
|
|
|
|
|
|||||||||
|
|
x 3 |
|
3 |
|
O2 |
|
||||
Отримавши певні уявлення про структуру полімеризованої рідини можна прогнозувати розподіл в ній окремих різновидів іонів. Найпростішим в даному випадку є використання константи іонної рівноваги. Наприклад, для реакції (8.5) яку можна записати в узагальненому вигляді
2O- O0+O2- |
8.7 |
константа рівноваги дорівнюватиме |
|
K=[O0]*[O2-]/[O-] |
8.8 |
Якщо вважати що K є константою не тільки за даної температури, але (незалежно від варіацій складу) зберігає постійне значення в межа системи, то можна приблизно розрахувати графіки залежності вільної енергії змішування від окладу та активності компонентів в основних бінарних силікатних розплавах.
Наприклад для реакції (розчинення форстериту):
Mg2SiO4 2MgO+SiO2 8.9
після досягнення рівноваги вільна енергія Гібса (G) пов’язана з активними концентраціями окислів (?) в розплаві наступним виразом:
G0Mg2SiO4-RTln[Mg2SiO4]=-RT{2ln[MgO]l+ln[SiO2]l} 8.10
Цей вираз є достатньо коректним, оскільки домінуючим структурним блоком розплаву олівіну є мономір, однак в більшості інших випадків, тим більш при аналізові багатокомпонентних систем слід враховувати довжину полімерних ланцюгів, яка теж впливає на константу рівноваги.
З врахуванням викладеного були виведені [Masson C.R., Smith J.B., Whiteway S.G. Activities and ionic distributions in liquid silicates: application of polymer theory. Can. J. Chem. 48, 1456-1464. 1970]
рівняння які встановлюють зв’язок між активністю окислу металу [MO] та складом бінарної
132
133
системи. Ці рівняння достатньо громіздкі і розглядати їх нам не обов’язково. З іншого ж боку їх застосування до аналізу емпіричних даних дозволило отримати константи рівноваги реакцій конденсації в бінарних системах, що має значний практичний інтерес.
Таблиця 8.2 - Константи рівноваги реакцій конденсації (K1,1)* для деяких силікатних систем при
NSiO2<0,5 [за Masson C.R. and others, 1970].
Система |
K1,1 |
Температура, С |
|
Система |
K1,1 |
Температура, С |
CaO-SiO2 |
0,0016 |
1600 |
|
FeO-SiO2 |
0,700 |
1257-1406 |
PbO-SiO2 |
0,196 |
1000 |
|
CoO-SiO2 |
2,000 |
1400-1700 |
MnO-SiO2 |
0,250 |
1500-1600 |
|
SnO-SiO2 |
2,550 |
1100 |
(*) реакція конденсації загального виду - SiO44-+SinO3n+12(n+1)- Sin+1O3n+42(n+2)-+O2- , її константа рівноваги K1,n, в даному випадку наведені коефіцієнти для n=1.
Крім загального висновку про те що катіони знаходяться в стані рівноваги, отримані результати дозволяють прогнозувати ступінь полімеризації бінарних систем: розплави системи CaO-SiO2 суттєво деполімеризовані, а системи SnO-SiO2 - навпаки, високо полімеризовані.
Структурне положення катіонів в силікатних розплавах.
З’ясування положення катіонів є ще складнішим ніж визначення ступеню полімеризації силікатних розплавів оскільки доведена [Boon J.A., Fyfe W.S. The co-ordination number of ferrous ions in silicate systems. Chem.Geol. 10, 287-298,1972] можливість суттєвої зміни структурної позиції катіонів в склі по відношенню до розплаву навіть при швидкій закалці. А це ставить під сумнів правомірність прогнозування положення катіонів у розплаві за результатами вивчення скла.
При цьому вбачається можливим все ж сформулювати деякі емпіричні правила які пов’язують структурне положення елементу в склі і розплаві. Так, якщо Ni в олівіні перебуває виключно в октаедричних позиціях то логічним буде припущення що в розплаві хоча б частина Ni знаходиться в тетраедричній позиції.
Перспективним видається застосування з цією метою (з’ясування позиції катіонів) теоретичних моделей структури рідини. Згідно однієї з них [Bernal J.D. The structure of liquids. Proc. R. Soc. Lond. A, 280, 299-322, 1964] виділяється 5 типів позицій аніонів (див. табл. 8.3), порівняно ж дрібні катіони займають проміжки з КЧ=4 або КЧ=5. Для силікатних розплавів це означає щільну упаковку іонів кисню, в проміжках якої розміщені кремній та інші катіони.
Таблиця 8.3 - Типи позицій існуючих у випадковій упаковці твердих сфер [за Bernal J.D., 1964].
Тип поліедру |
Кількість, % |
Обсяг, % |
|
Тип поліедру |
Кількість, % |
Обсяг, % |
Тетраедри |
73% |
48,4% |
|
Архімедові |
0,4% |
2,1% |
Напівоктаедри |
20,3% |
26,9% |
|
антипризми |
|
|
|
|
|||||
Тригональні |
3,2% |
7,8% |
|
Тетрагондодека |
3,1% |
14,8% |
призми |
|
|
|
едри |
|
|
****
Згідно експериментальних даних окремої уваги заслуговує поведінка в силікатних розплавах Al. Так, в мінералах і силікатному розплаві алюміній може заміщувати кремній в тетраедрах (домінуюча позиція з КЧ=4), або знаходитись поза тетраедрами (при підвищеному вмісті кисню, в цьому випадку КЧ=6). Крім того, в залежності від складу розплаву може утворювати як ізольовані тетраедри (знаходитись в них, AlO45- - в суміші альбіт-кремнезем), так і більш високо полімеризовані блоки (суміш анортит-кремнезем).
Цікавою особливістю є перехід Al3+ з четверної в шістірну координаційну позицію при зростанні тиску, що спостерігається в розплавах базальтового (44-52% SiO2) та андезитового (52-65% SiO2) складу. Такий перехід супроводжується, природно, зменшенням ступеню полімеризації та
133
134
в’язкості розплаву. Зменшення в’язкості в цьому випадку порівняно (залежність від температури проявляється сильніше) невелике (в 2 рази для андезитового розплаву з температурою 1350 C при зростанні тиску з 105 Па до 3*109 Па), однак достатнє для відчутного впливу на швидкості осадження кристалів та підйому розплавів в верхній мантії.
За спроможністю формувати високо полімеризовані сполуки в розплавах катіони хімічних елементів можна умовно поділити на дві групи: сіткоутворювачі і сіткомодифікатори.
Сіткоутворювачами, в першу чергу, є відносно малі іони з великим зарядом (Si4+, а також Al3+, P3+, інколи Fe3+, Ti4+, B3+, тобто переважно ті катіони які можуть заміщувати кремній в тетраедричних позиціях з КЧ=4).
Інші поширені катіони природних силікатних розплавів, що мають більший радіус, і, як правило, менший заряд (Ca2+,Mg2+, Fe2+, K+, Na+, і H+) є сіткомодифікаторами. Ці іони не можуть замістити силікон в тетраедрах і їхні позитивні заряди можуть бути збалансовані лише за рахунок розділу місткових з’єднань кисню. Відповідно, збільшення вмісту сіткомодифікаторів призводить до розриву зв’язків між тетраедрами, тобто асиміляція силікатним розплавом речовини яка містить сіткомодифікатори призводить до прогресивної деполімеризації.
Це ілюстровано на рис. 8.5, де порівнюється структура чистого скла кремнезему та скла кремнезему збагаченого катіонами. Структура розплаву, як ми вже зазначали, в свою чергу впливає на фізико-механічні властивості розплаву. Наприклад, розплави багаті на SiO2 мають низьку густину і високу в’язкість. При додаванні до розплаву катіонів (наприклад збагачення розплаву MgO або CaO), в’язкість знижується, а густина зростає, що обумовлено розривом структури полімеру.
Само собою, поділ елементів на сіткоутворювачі і сіткомодифікатори, враховуючи наведений вище приклад переходу Al3+ з позиції з КЧ=4 в позицію з КЧ=6, є достатньо умовним.
В якості емпіричного показника ступеню полімеризації використовують:
1) відношення (NBO/T) загальної кількості немісткових атомів кисню (NBO) до кількості іонів
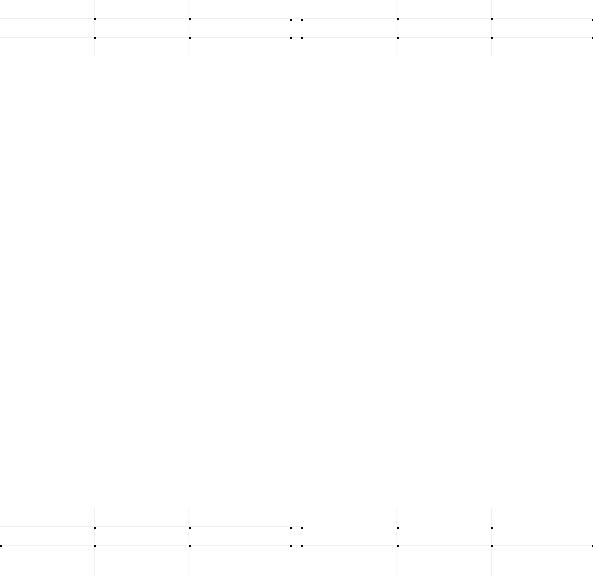
(Si4+ та Al3+) в тетраедричних позиціях (T) магми [Kohn, S. C. and P. F. Schofield. 1994. The implication of melt composition in controlling trace-element behavior: an experimental study of Mn and Zn partitioning between forsterite and silicate melts. Chem. Geol. 117: 73-87.] - це відношення є власне показником деполімеризації, його використання добре обгрунтовується з теоретичних позицій однак викликає зрозумілі утруднення на практиці. Відомі також рівняння регресії які пов’язують коефіцієнти розподілу мікроелементів (що займають октаедричні позиції) між твердою фазою і розплавом з величиною цього відношення:
lnD=a*ln(NBO/T)+b/T 8.11
для Zn в системі олівін-розплав lnD=-0,405*(ln(NBO/T)+6,077)+3594/T
2) відношення (R) загальної кількості атомів кисню до суми основних сіткоутворюючих атомів в магмі [1) Lacy E.D. A statistical model of polymerisation/depolymerisation relationships in silicate melts and glasses. Phys. Chem. Glasses. 6, 1965; 2) Lacy E.D. The Newtonian flow of simple silicate melts at high temperature. Phys. Chem. Glasses. 8, 238-246, 1967]:
R=O/(Si+Al+P) 8.12
Величина останнього відношення в гранітних розплавах близька до 2 (в високо полімеризованому розплаві чистого кремнезему RSiO2=2), а в ультраосновних - приблизно рівна 3 (в розплаві чистого
форстериту RMgSiO4=4).
Принципово можливою є оцінка в’язкості магм за температурою і складом розплаву. Залежність в’язкості розплаву від температури, визначена в результаті вивчення природних магм, можна описати співвідношення подібним до рівняння Арреніуса:
=A*eE/R*T 8.13
де A - константа, E - енергія активації в’язкої течії
135
(кДж/моль), R - універсальна газова постійна (8,31441 Дж*К-1*моль-1). Ця залежність ілюструє зростання в’язкості розплаву при зменшенні температури.
Рисунок 8.6 (7.12) - Зміни коефіцієнту розподілу цинку (олівін-розплав) як функція відношення кількості немісткових атомів кисню (NBO) до кількості іонів (Si4+ та Al3+) в тетраедричних позиціях (T) за експериментом Kohn S.C. і P. F. Schofield. (1994)
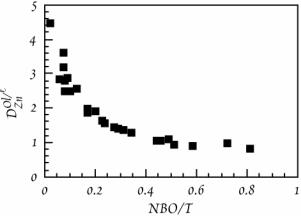
Доведена [Scarfe C.M. Viscosities of basic magmas at varying pressures. Nature Phys. Sci. 241, 101102, 1973] монотонна залежність енергії активації в’язкої течії магм різного складу (при температурі ліквідусу) від значення індексу R (див рис. 8.7)
Як і передбачалось, при зростанні величини індексу R в’язкість розплавів зменшується.
За [Bottinga Y., Weill D.F. The viscosity of magmatic silicate liquids a model for calculation. Am.J.Sci. 272, 438-475, 1972] для розрахунку в’язкості безводного силікатного розплаву петрогенні окисли слід поділяти на 2 типи:
ланцюгоутворювачі: SiO2, KAlO2, NaAlO2, Ca0,5AlO2, Mg0,5AlO2;
ланцюгомодифікатори: CaO, K2O, Na2O, MgO, FeO, TiO2, Al2O3.
Рисунок 8.7 - Залежність енергії активації в’язкої течії розплавів порід при ліквідусних температурах ( 1200 С) і тиску 1 атм від індексу складу R (див формулу 8.4): а – пантелерит, б - андезито-базальт, в - толеїт з океанічних островів, г - олівіновий базальт, д - олівіновий меланефеленіт (за Scarfe, 1973).
Моделі розчину магми
Завдання моделювання магми ускладнюють декілька чинників. По перше, магма містить багато розчинених компонентів (звичайно 8 або більше). По друге, тверді тіла які кристалізуються з магми самі є розчинами. По третє, магма кристалізується в широкому діапазоні температури (до 400-500°C і більше, у виняткових випадках). Крім того кристалізація може відбуватися в широкому діапазоні тисків (підйом магми до поверхні з асиміляцією вміщуючих порід). Незважаючи на ці (та інші) ускладнення, декілька з опублікованих моделей (Ghiorso та інші., 1983; Ghiorso і Sack, 1995; Nielsen і Dungan, 1983) є достатньо точними, щоб бути корисними для петрологів. Мета цих моделей - описати фази магми і їх пропорційну кристалізацію при охолодженні, а також еволюцію складу розплаву в процесі кристалізації. Нижче ми стисло розглядаємо модель Ghiorso.
Згідно моделі Ghiorso (Ghiorso і Sack, 1995) розплав уявляється як суміш незмішуваних рідин які кристалізуються незалежно і представлені: SiO2, TiO2, Al2O3, Fe2O3, MgCr2O4, Fe2SiO4, Mg2SiO4, CaSiO3, Na2SiO3, KAlSiO4, Ca3(PO4)2 та H2O.
Остання версія моделі Ghiorso, втілена в комп’ютерну програму під назвою "MELTS", реалізовану на базі системи UNIX workstations, недавно стала доступною для наукової громадськості через World Wide Web (WWW) (URL:
135
136 «http://msgmac.geology.washington.edu/MeltsWWW/Melts.html»). Вона повинна в майбутньому стати звичайним інструментом петрологів.
Дворешіткова модель Nielsen і Dungan
Зовсім інакше підійшли до проблеми моделювання поведінки силікатного розплаву
Nielsen і Dungan (1983). Їх модель базується на структурній моделі силікатного розплаву розробленій Bottinga і Weill (1972) для прогнозування в'язкості розплаву.
Модель Bottinga і Weill базується на тезі що компоненти силікатного розплаву поділяються на сіткоутворювачі і сіткомодифікатори. Nielsen і Dungan моделювали силікатний розплав як суміш двох розчинів або квазі-решіток: одна решітка, або розчин, складається з компонентів що формують сітку і а друга - з компонентів які модифікують сітку, тому модель й називається "дворешітковою". Всередині кожного розчину компоненти є ідеально змішуваними. Дві решітки, або розчини вважаються існуючими цілком незалежно один від одного, так що всі ефекти,
пов’язані із змішуванням двох структур, ігноруються.
Наступне завдання після встановлення цієї структури розділити компоненти на ті які формують сітку і ті які її змінюють. SiO2 вважається, звичайно, виключно сіткоутворюючим компонентом, а MgO, FeO, CaO, TiO2, MnO, і CrO1,5 зараховують до чинників що сприяють модифікації сіток. Експериментальні дані дозволяють припустити що Al і Fe3+ можуть бути як сіткомодифікаторами так і сіткоутворювачами, і, що Na і K можуть утворювати комплекси з сітковими формами Al. Тому Nielsen і Dungan об’єднали Na і K з алюмінієм, щоб сформувати компоненти NaAlO2 і KAlO2. Весь надлишок Al зачисляється до сіткомодифікаторів, у формі AlO1,5. Надлишкові Na і K об’єднуються з Fe3+, щоб сформувати компоненти KFeO2 і NaFeO2; Решта Fe3+ враховується як сіткомодифікатор у формі FeO1,5. Активності розраховуються з врахуванням ідеальності розчинів, наприклад:
8.14
8.15
де NF і NM є індексами сіткоутворювачів і сіткомодифікаторів, відповідно. Константи рівноваги для реакції між компонентами в розплавах і в різних можливих мінералах були вирахувані з експериментальних даних, при використанні рівнянь лінійної регресії. Їх вирази для константи рівноваги мають форму:
lnK=a/T+b |
8.16 |
з параметрами "a" і "b", які є нахилом і зміщенням регресійної лінії. З Розділу 3, ми можемо ідентифікувати параметр "a" з - Hr/R і параметр "b" з Sr/R. Nielsen і Dungan не розглядали вплив тиску і їхня модель обмежується до рівновагою розплаву з мінералами при атмосферному тиску, або в близьких до нього умовах.
Nielsen і Dungan дворешіткова модель по суті простіша, ніж модель Ghiorso і має ряд теоретичних хиб. Однією з них є припущення ідеальності, оскільки силікатні рідини можуть бути незмішуваними. Більш серйозною хибою є нездатність передбачити справжні активності. У моделі
136
137
Nielsen і Dungan, наприклад, додавання MgO до рідини не зменшує активність SiO2, що звичайно некоректно. Незважаючи на цих теоретичну недосконалість, модель широко використовується із значним успіхом для багатьох, однак не всіх складів магм (модель Ghiroso також не працює для всіх складів). До того ж, їх модель передбачає поведінку слідових елементів, як ми побачимо в Розділі 7. Комп'ютерні програми для розрахунку моделі Nielsen і Dungan, які підтримуються персональними комп’ютерами доступні на Geochemical Earth Reference Model (GERM) Web Site (http://www-ep.es.llnl.gov/germ/model-tools.html).
Вплив домішок води
Відомо, що природні магматичні системи можуть містити певну кількість води. При цьому верхня межа розчинності води понижується при підвищенні температури і зростає при підвищенні загального тиску. Так, за емпіричними даними в базальтовому розплаві розчинність води змінюється від 3,1% маси за тиску 100 МПа до 9,4% маси за тиску 600 МПа, а в андезитовому - від
4,5% маси за тиску 100 МПа до 10,1% маси за тиску 530 МПа [Hamilton D.L., Burnham C.W., Osborn E.F. The solubility of water and effects of oxygen fugacity and water content on crystallization of mafic magmas. J.Petrol. 5, 21-39, 1964]. Порівняно невисокий рівень масового вмісту води не повинен вводити в оману, адже 4% маси води в базальтовій магмі відповідає 10-15% мольної концентрації, а цього цілком досить для зміни структури розплаву порівняно з сухими умовами.
І дійсно, можна виділити, декілька важливих для геохімії наслідків наявності (відсутності) домішок води в магмі:
1)В присутності води можуть утворюватись водовмісні мінерали.
2)Вода, яка відділяється від магми на заключних етапах застигання може стати транспортним середовищем для великої кількості елементів які в іншому випадку були б зафіксовані в кінцевих продуктах кристалізації (саме в результаті такої міграції формується значна частина гідротермальних родовищ).
3)Зміни вмісту води в магмі при заданій температурі змінює поля стабільності мінералів в рівновазі з розплавом (наприклад, додавання води розширяє поле кристалізації олівіну і змінює
співвідношення полів CPx і OPx на потрійній діаграмі Mg2SiO4-CaMgSi2O6-SiO2 (розширюється поле CPx)
4)В присутності води зменшуються температури кристалізації багатьох мінеральних фаз.
5)Додавання води до безводних силікатних магм призводить до зміни в’язкості. При цьому в більшості типів магм (крім ультраосновних) спостерігається зменшення в’язкості (часом дуже суттєве) при додаванні води. Так, при додаванні 4% маси води до сухого розплаву андезитобазальтового складу за температури 1150 С і тиску 100 МПа в’язкість зменшується з 1000 до 250 пуаз, тобто в 4 рази.
Вважається, що зменшення в’язкості при додаванні води пов’язане з деполімеризацією розплаву (якщо він, звісно, не був деполімеризований раніше, як розплав олівінового базальту, наприклад) в результаті реакції води з містковими іонами кисню силікатної сітки за рівнянням:
H2O+ Si-O-Si 2( Si-OH) 8.17
При розчиненні ж води у розплаві зі значною часткою немісткових переходів відбувається утворення комплексів Si-OH та M(OH)n.
В більшості розплавів вода виступає в ролі основи, але в ультраосновних розплавах вода може відігравати роль кислоти. Крім того, за експериментальними даними, в ультраосновних розплавах можливе невелике підвищення ступеню полімеризації (і, тим самим, в’язкості) розплаву у зв’язку з реакцією:
|
- |
|
- |
8.18 |
H2O+2( Si-O) |
Si-O-Si +2OH |
|
|
|
137
138
Роль вуглекислого газу та інших летючих компонентів.
Вплив на структуру розплаву інших летючих компонентів (зокрема галогенів) та межі їх розчинності вивчені, за виключенням вуглекислого газу, слабко.
Розчинність вуглекислого газу в силікатних розплавах значно менша ніж води, але вона сильно зростає із збільшенням тиску чи температури. Низька розчинність CO2 є тим чинником який значною мірою визначає генерацію газової фази, що відділяється від розплаву в процесі фракціонної кристалізації магми. Крім того, низькі значення розчинності вуглекислоти допомагають пояснити природу багатьох збагачених CO2 флюїдних включень, виявлених у фенокристалах з деяких вулканічних порід.
Домінуючою формою знаходження вуглекислоти в розплаві є CO32- (в минулому ця форма знаходження взагалі вважалась єдино можливою). Згідно Майсена [Mysen, B. O. The solubility of H2O and CO2 under predicted magma genesis conditions and some petrological and geophysical implications. Rev. Geophys. Cpace. Phys. 15, 351-361,1977] в розплавах, які за складом відповідають жадеїту (NaAlSi2O6), альбіту (NaAlSi3O8) або нефеліну (NaAlSiO4), можуть бути присутніми й виокремлені молекули CO2.
Утворення аніонних груп CO32- при розчиненні вуглекислоти, вірогідно, призводить до збільшення ступеню полімеризації розплаву за реакцією:
2( Si-O)-+CO2 Si-O-Si +CO32- |
8.19 |
Однак в присутності води CO32- є стійким в розплаві і без його подальшої полімеризації:
2( Si-O)-+H2O+CO2 2( Si-OH)+CO32- |
8.20 |
Такий (8.19) механізм розчинення пояснює підвищену розчинність CO2 в основних розплавах (порівняно з кислими), адже в них оскільки частка немісткових кисневих атомів в них є значно вищою.
Концентрація хлору в базальтах близька до 0,02%, однак форма його знаходження в розплаві (вільний хлор чи хлориди) невідома. Більш кислі породи типу агпаїтових склуватих порід можуть містити кілька десятих відсотку хлору, однак цей елемент може втрачатися при кристалізації, оскільки в присутності фтору він не входить до складу водовмісних мінералів. Припускають що хлор, як елемент що має сильну спорідненість з співіснуючою в магмі водною фазою, концентруватиметься в тих водовмісних мінералах, які першими виділяються при диференціації магми, тоді як фтор, завдячуючи спорідненості до розплаву, буде збагачувати пізні водовмісні мінерали. Оскільки хлор явно тяжіє до водної фази, його участь у силікатному розплаві в ролі деполімеризуючого агенту є малоймовірною, скоріше він буде зв’язаний з натрієм чи іншим сіткомодифікатором. Цим хлор сильно відрізняється від фтору, іони якого можуть роз’єднувати місткові атоми кисню в сітці і, тим самим, знижувати в’язкість розплаву:
Si-O-Si +F- Si-O-+ Si-F- 8.21
В аналізах поширеності фтору в гранітоїдах відмічаються суттєві відмінності вмістів цього елементу навіть в породах дуже близьких типів. Очевидна неспроможність силікатного розплаву утримувати хлор і, на пізніх стадіях кристалізації, частину фтору є дуже важливим чинником процесів метасоматозу і гідротермального рудоутворення.
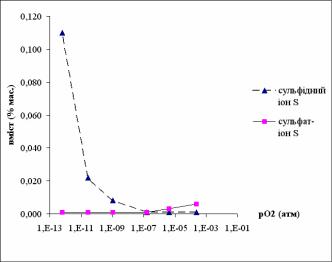
Дані щодо розчинності сірки (сірка в елементарній формі, сульфат-іони і сульфід-іони) в розплавах досить представницькі. Концентрація сірки в природних базальтових розчинах звичайно не перевищує 0,1% мас. Вважають, що домінуючою формою знаходження сірки є сульфідна. При цьому виявлена залежність загального вмісту сірки та форм її знаходження від парціального тиску кисню: за низького парціального тиску кисню (<10-8 атм.) домінуючим є сульфід-іон, а при високому (>10-8 атм.) - сульфат-іон (сірка в елементарному стані нерозчинна).
Рис. 8.8 – Залежність співвідношення вмістів
139
сульф
тиску Т=12
139
140
Розчинність сірки (за інших рівних умов) збільшується при зростанні температури. Зафіксоване збільшення розчинності сірки при зростанні вмісту металу в розплаві (в базальтовому розплаві при зростанні вмісту FeO в 4 рази - від 5 до 20% мас., максимальна розчинність S зростає від 0,05% до 0,2% мас.) дозволяє припустити що сірка перебуває в координації з катіонами металів (зокрема заліза), а не з киснем тетраедрів.
140
