
Тема №2: Общие закономерности химических процессов.
1) Сформулируйте основной круг задач, решаемых в химической технологии при выборе технологического режима на основании законов химической кинетики.
Главные направления развития ХТ:
- увеличение мощностей химико-технологических систем и отдельных аппаратов;
- интенсификация работы аппаратов;
- механизация трудоемких процессов;
- комплексная автоматизация отдельных производств с применением ЭВМ;
- замена периодических производств на непрерывные;
-снижение энергозатрат и рациональное использование теплоты химической реакции;
- уменьшение стадий производства и переход к замкнутым системам;
- создание безотходных производств.
2) Как определить направленность химической реакции? Как, сравнивая значения энергии Гиббса ∆Gдля различных реакций, можно определить, какая из них является спонтанной (самопроизвольной)?
О протекании химической реакции судят по изменению изобарно-изотермического потенциала (энергии Гиббса). Известно, что при проведении химической реакции в изобарно-изотермических условиях самостоятельно, т.е. в сторону образования продукта, протекают реакции,сопровождающиеся уменьшением энергии Гиббса.
Энергия Гиббса может быть определена по уравнению Вант-Гоффа
![]() .
.
Эти приближенные равенства показывают, что при низких температурах критерием направления самопроизвольного процесса в первом приближении может служить знак теплового эффекта химической реакции; при высоких температурах – знак изменения энтропии. Это означает, что при низких температурах самопроизвольно протекают экзотермические реакции, а при высоких – реакции, сопровождающиесяростом энтропии.
3) Сформулируйте основные условия равновесия.
Условия равновесия будут определяться температурой, давлением и концентрацией реагирующих веществ.
4) Что характеризует химическое равновесие?
Характеризует соотношением произведения концентраций продуктов реакции к произведению концентрации реагента, в степенях их коэффициентов в реакции, при данных условиях.
5) Сформулируйте принцип Ле Шателье. Каким образом он помогает предсказать влияние изменения температуры и давления на состояние равновесия химической реакции?
В соответствии с принципом Ле-Шателье, если на систему, находящуюся в равновесии, воздействовать извне путем изменения какого-либо условия, то в системе усилится такой процесс, течение которого ослабит влияние произведенного воздействия.
6) Что такое эксэргия?
Эксергия – часть, равная максимальной полезной работе, которую может совершить термодинамическая система при переходе из данного состояния в состояние равновесной с окружающей средой
7) Каковы возможности и цели эксэргетического анализа технологических процессов?
8) Как рассчитать эксэргию реакционного потока?
![]()
9) С какойцелью в технике используют эксэргетический КПД? Каковы пути увеличения эксэргетического КПД?
10) Чем различаются определения скорости гомогенной и гетерогенной реакций?
Скорость гомогенной реакции определяется как изменение концентраций реагентов в течение определённого времени в единице объёма (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенной реакции).
12) Как составляют кинетические уравнения простых реакций?
13. Как составляют кинетические уравнения сложных реакций:
а) с известным механизмом реакции;
б) с неизвестным механизмом реакции?
14) От каких микрокинетических факторов зависит скорость химической реакции?
15) Запишите уравнение Аррениуса в дифференциальной, интегральной и логарифмической форме. В чем суть уравнения Аррениуса?
![]()
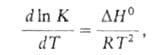
16. В чем заключается главная особенность гетерогенных химических процессов?
Гетерогенный процесс включает пять стадий:
- внешнюю диффузию реагента через пограничный слой газа;
- внутреннюю диффузию реагента через слой золы или инерта;
- химическую реакцию;
- внутреннюю диффузию продуктов через слой золы или инерта;
- внешнюю диффузию продуктов через пограничный газовый слой.
17) Какие кинетические модели обычно используют для описания гетерогенных процессов в системах газ–твердое тело, газ–жидкость?
18) Какой смысл вкладывается в понятия «кинетическая область гетерогенного процесса», «диффузионная область»?
При низкой температуре лимитирующей стадией гетерогенного процесса является химическая реакция (кинетическая область) при повышении температуры константа скорости хим реакции быстро увеличивается и начиная с некоторой температуры когда скорость реакции станет больше скорости диффузии, лимитирующий стадией становится процесс диффузии
19) Как увеличить коэффициент массотдачи на стадии внешней диффузии?
20) Сформулируйте основные свойства лимитирующей стадии.
21) Как определить лимитирующую стадию гетерогенного процесса, экспериментально изучая влияние температуры на скорость образования продуктов в ходе этого процесса?
Лимитирующие стадии гетерогенного процесса можно определить, меняя температуру и скорость газового потока (рисунок 5.3).
![]()
![]()
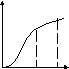
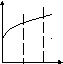
Кин. Перех. Диф. Диф. Перех. Кинетич.
![]() Т
Т
Рисунок 5.3 – Зависимость общей скорости процесса
от температуры и скорости потока
Меняя температуру и скорость газового потока, можно определить влияние внешней диффузии и скорости химической реакции на скорость гетерогенного процесса.
22) Как определить лимитирующую стадию гетерогенного процесса в системах газ–твердое тело, используя теоретические зависимости между временем пребывания в реакторе и степенью превращения твердой фазы для различных областей протекания гетерогенного процесса?
23) В чем заключается различие в расчете реакторов для проведения гетерогенных процессов в системе газ–твердое тело в случаях, когда твердая фаза состоит из частиц одного размера и когда она характеризуется каким-то распределением частиц по размерам?
24) Какая величина называется коэффициентом ускорения абсорбции? Почему можно говорить об ускорении абсорбции, если в жидкой фазе протекает химическая реакция?
25) Сравните достоинства и недостатки пленочной модели и моделей обновления поверхности, используемых при описании газожидкостных реакций.
