
2. Рн атмосферних опадів, підземних і поверхневих вод.
Неорганічні сполуки вуглецю, що містяться в природних водах у вигляді похідних вугільної кислоти, тісно взаємоповʼязані один з одним і утворюють карбонатну систему.
У контакті з водою діоксид вуглецю розчиняється до наставання рівноваги:
СО2(г) = СО2(р) + Н2О ↔ Н2СО3.
Вугільна кислота дисоціює за першим ступенем з утворенням катіона водню і аніона гідрокарбонату:
Н2СО3 ↔ Н+ + НСО3−.
Константа рівноваги цього процесу дорівнює:
К1
=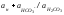 .
.
Дисоціація вугільної кислоти за другим ступенем відбувається значно слабше і призводить до появи карбонат-іонів:
НСО3− ↔ Н+ + СО32−.
Константа дисоціації вугільної кислоти за другим ступенем має вигляд:
К2 =
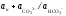
Якщо відома сумарна активність карбонатів і рН розчину, завжди можна обчислити активність кожного з компонентів карбонатної системи. Для орієнтовних розрахунків зручно використовувати розподільну діаграму, яка є залежністю вмісту у мольних частках компонентів карбонатної системи від величини рН розчину.
Аналіз наведених вище рівнянь, що описують процес розчинення діоксиду вуглецю у воді, дає змогу вивести рівняння залежності концентрації іонів водню в розчині від парціального тиску діоксиду вуглецю у повітрі.
Константа дисоціації вугільної кислоти за другим ступенем приблизно на чотири порядки менша, ніж константа дисоціації за першим ступенем, тому, оцінюючи вплив вугільної кислоти на значення рН атмосферних опадів, процес дисоціації за другим ступенем можна не брати до уваги.
У разі дисоціації вугільної кислоти за першим ступенем концентрації гідрокарбонат-іонів і іонів водню, що утворюються, рівні між собою:
[Н+] = [НСО3−].
Оскільки дослідний розчин має низьку концентрацію іонів, можна прийняти, що коефіцієнти активності іонів Н+ та НСО3− дорівнюють одиниці. Тому й активність цих іонів дорівнюватиме між собою, а константу дисоціації можна подати у вигляді:
К1 =
[ Н+]2/[Н2СО3].
Н+]2/[Н2СО3].
Зважаючи
на незначну частку недисоційованої
вугільної кислоти в розчині (не більше
1% суми концентрацій СО2 + Н2СО3) і на те,
що дуже важко розділити ці дві складові
під час експериментального визначення
їх концентрацій у розчині, під концентрацією
Н2СО3, звичайно, мають на увазі концентрацію
розчиненого діок сиду
вуглецю, яка відповідно до закону Генрі
дорівнює:
сиду
вуглецю, яка відповідно до закону Генрі
дорівнює:

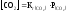
де
[СО2] – концентрація розчи неного
діоксиду вуглецю, моль/л;
неного
діоксиду вуглецю, моль/л; –
константа Генрі для вуглекислого газу,
моль/(л ∙ Па) або моль/(л∙атм);
–
константа Генрі для вуглекислого газу,
моль/(л ∙ Па) або моль/(л∙атм); –
парціальний тиск діоксиду вуглецю в
повітрі (Па або атм), тому константу
дисоціації можна подати у вигляді:
–
парціальний тиск діоксиду вуглецю в
повітрі (Па або атм), тому константу
дисоціації можна подати у вигляді:
К1 = [Н+]2/[Н2СО3]= [Н+]2/[СО2]р ,
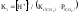 .
.
З останнього рівняння легко вивести залежність концентрації іонів водню в розчині від парціального тиску діоксиду вуглецю в атмосферному повітрі:
[Н+]
= (K1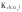 )
РСО2)1/2 .
)
РСО2)1/2 .
Звідси легко знайти рН розчину, що перебуває у контакті з повітрям, яке містить діоксид вуглецю:
рН
= −lg[H+] = lg (K1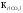 )
) )1/2
.
)1/2
.
Необхідно відзначити, що підходи до оцінювання значення рН при рівновазі для процесів розчинення таких газів, як, наприклад, СО2, SO2, NH3, у воді, що не містить інших домішок, є загальними. Тому останні може бути використано для визначення рН атмосферних опадів, коли в повітрі наявні діоксид вуглецю, діоксид сірки, аміак або інші гази та їх суміші, оскільки в цьому випадку в розчині практично немає джерел домішок, здатних вплинути на розглянуті рівноваги.
Оцінки, проведені для розчинів, які утворюються при контакті з вологою повітря, що містить 0,035‰ діоксиду вуглецю і не містять інших кислих газів, показують, що рН утвореного розчину дорівнюватиме 5,7. Оскільки такий вміст діоксиду вуглецю відповідає середнім значенням, характерним для атмосферного повітря, слід чекати, що рН атмосферних опадів у разі відсутності інших кислих газів і аміаку буде близько 5,7. У реальних умовах рН атмосферних опадів залежить від ступеня забруднення атмосферного повітря і змінюється як у меншу, так і в більшу сторону.
У деяких районах Землі в даний час випадають переважно осади з рН < 5,7; такі осади називають кислотними, часто використовується термін «кислотні дощі». Основний внесок у кислотність таких опадів (до 80%) спричинюють сполуки сірки, близько 15% припадає на сполуки азоту і до 5% кислотності атмосферних опадів повʼязують із сполуками хлору.
Карбонати значно поширені як у донних відкладеннях морів і океанів, так і на поверхні материків. Дуже значні шари вапняків, мергелів та інших карбонатних порід зустрічаються практично всюди.
Серед солей вугільної кислоти (карбонатів) найпоширенішим у природі є карбонат кальцію.
Процес безпосереднього розчинення карбонату кальцію за рівнянням:
СаСО3 = Са2+ + СО32‒ .
практично не грає ролі під час переходу малорозчинних карбонатів у розчин. Солі вугільної кислоти в природних водоймищах можуть переходити в розчин і існувати в ньому в помітних кількостях тільки за наявності розчиненого діоксиду вуглецю:
СаСО3 + СО2(р) ↔ Са2+ + 2НСО3−.
Аніони, що утворюються при цьому, включаються в загальну систему карбонатних рівноваг, яка існує у природних водах, і істотно впливають на рН розчинів.
Залежність між концентрацією іонів кальцію в розчині і парціальним тиском вуглекислого газу над ним, за Н.П.Тарасовою, має вигляд:
[Са2+]3
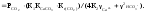
Отримане рівняння свідчить про те, що співвідношення між концентрацією іонів кальцію в розчині і парціальним тиском діоксиду вуглецю над цим розчином нелінійне. Тому при змішуванні природних вод, рівноважних з СаСО3, але із різним парціальним тиском СО2 над розчином, слід чекати отримання нерівноважної за карбонатом кальцію суміші. У цьому разі процес змішування може супроводжуватися розчиненням або осадженням карбонату кальцію.
Крім кальциту й арагоніту в літосфері достатньо поширені карбонатні породи, що містять кальцій і магній – доломіт CaMg(CO3)2 і високомагнезіальні кальцити. Кристалічна структура доломіту подібна до структури кальциту, за винятком того, що атоми Са2+ і Mg2+ розміщені в різних площинах. Порядок розміщення цих атомів відрізняє доломіт від високомагнезіального кальциту того самого складу. Магнезіальні кальцити, що утворюються в районах морського мілководдя, звичайно містять від 11 до 19% (мол.) MgCО3, і їх відносять до високомагнезіальних кальцитів. Кальцит, що містить менше 5%(мол.) MgCO3, називають низькомагнезіальним.
Процес розчинення доломіту можна подати таким рівнянням:
CaMg(CO3)2 ↔ Са2+ + Mg2+ + 2CO32−.
Константа рівноваги цього процесу дорівнює:
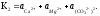
Значення константи рівноваги процесу розчинення доломі-ту, знайдене експериментально, при вивченні рівноваги, що встановилася в природних водах, які були тривалий час у контакті з доломітовими породами, склало Кд = 10−17.
У природі можливе взаємне перетворення кальциту і доломіту:
CaMg(CO3)2 + Са2+ ↔ 2СаСО3 + Mg2+.
Константа рівноваги цього процесу дорівнює відношенню активності іонів магнію і кальцію:
К2д-к = аMg 2+ /аCa2+.
У разі, коли відношення активностей іонів магнію і кальцію в розчині буде більшим від значення константи рівноваги Кд-к реакції, кальцит переходитиме в доломіт, і навпаки. Константу рівноваги цього процесу можна визначити за значенням константи розчинення доломіту і кальциту.
Такі розрахунки дають можливість припустити, що для більшості поверхневих вод кальцит – менш стійка форма карбонатних порід, ніж доломіт, при відношенні концентрацій [Mg2+]/[Ca2+] > 1. В реальних умовах кальцит рідко перетворюється в доломіт при низьких температурах, якщо відношення концентрацій [Mg2+]/[Ca2+] < 10.
