
Физхимия_студентам_1семестр / Домашние зад 1_семестр / Д_задан_3
.docДомашнее задание № 3
Первый закон термодинамики. Правило Кирхгоффа.
-
Выведите аналитическую зависимость теплового эффекта (Дж) реакции А от температуры, если известен тепловой эффект этой реакции при 298 К. Уравнения зависимости СР = (Т) возьмите из справочника. Вычислите тепловой эффект реакции при температуре Т. Постройте графики зависимости НТ = (Т) в том интервале температур, для которого справедливо выведенное уравнение зависимости НТ = (Т). Определите графически
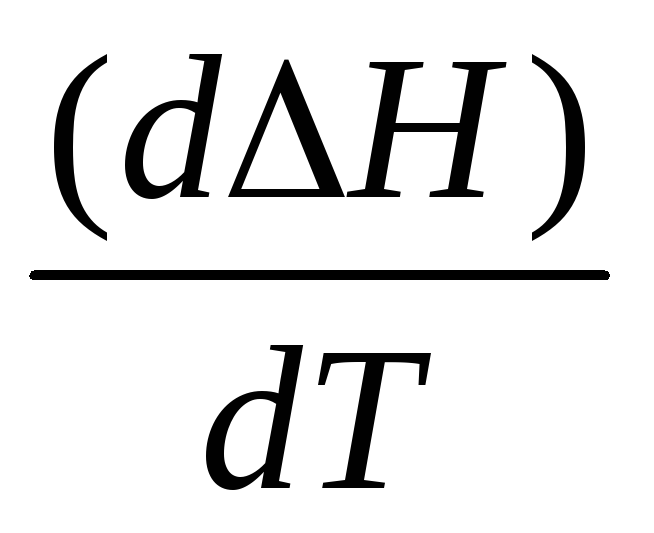 при температуре Т1. Рассчитайте
СР
при этой температуре.
при температуре Т1. Рассчитайте
СР
при этой температуре.
|
№ варианта |
Реакция А |
Т, К |
Т1, К |
|
1 |
2Н2+СО = СН3ОН(г) |
800 |
350 |
|
2 |
4HC1 + O2 = 2Н2О(ж) + 2C12 |
750 |
650 |
|
3 |
-NH4C1 = NH3+HC1 |
455 |
450 |
|
4 |
2N2 + 6Н2О(г) = 4NH3 + 3O2 |
1300 |
1000 |
|
5 |
4NO +6Н2О(г) = 4NH3 + 5O2 |
1000 |
900 |
|
6 |
2NO2 = 2NO + O2 |
700 |
500 |
|
7 |
N2O4 = 2NO2 |
400 |
350 |
|
8 |
Mg(OH)2 = MgO + H2O(г) |
500 |
310 |
|
9 |
CaCO3 = CaO + CO2 |
1000 |
700 |
|
10 |
Ca(OH)2 = CaO + H2O(г) |
500 |
340 |
|
11 |
½S2 (г) + 2Н2О(г) = SO2 +2H2 |
1000 |
900 |
|
12 |
½S2 (г) + 2CO2 = SO2 + 2CO |
900 |
850 |
|
13 |
2SO2 + O2 = 2SO3 |
700 |
600 |
|
14 |
SО2 + C12 = SО2C12 (г) |
400 |
300 |
|
15 |
CO + 3H2 = CH4 + Н2О(г) |
1000 |
900 |
|
16 |
2CO + SO2 = ½S2 (г) + 2CO2 |
900 |
700 |
|
17 |
СО + С12 = СОС12 (г) |
400 |
350 |
|
18 |
CO2 + H2 = CO + Н2О(г) |
1200 |
1000 |
|
19 |
CO2 + 4H2 = CH4 + 2Н2О(г) |
1000 |
900 |
|
20 |
2CO2 = 2CO + O2 |
700 |
500 |
|
21 |
CH4 + CO2 = 2CO + 2H2 |
900 |
320 |
|
22 |
C2H6 = C2H4 + H2 |
400 |
350 |
|
23 |
С2Н5ОН(г) = C2H4+ Н2О(г) |
400 |
300 |
|
24 |
СН3СНО(г) + Н2 = С2Н5ОН(г) |
500 |
450 |
|
25 |
С6Н6(г) + ЗН2 = С6Н12 |
600 |
500 |
-
Определите тепловой эффект химической реакции А при температуре Т. Для расчета воспользуйтесь средними теплоемкостями веществ в интервале температур 298 – Т и таблицей функций (НТ - Н298) из приложения.
|
№ варианта
|
Реакция А
|
Т, К |
№ варианта
|
Реакция А
|
Т, К |
|
1 |
СО + С12 = СОС12 |
500 |
14 |
CO + ½О2 = CО2 |
700 |
|
2 |
CO + ½О2 = CО2 |
500 |
15 |
Н2 + ½О2 = Н2О |
700 |
|
3 |
Н2 + ½О2 = Н2О |
500 |
16 |
NH3 + HC1 = NH4C1 |
600 |
|
4 |
NH3 + HC1 = NH4C1 |
400 |
17 |
2NaOH + CО2 = Na2 CО3 + Н2О |
700 |
|
5 |
2NaOH + CО2 = Na2 CО3 + Н2О |
500 |
18 |
Н2 + ½S2 = Н2S |
700 |
|
6 |
Н2 + ½S2 = Н2S |
500 |
19 |
СО + С12 = СОС12 |
800 |
|
7 |
СО + С12 = СОС12 |
600 |
20 |
Н2 + ½О2 = Н2О |
800 |
|
8 |
CO + ½О2 = CО2 |
600 |
21 |
NH3 + HC1 = NH4C1 |
700 |
|
9 |
Н2 + ½О2 = Н2О |
600 |
22 |
2NaOH + CО2 = Na2 CО3 + Н2О |
800 |
|
10 |
NH3 + HC1 = NH4C1 |
500 |
23 |
Н2 + ½S2 = Н2S |
800 |
|
11 |
2NaOH + CО2 = Na2 CО3 + Н2О |
600 |
24
|
СО + С12 = СОС12 |
900 |
|
12 |
Н2 + ½S2 = Н2S |
600 |
25 |
CO + ½О2 = CО2 |
900 |
|
13 |
СО + С12 = СОС12 |
700 |
|
|
|
Приложение
Функции (Н°Т – Н°298) для некоторых веществ, кДж/моль
|
Т, К |
Н2О |
Н2 |
О2 |
CО2 |
CО |
СОС12 |
Сl2 |
HC1 |
|
300 |
0,084 |
0,054 |
0,054 |
0,084 |
0,084 |
0,126 |
0,064 |
0,084 |
|
400 |
3,743 |
2,958 |
3,025 |
4,017 |
3,012 |
6,234 |
3,538 |
2,971 |
|
500 |
6,945 |
5,883 |
6,084 |
8,326 |
5,941 |
12,845 |
7,109 |
8,889 |
|
600 |
10,544 |
8,812 |
9,242 |
12,929 |
8,953 |
19,790 |
10,748 |
8,870 |
|
700 |
14,226 |
11,749 |
12,502 |
17,782 |
12,050 |
27,029 |
14,424 |
11,841 |
|
800 |
18,033 |
14,703 |
15,841 |
22,803 |
15,188 |
34,434 |
18,134 |
14,853 |
|
900 |
21,966 |
17,673 |
19,246 |
28,033 |
18,410 |
42,007 |
21,860 |
17,949 |
|
1000 |
26,024 |
20,677 |
22,707 |
33,388 |
21,714 |
49,706 |
25,604 |
21,046 |
Продолжение
|
Т, К |
SO2 |
SO2Cl2 |
NH3 |
NH4C1 |
Na2CО3 |
NaOH |
S2 |
Н2S |
|
300 |
0,084 |
0,167 |
0,084 |
0,159 |
0,205 |
0,109 |
0,042 |
0,084 |
|
400 |
4,271 |
8,248 |
3,807 |
9,680 |
11,996 |
6,350 |
4,640 |
3,556 |
|
500 |
8,793 |
16,874 |
7,824 |
23,470 |
26,295 |
13,300 |
8,565 |
7,196 |
|
600 |
13,566 |
25,834 |
12,217 |
33,090 |
40,593 |
34,200 |
12,150 |
11,046 |
|
700 |
18,590 |
35,087 |
16,862 |
43,820 |
57,612 |
42,748 |
15,498 |
15,021 |
|
800 |
23,740 |
44,466 |
21,840 |
- |
74,630 |
51,296 |
73,341 |
19,205 |
|
900 |
29,058 |
53,970 |
27,112 |
- |
91,251 |
59,727 |
75,174 |
23,514 |
|
1000 |
34,459 |
63,559 |
32,635 |
- |
107,872 |
68,157 |
77,019 |
28,033 |
