
- •2.Строение и уровни структурной организации белков
- •3. Найти самой4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •Азотистые основания.
- •Нуклеозиды.
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •1. Протеиногенные аминокислоты
- •1. "Альдегиды. Кетоны".
- •Осмотическое давление
- •Критерии ароматичности[править | править вики-текст]
- •4. Определение общего белка в сыворотке крови по биуретовой реакции
- •Гипопротеинемия
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •Обратимое ингибирование
- •Неконкурентное ингибирование
- •Ингибирование субстратом[править | править вики-текст]
- •Аллостерическое ингибирование[править | править вики-текст]
- •Значения pH в растворах различной кислотности[править | править вики-текст]
- •Методы определения значения pH[править | править вики-текст]
- •3.Лекарственные препараты как конкурентные ингибиторы
- •2. Оксокислоты
- •Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •2.2. Химические свойства
- •Причины ацидоза[править | править вики-текст]
- •Классификации ацидоза[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •Классификация[править | править вики-текст]
- •Этиология[править | править вики-текст]
- •Газовый (респирато́рный) алкалоз[править | править вики-текст]
- •Негазовый алкалоз[править | править вики-текст]
- •Смешанный алкалоз[править | править вики-текст]
- •Патогенез[править | править вики-текст]
- •Лечение[править | править вики-текст]
- •1 Аксиома. Изменение рСо2 крови на 10 мм рт.Ст. Обусловливает реципрокное изменение pH на 0,08.
- •2 Аксиома. Изменение pH на 0,15 является результатом изменения концентрации буферных оснований на 10 ммоль/л.
- •1. 1. Протеиногенные аминокислоты
- •10) Запасная (резервная) функция
- •11) Моторная (двигательная) функция
- •Классификация по типу строения
- •Простые и сложные белки
Обратимое ингибирование
КОНКУРЕНТНОЕ
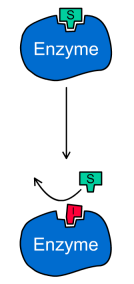
В этом случае ингибитор связывается вактивном центре фермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации Ki' >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
|
|

Неконкурентное ингибирование
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
Бесконкурентное ингибирование[править | править вики-текст]
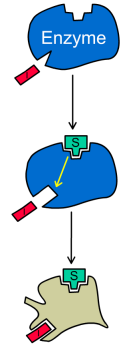
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема
и уравнение Михаэлиса-Ментен в случае
бесконкурентного ингибирования:
|
|
Ингибирование субстратом[править | править вики-текст]
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
|
|
|
Необратимое ингибирование[править | править вики-текст]
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
Аллостерическое ингибирование[править | править вики-текст]
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
4. 2,3-Бифосфоглицерат - аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) - вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
В нормальньж условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к О2.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров.
Центральная полость - место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление О2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α 1 β 1 и α 2 β 2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β -цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к О2. Присоединение БФГ к дезоксигемоглобину происходит в аллостерическом центре.
В лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина. Разрыв
ионных связей между димерами α 1 β 1 и α 2 β 2 приводит к "расслаблению" белковой молекулы, уменьшению центральной полости и вытеснению БФГ.
СМ В УЧЕБНИКЕ ГРАФИЧЕСКОЕ ПОЯСНЕНИЕ
БИЛЕТ 13
1. СМ В ДНЕВНИКЕ
2. Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
![]()
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
![]()
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
![]()
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности(в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активностиводородных ионов, выраженной в молях на один литр:
![]()
