
Физическая и коллоидная химия-2_260800_зачет_2014
.pdf-: системы, имеющие межфазную поверхность.
I:
S: При растворении в воде молекулы ПАВ: -: увеличивают поверхностное натяжение; +: уменьшают поверхностное натяжение; -: не влияют на поверхностное натяжение; -: все ответы верны.
I:
S: Из приведенных твердых адсорбентоов гидрофильной поверхностью обладает: -: тальк; -: парафин; -: угли;
+: силикагели.
I:
S: Из приведенных, твердых адсорбентоов гидрофобной поверхностью обладает: -: силикагели; -: глины; +: графит;
-: все перечисленные адсорбенты.
I:
S: В качестве адсорбента для очистки спирта от сивушных масел в пищевой промышленности используют:
-: силикагели; -: глины; +: угли;
-: молекулярные сита.
I:
S: Примером неограниченной растворимости одной жидкости в другой являются: -: вода - эфир; +: спирт и вода; -: анилин - вода; -: фенол - вода.
I:
S: Примером ограниченной растворимости одной жидкости в другой являются: -: вода - раствор аммиака; -: спирт и вода; -: ацетон - вода; +: анилин - вода.
I:
S: С увеличением концентрации ПАВ поверхностное натяжение растворов: -: не изменяется; -: растет; +: уменьшается;
-: равномерно распределяется по всему объему.
I:
S: Поверхностное натяжение раствора при нагревании: -: уменьшается; -: растет; +: не изменяется;
-: температура не влияет.
I:
S: К 100мл воды добавили 20г спирта. Поверхностное натяжение раствора: +: не измениться; -: растет; -: уменьшается;
-: равномерно распределяется по всему объему.
I:
S: Тип эмульсии не определяют: -: методом смачивания;
-: окрашиванием водоили жирорастворимыми красителями; -: с помощью парафинированной пластинки; +: электрофорезом.
I:
S: Коалесценция - это:
-: процесс укрупнения частиц дисперсной фазы -: адсорбция ионов на адсорбенте +: самопроизвольное слияние жидких капель
-: равномерное распределение частиц в объеме
I:
S: Эмульгирующую способность эмульгатора нельзя оценить: -: по предельному объему эмульгированной дисперсной фазы; -: по объемной концентрации дисперсной фазы; -: по кратности эмульсии; +: по скорости диффузии.
I:
S: Для получения коллоидных растворов необходимо: +: присутствие стабилизатора;
-: добавление электролитов; -: добавление угля; -: ионов водорода.
I:
S: В какой из следующих случаев реакция не осуществима при любых температурах:
-: 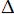 H > 0,
H > 0, 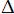 S >0; +:
S >0; +: 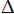 H > 0,
H > 0, 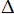 S <0; -:
S <0; -: 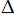 H < 0,
H < 0,  S <0; -:
S <0; -: 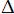 H < 0,
H < 0, 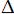 S >0.
S >0.
I:
S: В эндотермических реакциях:
+: энтальпия реакционной смеси увеличивается; -: скорость химической реакции увеличивается при понижении температуры; -: тепловой эффект реакции положителен;
-: для достижения равновесия требуется катализатор; -: равновесие устанавливается быстрее.
I:
S: Укажите формулу для расчета энергии Гиббса (изобарно-изотермического потенциала):
-: 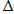 Q=
Q= 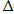 U + A;
U + A;
-:  F =
F = 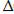 U + T
U + T 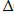 S;
S;
-:  H=
H= 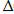 U + P
U + P 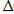 V;
V;
+: 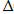 G =
G =  H-T
H-T 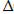 S;
S;
-: 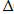 Sx.p. =
Sx.p. = 
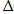 Sпрод. -
Sпрод. - 
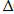 Sucx.
Sucx.
I:
S: Укажите формулу, выражающую I следствие из закона Гесса:
-: 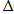 Q =
Q = 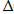 U + А;
U + А;
-:  F =
F = 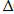 U + T
U + T 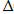 S;
S;
-:  Н =
Н = 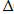 U + P
U + P 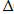 V;
V;
-: 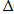 G =
G = 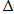 H-T
H-T  S;
S;
+: 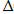 Sx.p. =
Sx.p. = 
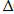 Sпрод. -
Sпрод. - 
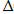 Sucx.
Sucx.
I:
S: Скорость химической реакции - это:
-: время, за которое полностью расходуется одно из исходных веществ; -: время, за которое заканчивается реакция;
+: изменение количества вещества реагентов (или продуктов) в единицу времени в единице объема; -: количество вещества продуктов реакции к моменту окончания реакции;
-: скорость, с которой добавляют химические реактивы.
I:
S: Важнейшим следствием термохимического закона Гесса является утверждение, что тепловой эффект химической реакции равен:
-: сумме теплот образования исходных продуктов; -: сумме теплот образования продуктов реакции;
+: сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов термохимического уравнения реакции; -: сумме теплот образования исходных веществ за вычетом суммы теплот образования продуктов реакции;
-: сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ.
I:
S: Экспериментальные теплоты сгорания веществ определяют в специальном приборе, называемом:
-: спектрофотометром; +: калориметром; -: аппаратом Киппа; -: колориметром.
I:
S: Сформулируйте первое начало термодинамики:
-: скорость химической реакции определяется энергией активации данной реакции; -: физические величины, однозначно определяющие состояние системы, являются функциями состояния;
+: сумма изменения внутренней энергии и совершенной системой (над системой) работы равна сообщенной (или выделенной ею) теплоте; -: при одинаковых условиях в равных объемах различных газов содержится одинаковое число молекул;
-: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате этой химической реакции.
I:
S: Изобарно-изотермический потенциал связан с энтальпией и энтропией следующим соотношением:
-: 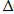 G =
G =  Н + T
Н + T 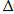 S;
S;
-: 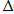 G =
G = 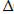 Н - T
Н - T 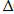 S;
S;
+: 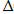 G /Т =
G /Т = 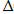 Н +
Н + 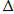 S;
S;
-: 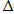 G = Т
G = Т 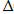 Н +
Н + 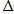 S;
S;
-: 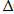 G =
G = 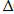 Н +
Н + 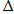 S/T.
S/T.
I:
S: В каких единицах измеряется энтропия? -: Дж/моль; -: кДж/моль;
-: кДж/(моль • К); +: Дж/(моль • К);
-: кДж/К.
I:
S: Четвертым состоянием вещества является плазма, которая представляет собой: +: газ, состоящий из смеси нейтральных и ионизированных частиц и электронов; -: полностью ионизированный газ; -: аморфное вещество; -: жидкие кристаллы;
-: супертяжелое вещество.
I:
S: Величину R в уравнении Клапейрона-Менделеева называют: -: постоянной Авогадро; -: константой Больцмана; -: энергией активации; -: энергией ионизации;
+: универсальной газовой постоянной.
I:
S: Различают два состояния всех твердых веществ: -: хрупкое и мягкое; -: простое и сложное;
-: аллотропное и полиморфное; +: аморфное и кристаллическое; -: прочное и ковкое.
I:
S: Чему равны стандартные энтальпии образования простых веществ:
-: 1 кДж; -: 298 Дж; +: нулю;
-: 273 Дж;
-: зависят от природы вещества.
I:
S: Стехиометрические коэффициенты в термохимических уравнениях указывают на: -: соотношение между количествами веществ; +: реальные количества реагирующих и образующихся веществ; -: массы веществ;
-: скорость расходования и образования продуктов; -: соотношение между массами реагентов.
I:
S: Для описания термодинамической системы какое количество характеристических функций используется:
-: одна; -: две; -: три;
-: четыре; +: пять.
I:
S: При написании в уравнениях энтальпии используется символ:
-: U;
+: Н;
-: G;
-: F;
-: S.
I:
S: Энергией называется:
-: физическая величина, характеризующая направление теплообмена между системами; -: экзотермический химический процесс; +: физическая величина, являющаяся мерой взаимодействия и движения материальных систем; -: термодинамическое состояние системы;
-: количество тепла, выделяющееся в ходе химической реакции.
I:
S: В зависимости от способности химической системы к обмену энергией и веществом с внешней средой, различают три типа систем: изолированные, закрытые и открытые. Внешней средой называют:
-: выделенную (реально или условно) часть материального мира, которая является предметом наблюдения или исследования; -: атмосферу Земли;
+: всю остальную часть материального мира вне пределов выделенной из него системы; -: стенки реакционного сосуда; -: помещение лаборатории.
I:
S: Изолированная система с внешней средой:
-: обменивается энергией, но не обменивается веществом; +: не обменивается ни энергией, ни веществом; -: обменивается веществом, но не обменивается энергией; -: обменивается и энергией, и веществом;
-: в зависимости от условий, обменивается то энергией, то веществом.
I:
S: Закрытая система с внешней средой:
+: обменивается энергией, но не обменивается веществом;
-: не обменивается ни энергией, ни веществом; -: обменивается веществом, но не обменивается энергией; -: обменивается и энергией, и веществом;
-: в зависимости от условий, обменивается то энергией, то веществом.
I:
S: Открытая система с внешней средой:
-: обменивается энергией, но не обменивается веществом; -: не обменивается ни энергией, ни веществом; -: обменивается веществом, но не обменивается энергией; +: обменивается и энергией, и веществом;
-: в зависимости от условий, обменивается то энергией, то веществом.
I:
S: Сформулируйте третье начало термодинамики.
+: скорость химической реакции определяется энергией активации данной реакции; -: физические величины, однозначно определяющие состояние системы, являются функциями состояния;
-: сумма изменения внутренней энергии и совершенной системой (над системой) работы равна сообщенной (или выделенной ею) теплоте; -: при одинаковых условиях в равных объемах различных газов содержится одинаковое число молекул;
-: энтропия идеального ионного кристалла при абсолютном нуле равна нулю.
I:
S: Ниже приведены формулировки второго начала термодинамики. Какое из них неверно: -: невозможна самопроизвольная передача тепла от более нагретого тела к менее нагретому телу; -: состояние с максимальной энтропией является наиболее устойчивым состоянием для
изолированной системы; +: энтропия идеального ионного кристалла при абсолютном нуле равна нулю;
-: при протекании любого реального процесса невозможно обеспечить средства возвращения каждой из участвующих в нем систем в ее исходное состояние.
