
Лабораторные работы / Лабораторная работа 1 - FSiH3 - 2009 / Лаба1_FSiH3
.pdfЦели и задачи расчета.
Определение критериев выбора и изучение принципов построения стандартного базисного набора для расчета молекулярных систем. Изучение методов интерпретации результатов расчета и представления молекулы в виде вектора свойств на их основе. Знакомство с программным комплексом GAMESS.
Выполнение неэмпирического расчета молекулы FSiH3 по программному комплексу GAMESS с оптимизацией геометрии. Оценка на основании результатов расчета стабильности и факторов, определяющих реакционную способность этой молекулы.
Характеристика и обоснование выбора метода расчета и базиса для решения поставленной задачи. Описание способа построения базисного набора.
Расчет молекулы FSiH3 осуществлен по программному комплексу GAMESS в стандартном базисном (валентно-расщепленном) наборе Попла 6-31G*. Валентные АО представлены линейными комбинациями 2 сжатых комбинаций гауссовых орбиталей, остовные АО – 1-й. На каждом неводородном атоме также центрировано по 6 компонент поляризационных d-функций. Таким образом, базис для расчета молекулы FSiH3 состоит из 40 функций:
F – 1·1s + 2·4·(2s + 2p) + 6·3d = 15;
Si – 1·1s + 1·4·(2s + 2p) + 2·4·(3s + 3p) + 6·3d = 19; H – 2·1s = 2;
FSiH3 – 15 + 19 + 2·3 = 40.
Все валентные базисные функции двухэкспоненциальные (6-31G*), остовные 1s АО — одноэкспоненциальные, s- и p-сжатые гауссовы орбитали, соответствующие (с формальной точки зрения) главному квантовому числу, свернуты в sp-оболочки [(2s + 2p), (3s + 3p)] и представлены различными линейными комбинациями гауссовых примитивов с одинаковыми экспоненциальными множителями.
Каждая остовная орбиталь представлена линейной комбинацией из 6 гауссовых примитивов (6-31G*). Каждая орбиталь для валентных электронов представлена линейной комбинацией либо из 3, либо из 1 гауссовых примитивов.
Базис 6-31G* является наименьшим из возможных базисов, пригодным для расчета длин связей и валентных углов молекулы FSiH3 с экспериментальной точностью. Добавление поляризационных d-функций учитывает поляризацию электронных оболочек атомов галогенов при образовании связей; это обеспечивает уменьшение длины связей на ~ 0.05 Å.
Интерпретация результатов расчета
1. Оценка стабильности молекулы
Энергия образования молекулы FSiH3, или энтальпия образования молекулы FSiH3 при 0К в бесконечно разреженном газе без учета энергии нулевых колебаний, вычисляется по формуле:
fH0(FSiH3) = E(FSiH3) – 1/2 E(F2) – 1/2 E(Si2) – 3/2 E(H2),
где E(FSiH3) — полная энергия молекулы, полученная в данной работе E(FSiH3) = -390.147 а.е.
E(F2) = -198.677757 a.e. E(Si2) = -577.636556 a.e. E(H2) = -1.126828 a.e.
fH0(FSiH3) = -390.147 + 1/2·198.677757 + 1/2·577.636556 + 3/2·1.126828 = = -0,300 а.е. = -785,0 кДж/моль
Экспериментально полученное значение: -408 кДж/моль (Farber, M.; Srivastava, R. D. Chem. Phys. Lett. 1977, 51, 307).
Расчетное и экспериментальное значения отличаются почти в 2 раза. Молекула стабильна (ΔfH0(FSiH3) < 0).
2. Свойства связей молекулы
Рассчитанные длины связей: Si–F = 1.600 Å;
Si–H = 1.476 Å.
Угол F–Si–H составил 108,6 градусов, двугранный угол F–Si–H–H – 120 градусов.
Экспериментальные данные (А.Гордон, Р.Форд, Спутник химика, М., 1972, с.128):
Si–F = 1,561±0,005 Å; Si–H = 1,476±0,005 Å.
Длины связей определены с достаточной точностью, причем для связи Si-H расчет полностью согласуется с экспериментом, для связи Si-F погрешность составляет 2,5%.
Порядки связей: Si–F = 0.832; Si–H = 0.947.
Валентность по Коулсону: F = 0.853;
Si = 3.674;
H = 0.962.
Вывод: связи в молекуле ковалентные.
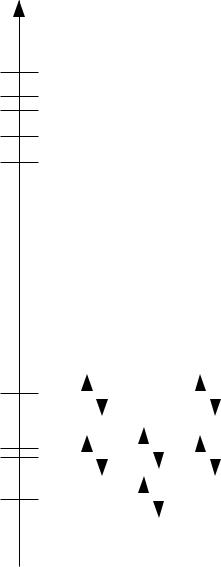
3. Построение диаграммы энергетических уровней
E, а.е.
0,3606
0,2969
0,2598
0,1902
0,1228
-0,4887
-0,6345 -0,6580
-0,7690
φ19 |
|
|
|
|
φ20 |
||
|
|
|
|
|
|
φ18 |
|
|
|
|
|
|
|
|
|
φ |
15 |
|
|
|
φ17 |
φ16 |
|
|
|
|
|||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
φ14 |
НВМО |
|
|
|
|
|
|
||
|
|
|
|
|
φ12 |
|
|
|
|
|
|
|
φ13 |
ВЗМО |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
φ11 |
|
|
|
|
|
||||
φ |
9 |
|
|
|
|
|
|
|
|
|
φ |
10 |
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
φ8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Определение нуклеофильных/электрофильных свойств молекулы. Определение жесткости/мягкости молекулы.
Энергия нижней вакантной молекулярной орбитали составляет +0,1228 эВ, соответственно, молекула проявляет себя как нуклеофил.
Энергетическая щель между ВЗМО и НВМО составляет +0,1228-(-0,4887) = = 0,6115 а.е. = 16,64 эВ > 1 эВ, соответственно, реагент является жёстким. Жёсткость молекулы определяется как:
η = ½ (ЕНСМО — ЕВЗМО) = ½ · 16.64 = 8.32.
5. Определение положения реакционных центров
Положение реакционных центров в жестких реагентах приближенно определяется зарядами на атомах. Распределение зарядов на атомах молекулы по Малликену:
F = -0.503;
Si = + 0.866;
H = -0.121.
Электрофильная атака будет протекать по атому фтора, нуклеофильная - по атому кремния.
6. Оценка растворимости
Дипольный момент молекулы FSiH3 составляет согласно расчетам 1.53 Д, что является относительно высокой величиной, соответственно, соединение должно быть хорошо растворимо в полярных растворителях (воде, ДМФА, ДМСО, спиртах).
