
- •Оглавление
- •ВВЕДЕНИЕ
- •1. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.11. Химический потенциал
- •2. ПОНЯТИЕ О ФАЗОВЫХ РАВНОВЕСИЯХ
- •3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •4. ТЕРМОДИНАМИКА РАСТВОРОВ
- •5. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.9. Катализ
- •7. КОЛЛОИДНЫЕ СИСТЕМЫ
- •7.4. Адсорбция
- •7.5. Мицеллообразование
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ГЛОССАРИЙ

7.КОЛЛОИДНЫЕ СИСТЕМЫ
7.4.Адсорбция
σ
σводы
σу
ККМ СПАВ
Рис. 34. Зависимость поверхностного натяжения воды σ от концентрации ПАВ – СПАВ
Следует знать, что ПАВ характеризуются специфическими особенностями:
1)способностью понижать поверхностное и межфазное натяжение в очень разбавленных растворах вследствие адсорбции и ориентации молекул на поверхности раздела;
2)незначительной величиной максимально возможной концентрации их в растворе в молекулярной форме;
3)образованием мицелл выше определенной так называемой критиче-
ской концентрации мицеллообразования (ККМ) (см. рис. 34);
4)сольюбилизацией (гидрофобным связыванием) водно-нерастворимых
веществ внутри мицелл.
7.5. Мицеллообразование
Как и адсорбция, явление мицеллообразования связано с молекулярными взаимодействиями ее полярных молекул (частей молекул) и гидрофобными сцеплениями углеводородной цепи.
Выше ККМ системы вода – ПАВ представляют собой коллоидные системы.
Молекулы ПАВ являются основными составляющими моющих средств. В области малых концентраций выше ККМ мицеллы мыла достаточно симметричны, сохраняют сфероидальную форму и равномерно покрыты с поверхности гидратированными группами. Это означает, что мицеллы вполне стабилизированы. Их межфазное натяжение – удельная свободная поверхностная энергия на границе с окружающей дисперсионной средой – близко к 0. Они не могут поэтому взаимодействовать друг с другом, образуя анизометрические цепочки или пространственные сетки. При дальнейшем возрастании концентрации выше некоторого критического значения мицеллы, стано-
Физическая химия. Учеб. пособие |
128 |

7.КОЛЛОИДНЫЕ СИСТЕМЫ
7.5.Мицеллообразование
вясь все более и более асимметричными, вызывают появление ярко выраженной аномалии вязкости.
Строение мицелл в полярном (в воде) и неполярном ( в углеводороде) растворителях приведено ниже:
В воде |
В углеводороде |
Одна из особенностей ПАВ в коллоидных дисперсиях (т.е. при концентрациях водного раствора выше ККМ) состоит в их способности обратимо сольюбилизировать (растворять) углеводороды или вообще гидрофобные вещества, практически нерастворимые в воде, в ядрах мицелл. Сольюбилизация характеризуется равновесным распределением гидрофобного вещества между двумя фазами: истинным водным раствором мылообразных ПАВ и внутренними частями (ядрами) мицелл коллоидной фазы. Явление сольюбилизации определяет моющие свойства мыл – способность удалять с поверхностей гидрофобные вещества, нерастворимые в чистой воде.
Белковые вещества, существенно отличаясь по своей химической природе от обычных мыл и являясь высокомолекулярными соединениями, имеют с мылами общее свойство – они обладают поверхностной активностью, а вследствие этого – и сольюбирующей способностью.
Явление сольюбилизации (гидрофобного связывания) в белковых системах представляет большой интерес как для строения белка, так и для изучения биологически важных процессов переноса и обмена веществ в организме. Сольюбилизация углеводородов в растворах белков, как и в случае мицеллярных растворов мыл, связана с проникновением углеводородов в неполярные ядра белковых структур. Явление сольюбилизации является составной частью ферментативного катализа. Биологические катализаторы белковой природы (ферменты) имеют гидрофобные «карманы», которые обычно являются активными центрами ферментов, где происходят химические реакции. Благодаря явлению сольюбилизации субстраты этих реакций «затягиваются» в активные центры и упорядочиваются оптимальным для реакции образом.
Всвязи с исследованием сложных биологических мембран, их свойств
ифункций, особый интерес представляет поведение глобулярных белков на границе раздела фаз. Белки, являясь поверхностно-активными веществами,
Физическая химия. Учеб. пособие |
129 |

7.КОЛЛОИДНЫЕ СИСТЕМЫ
7.5.Мицеллообразование
адсорбируются на поверхности раздела различных твердых и жидких фаз. При адсорбции они ориентируются неполярными группами в менее полярную фазу, а полярными группами – к воде.
Формирование адсорбционного слоя высокомолкулярных соединений протекает во времени, в отличие от низкомолекулярных ПАВ, для которых образование равновесного слоя происходит практически мгновенно. Временная зависимость формирования адсорбционного слоя и возникновение прочного межфазного слоя из высокомолекулярных соединений обусловлена замедленной диффузией адсорбирующихся макромолекул и медленной ориентацией их на границе раздела фаз. Различия в адсорбции высокомолекулярных соединений и низкомолекулярных ПАВ объясняются также следующим: адсорбция низкомолекулярных ПАВ полностью обратима, а высокомолекулярных – необратима. Высокомолекулярные вещества после определенного промежутка времени образуют пленки на поверхности водного раствора. Вместе с тем некоторые сегменты высокомолекулярных белков на поверхности могут оставаться подвижными.
7.6. Двойнойэлектрическийслой иэлектрокинетическиеявления
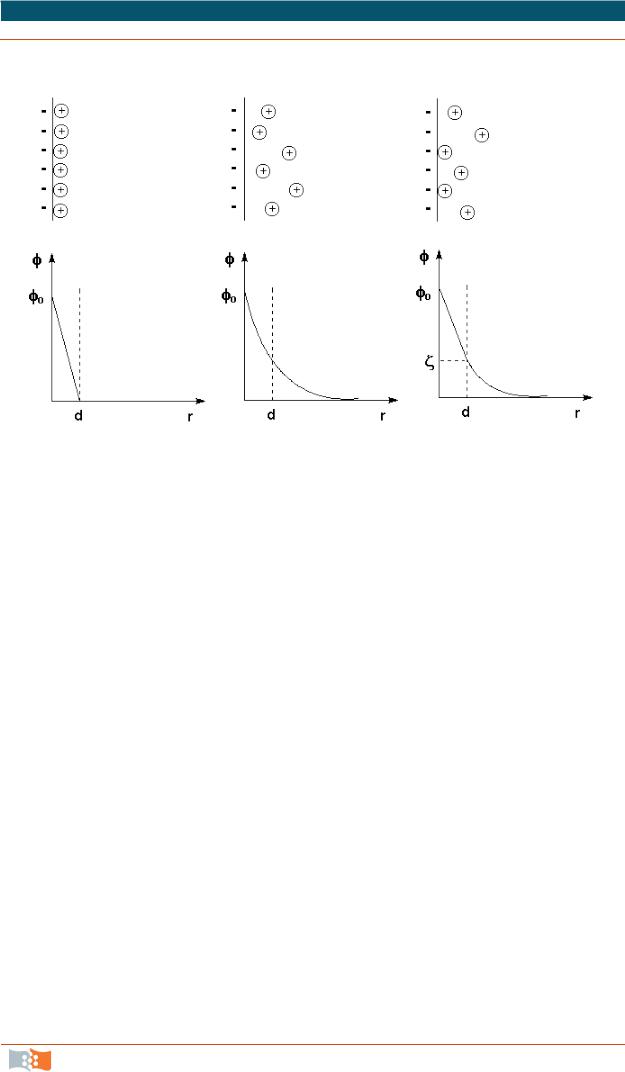
При рассмотрении строения мицеллы было показано, что на поверхности коллоидных частиц образуется двойной электрический слой (ДЭС). Первая теория строения ДЭС была развита Гельмгольцем и Перреном; в их представлении двойной электрический слой подобен плоскому конденсатору, внутренняя обкладка которого находится в твердой фазе, а внешняя – в жидкости параллельно поверхности ядра на расстоянии порядка диаметра иона. Потенциал электрического поля внутри ДЭС φ в этом случае линейно уменьшается с увеличением расстояния от поверхности r (рис. 35, а). Позднее Гуи и Чепмен предложили другую модель, согласно которой противоионы, благодаря тепловому движению, образуют вблизи твердой поверхности ядра диффузную ионную атмосферу. Уменьшение электрического потенциала ДЭС φ с увеличением расстояния r в этом случае происходит нелинейно
(рис. 35, б).
Физическая химия. Учеб. пособие |
130 |
7.КОЛЛОИДНЫЕ СИСТЕМЫ
7.6.Двойной электрический слой и электрокинетические явления
а |
б |
в |
Рис. 35. Строение ДЭС: |
а) по Гельмгольцу и Перрену; |
б) по Гуи и Чепмену; |
в) по Штерну (вверху – схема расположения противоионов, внизу – зависимость потенциала от расстояния)
Предложенная Штерном модель строения ДЭС объединяет ранние модели, учитывая как адсорбцию противоионов, так и их тепловое движение. Согласно этой модели, являющейся в настоящее время общепринятой, часть противоионов находится на расстояниях порядка диаметра иона от поверхности ядра, образуя слой Гельмгольца (адсорбционный слой противоионов), а другая часть образует диффузный слой (рис. 35, в). Потенциал диффузной части двойного электрического слоя называют электрокинетическим потенциалом и обычно обозначают греческой буквой ζ (дзета) и называют поэтому дзета-потенциалом. Посколькуζ-потенциал пропорционален заряду коллоидной частицы, агрегативная устойчивость золя пропорциональна его величине.
Если поместить золь в постоянное электрическое поле, то, как и в растворах электролитов, заряженные частицы будут двигаться к противоположно заряженным электродам: коллоидная частица с адсорбированными на ней противоионами – в одну сторону, противоионы диффузного слоя – в другую. Сила, с которой электрическое поле действует на частицы и, следовательно, скорость движения частиц, очевидно, будет пропорциональнаζ -потенциалу. Движение частиц дисперсной фазы в электрическом поле называется электрофорезом. Электрофорез – пример электрокинетических явлений.
Физическая химия. Учеб. пособие |
131 |

7.КОЛЛОИДНЫЕ СИСТЕМЫ
7.6.Двойной электрический слой и электрокинетические явления
Величина ζ-потенциала связана со скоростью движения частиц дисперсной фазы при электрофорезе U, напряженностью электрического поля E, вязкостью среды η, диэлектрической проницаемостью дисперсионной среды
εуравнением Гельмгольца – Смолуховского):
ξ= KπηεEU .
Здесь K – постоянная, зависящая от формы частиц дисперсной фазы; для сферических частиц K = 6.
В зависимости от условий, одна и та же система может существовать либо в виде истинного раствора, либо в виде коллоидной системы. При этом изменяются вязкость сред и скорость диффузионных процессов переноса вещества. Такие переходы являются важными в различных внутриклеточных процессах.
Физическая химия. Учеб. пособие |
132 |
