
- •Вопросы к коллоквиуму I
- •2) Закон Гесса: Тепловой эффект химической реакции не зависит от промежуточных стадий реакции (пути протекания процесса), а определяется только состоянием исходных веществ и продуктов реакции.
- •3) Энтропия: свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса:
- •6) Размерность константы химического равновесия – безразмерна.
- •7) Сдвиг химического равновесия
2) Закон Гесса: Тепловой эффект химической реакции не зависит от промежуточных стадий реакции (пути протекания процесса), а определяется только состоянием исходных веществ и продуктов реакции.
Следствие:
-
тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
-
Тепловой эффект реакции равен разности между суммой теплот образования всех продуктов реакции и суммой теплот образования всех реагентов, взятых с соответствующими стехиометрическими коэффициентами.
Эндоэффект: процесс, протекающий с поглощением тепла.
Экзоэффект: процесс, протекающий с выделением тепла.
Причины: энергия выделяется, если в результате химических процессов происходит образование новых связей.
Энергия поглощается, если в результате химических процессов происходит разрыв связей (разрушение кристаллической решетки).
3) Энтропия: свойство системы, изменение которого при обратимом процессе численно равно отношению теплоты к температуре протекания процесса:
∆S=Q/T. Дж/(моль*К). 
 ;
k – константа Больцмана
(1,38 * 10-25 Дж/К).
;
k – константа Больцмана
(1,38 * 10-25 Дж/К).
Микросостояние указаны координаты частиц, скорость, направление, энергия.
Энтропия — мера неупорядоченности системы.
Физический смысл энтропии состоит в том, что она является мерой вероятности или степени неупорядоченности данной системы; возрастание вероятности всегда сопровождается возрастанием энтропии.
При нагревании выше 0 К и до температуры плавления энтропия вещества возрастает прежде всего за счет
увеличения распределения частиц по
колебательным уровням энергии. В этом
интервале температур для обратимого
нагревания при постоянном давлении
энтропия может быть рассчитана по
формуле: ![]()

Значения энтропии различных веществ
при 298 К и давлении 1 атм ( )
сведены в таблицы. Энтропии простых
твердых веществ составляют десятки
Дж/(моль • К). Для газообразных веществ
энтропия значительно выше — порядка
нескольких сотен и зависит от массы
частиц и их геометрического строения.
)
сведены в таблицы. Энтропии простых
твердых веществ составляют десятки
Дж/(моль • К). Для газообразных веществ
энтропия значительно выше — порядка
нескольких сотен и зависит от массы
частиц и их геометрического строения.
Стандартная энтропия образования Sоf,298 (или Sообр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
На основании данных о стандартной энтропии веществ можно рассчитать изменение энтропии различных химических процессов. Поскольку энтропия является функцией состояния, то ее изменение не зависит от пути процесса и равно разности энтропии продуктов реакции и исходных веществ.
![]()
 Ф.П.
– фазовый переход.
Ф.П.
– фазовый переход.
Энтропия – функция состояния в изолированной системе (∆S=0).
Во многих случаях изменение энтропии процесса можно оценить качественно:
• Энтропия всегда увеличивается при
переходе из конденсированного состояния
(твердого или жидкого) в парообразное,
например,
 I2(тв.)
= = 117 кДж/(моль• К), a
I2(тв.)
= = 117 кДж/(моль• К), a
 I2(r.)
= 260,6 Дж/(моль- К);
I2(r.)
= 260,6 Дж/(моль- К);
• Энтропия возрастает при растворении твердого или жидкого вещества, причем чем больше степень диссоциации, тем заметней увеличивается энтропия. При растворении газов, напротив, энтропия уменьшается.
• Чем сложнее состав вещества, тем больше его энтропия. Например, для оксидов марганца МпО, Мп2Оэ и Мп304 энтропия равна соответственно 61,50; 110,5 и 154,8 Дж/(моль • К);
• В химических реакциях энтропия возрастает, если в результате их увеличивается количество газообразных веществ.
Второй закон термодинамики: Невозможно осуществить перенос тепла от более холодного тела к более горячему, не затрачивая на это работу (Р. Клаузиус). В изолированных системах самопроизвольно идут процессы, при которых происходит увеличение энтропии (∆Sизол > 0).
Третий закон термодинамики (постулат Планка): энтропия идеального кристалла чистого вещества при абсолютном 0 К равна 0.
4) Свободная энергия (G): это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
G=U+PV-TS
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
∆G=Gкон-Gнач
В химических процессах одновременно действуют два противоположных фактора — энтропийный и энтальпийный. Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса:
∆G=∆H-T∆S
величина ∆G характеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу.
G0 - это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса
(∆G < 0). При достижении равновесия в системе ∆G = 0.
-
Если
 < 0,
< 0,
 > 0, то
> 0, то
 < 0 всегда (процесс может протекать
самопроизвольно при любой температуре).
< 0 всегда (процесс может протекать
самопроизвольно при любой температуре). -
Если
 > 0,
> 0,
 < 0, то
< 0, то
 > 0 всегда (процесс не протекает ни при
какой температуре).
> 0 всегда (процесс не протекает ни при
какой температуре). -
Если
 < 0,
< 0,
 < 0, то
< 0, то
 < 0 при Т <
< 0 при Т <
 (процесс
идет при низкой температуре за счет
энтальпийного фактора).
(процесс
идет при низкой температуре за счет
энтальпийного фактора). -
Если
 > 0,
> 0, > 0, то
> 0, то
 < 0 при Т >
< 0 при Т >
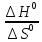 (процесс идет при высокой температуре
за счет энтропийного фактора).
(процесс идет при высокой температуре
за счет энтропийного фактора).
5) Химические равновесие – это состояние системы, при котором скорость прямой реакции равно скорости обратной реакции. Химическое равновесие - это такое состояние системы, когда число молекул в системе остается постоянным во времени при постоянных внешних условиях. При химическом равновесии число образующихся в единицу времени молекул при прямой реакции равно числу молекул вступивших во взаимодействие при обратной реакции, т.е. химическое равновесие является ДИНАМИЧЕСКИМ.
Характеризуется:
-
Количества в-в не зависят от времени
-
Отсутствуют потоки массы и энергии
Признаки химического равновесия:
-
В системе не происходит видимых во времени изменений при отсутствии внешнего воздействия
-
Снятие внешних воздействий приводит к возвращению к равновесию (самое малое воздействие приводит к смещению равновесию в сторону ослабляющую это воздействие).
-
равновесие достигается как при прямой, так и при обратной реакции.
Истинное хим. равновесие – G=0.
Ложное хим. равновесие
Константа химического равновесия - величина, выражающая соотношение констант скорости прямой и обратной реакции или соотношение произведений концентраций продуктов реакции к произведению концентрации реагентов.
Она показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равны 1 моль/л. В этом заключается физический смысл константы химического равновесия K.
