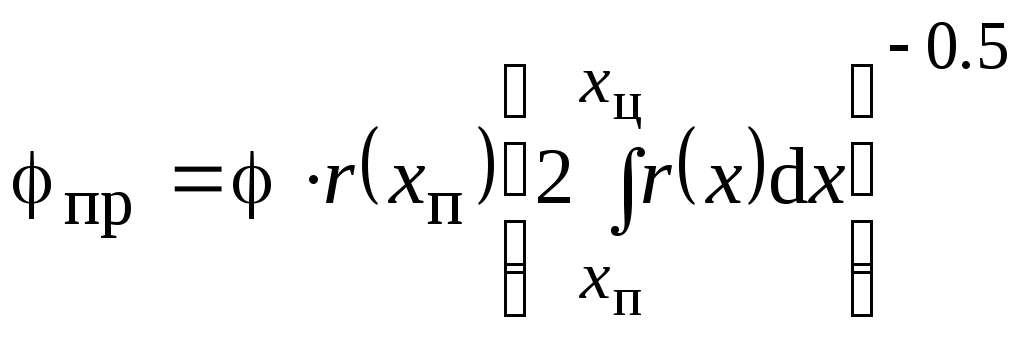Лабораторные работы / Теория (3 работы) - Бесков - 2003 / Pr-catalyst
.docПРОЦЕСС В ПОРИСТОМ ЗЕРНЕ КАТАЛИЗАТОРА
Математическая модель процесса в пористом зерне катализатора
Пористое зерно катализатора - квазигомогенная среда. Процесс – изотермический. Внешний массообмен не влияет на процесс.
![]() (1)
(1)
при r = R0: С(R0) = Сп
при r = 0: dС/dr = 0
где Dэф - эффективный коэффициент диффузии;
r - текущий радиус зерна (коородината);
R0 - размер (радиус) зерна;
- параметр, определяющий форму зерна: = 0 - пластинка,
= 1 - цилиндр,
= 2 - шар;
w(с) - скорость превращения вещества;
С, Сп - концентрация текущая и на поверхности зерна.
В программе используется "вычислительная" модель процесса:
![]()
при = 1: х = хп (2)
при = 0: dх/d = 0
где х = (С0 - С)/С0 - степень превращения исходного вещества;
С0 - начальная концентрация реагента в исходной непрореагировавшей смеси (С0 может отличаться от CН, если зерно катализатора окружает частично прореагировавшая реакционная смесь);
хп - степень превращения исходного вещества у поверхности зерна;
= r/R0 - безразмерный радиус;
r(x) = - w(C(x))/С0 – приведенная скорость реакции.
Если протекает сложная реакция, то система (2) должна быть дополнена уравнением (3):
![]()
(3)
при = 1: y(1) = yп; при = 0: dy/d = 0
где y, уп - степень превращения А в R (в один из продуктов) в объеме и на поверхности.
Кинетические уравнения предусмотренные в программе (в приведенной форме):
- простая необратимая реакция AA + BB продукты
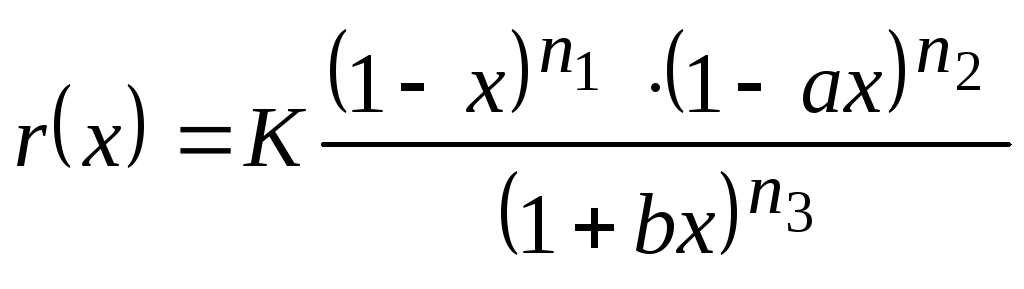 (4)
(4)
- простая обратимая
реакция AA
+ BB RR
+ SS
простая обратимая
реакция AA
+ BB RR
+ SS
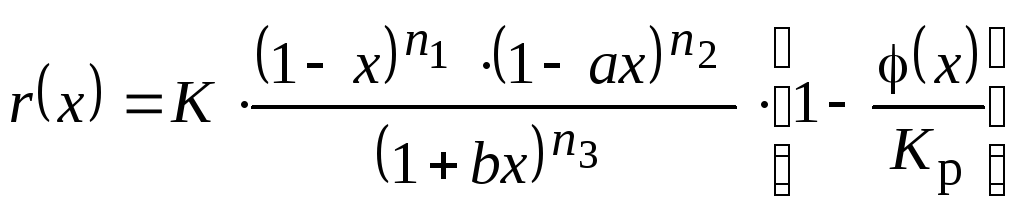 (5)
(5)
Функция
![]() учитывает oбратимость реакции, и в
программе рассчитывается через степень
превращения исходного вещества А. Для
расчета задают начальные концентрации
исходных компонентов А и В и
стехиометрические коэффициенты A,
B, R,
S в уравнении
реакции.
учитывает oбратимость реакции, и в
программе рассчитывается через степень
превращения исходного вещества А. Для
расчета задают начальные концентрации
исходных компонентов А и В и
стехиометрические коэффициенты A,
B, R,
S в уравнении
реакции.
1 3
-
 сложная реакция A R
S
сложная реакция A R
S

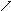 2
2

с кинетическим уравнением n-го поpядка для каждого этапа
![]() (6)
(6)
Для сложной реакции в уравнениях (2)-(3) используется r(x) = r1 + r2, rR(x,y) = r1 - r3.
Показатели процесса в пористом зерне катализатора.
Решение уравнений (2) и (3) дает распределение x по глубине зерна. Наблюдаемая скорость превращения Wн есть среднеинтегральная (отнесенная к единице объема зерна):
![]() (7)
(7)
Аналогично рассчитывается среднеинтегральная скорость превращения WRн компонента R при протекании сложной реакции.
Степень использования внутренней поверхности (эффективность процесса)
= Wн/W(хп) (8)
При протекании сложной реакции рассчитывается селективность превращения по компоненту R
SRн = WRн/Wн (9)
Возможности программы "Пористое зерно катализатора" лабораторного программного комплекса Lab-OXT
Расчет процесса в пористом зерне катализатора при протекании простой или сложной реакций включает:
- распределение степени превращения в пористом зерне- х(), у();
- наблюдаемая скорость превращения Wн;
- степень использования внутренней поверхности (эффективность процесса);
- наблюдаемая селективность процесса Sн (для сложной реакции);
- параметры процесса
|
Модуль Зельдовича-Тиле |
Параметр модифицированный |
Параметр приведенный |
|
= Ro |
м
=
|
|
где Vз, Sз - объем и наружная поверхность зерна; хц – максимально возможная степень превращения в центре зерна (во внутридиффузионной области: хц = 1 для необратимой реакции, хц = хравн для обратимой реакции).
Вводимые исходные данные
Форма зерна катализатора - пластинка с непроницаемыми торцевыми гранями, цилиндр с непроницаемыми торцами, шар.
Вид кинетической модели - простая обратимая или необратимая, сложная реакции.
Параметры выбранной кинетической модели: K, KP, а, b, n1, n2, n3, - см. уравнения (4)-(6).
Параметры и условия процесса - размер зерна R0, эффективный коэффициент диффузии Dэф, значения x и y на поверхности зерна – xп и yп.
Если форма зерна отлична от форм, предусмотренных программой, то достаточную точность расчета степени использования внутренней поверхности дает следующее:
-
использовать приведенный размер зерна R0 = 3Vз/Sз и проводить расчет для шара;
-
или использовать R0 = Vз/Sз и проводить расчет для пластинки.
Результаты расчета
Выводятся данные, перечисленные в разделе "Возможности программы". Распределения - х() и у() выводятся в табличном или графическом виде.
Рекомендации по выполнению задания
Выполнение задания требует подготовки исходных данных для расчета. Из перечня исходных данных, которые перечислены выше и будут запрашиваться программой, представьте себе как их получить или рассчитать из формулировки задания.
Важно ! 1) Обычно кинетические данные в задании представлены в виде зависимости скорости превращения от концентрации компонентов, например, w = - kC, или w = - kC2, или w = - kCАСВ и т.д. Необходимо перейти к "вычислительной" форме кинетической зависимости (4), (5) или (6) и определить параметры K а, b, n1 и др. Они не обязательно будут совпадать с подобными параметрами исходного кинетического уравнения. Примеры.
Реакция первого порядка w(C) = -kC.
В расчетном виде
![]() .
Это выражение для r(х)
получим, если в функции (4) используем
такие коэффициенты:
.
Это выражение для r(х)
получим, если в функции (4) используем
такие коэффициенты:
K = k, а = в = 0, n1 = 1, n2 = n3 = 0.
Реакция второго порядка w(C) = -kC2.
В расчетном виде
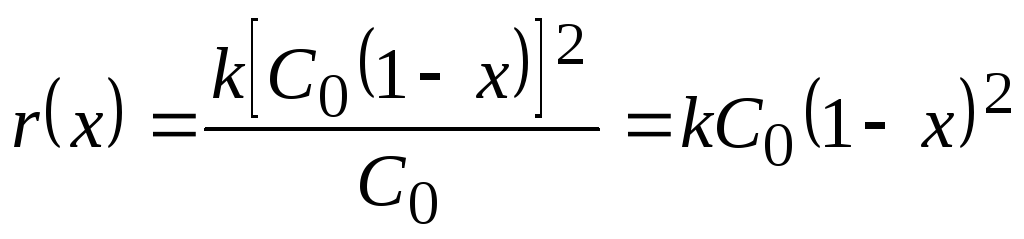 .
Это выражение для r(х)
получим, если в функции (4) используем
такие коэффициенты:
.
Это выражение для r(х)
получим, если в функции (4) используем
такие коэффициенты:
K = kСо, а = в = 0, n1 = 2, n2 = n3 = 0.
Реакция A + 2B = R + ..... первого порядка по компонентам А и В: w(C) = -kCACB.
Начальные концентрации компонентов А и В: CA0 и CB0;
Исходный компонент - вещестово А, и его степень превращения – х.
Текущие концентрации: СA = СA0(1 - х), СB= СB0 – 2СA0x.
В расчетном виде
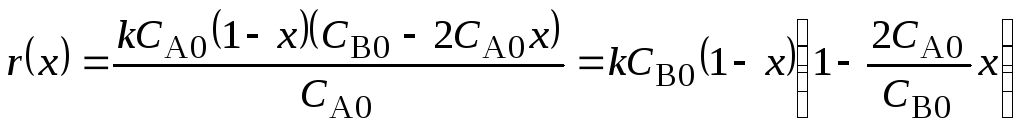 .
Это выражение для r(х)
получим, если в (4) используем такие
коэффициенты:
.
Это выражение для r(х)
получим, если в (4) используем такие
коэффициенты:
K = kcB0, а = 2СA0/СB0, в = 0, n1 = n2 = 1, n3 = 0.
Сложная реакция представлена кинетическими уравнениями:
![]()
где k1, k2, k3 – константы скорости частных реакций; n1, n2, n3 – порядки частных реакций.
Расчетный вид кинетических
уравнений (6) получим, если в них
использовать
![]()
2) При подготовке данных необходимо соблюдать размерности используемых величин. Например, в уравнениях (3.3)-(3.4) все его члены (в том числе x - безразмерные. Поэтому размерности величин, входящих в выражение (3.5) для x) должны быть, например, такие: W(x) c-1, R0 см, Dэф [см2/с}. Если размерность скорости реакции w(c) [моль/м3с], то размерность c0 должна быть [моль/м3], чтобы получить размерность W(x) = w(c)/co [c-1].