
Экзамен - Задачи - 2000 / Ex-balance
.docI. Основные технологические показатели химического производства
1-1. Химический состав оконного (силикатного) стекла выражается формулой Na2OCaO6SiO2; составные части стекла образуются из следующих продуктов: Na2O - из соды; CaO - из известняка; SiO2 - из песка. Рассчитать теоретические коэффициенты по сырью при производстве стекла, если сода содержит 93,8 % Na2CO3, известняк содержит 90,5 % СаСО3 и песок 99,0 % SiO2.
1-2. Сколько потребуется сульфата железа FeSO47H2O и хромового ангидрида CrO3 для получения 1 т железохромового катализатора конверсии окиси углерода, имеющего состав: Fe2O3 - 90 %; Cr2O3 - 10 %.
1-3. Негашеная известь содержит 94 % CaO, 12 % CO2 и 4.8 % примесей. Получается она обжигом известняка, содержащего 89 % СаСО3. СО2 в негашеной извести получается из-за наличия в ней карбонатов СаСО3, количество которых определяет степень обжига известняка. Определить расходный коэффициент известняка на 1 т извести указанного состава и степень обжига известняка.
1-4. Рассчитать расход колчедана, содержащего 40 % S на 1 т H2SO4, если потери S и сернистого ангидрида в производстве серной кислоты составляют 3%, а степень абсорбции - 99%.
1-5. Рассчитать зависимость содержания кислорода в газах обжига от концентрации SO2 при воздушном дутье:
а) для обжига колчедана (FeS2);
б) для обжига серы;
в) для обжига сернистого цинка (ZnS)
1-6. Рассчитать расходный коэффициент технического ацетальдегида, содержащего 98% ацетальдегида, для получения 1 тонны уксусной кислоты в процессе его окисления по реакции
CH3CHO + 0,5 O2 CH3COOH,
если выход кислоты по альдегиду составляет 89,3%.
1-7. Рассчитать расходные коэффициенты по сырью в производстве 1 тонны фосфата аммония (NH4)3PO4. Фосфорная кислота имеет концентрацию 58% , а аммиак содержит 2% влаги.
1-8. Рассчитать теоретический и практический коэффициенты 97% изопентана в производстве 1 тонны изопрена. Процесс каталитического дегидрирования изопентана осуществляется по реакциям:
С5Н12 ↔ С5Н10 + Н2
С5Н10 ↔ С5Н10 + Н2
Выход изоамилена составляет 73%, а изопрена - 65% от теоретического
1-9. Рассчитать основные технологические показатели производства малеинового ангидрида воздушным окислением бензола:
- теоретические и фактические расходные коэффициенты;
- выходы продуктов на подаваемый и превращенный бензол;
общую и избирательную конверсии бензола.
Химическая схема процесса.


 СН─СО
СН─СО![]()
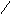 C6Н6
+ 4,5 О2
= O
+ 2Н2О
+ 2СО2
C6Н6
+ 4,5 О2
= O
+ 2Н2О
+ 2СО2
СН─СО
 СН─СО
СН─СО![]() СН─СООН
СН─СООН
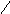 ||
O
+ Н2О
= ||
||
O
+ Н2О
= ||
СН─СО СН─СООН
Материальный баланс производства малеинового ангидрида
|
Приход |
Расход |
||||
|
Компоненты |
Кг/час |
Компоненты |
кг/час |
||
|
1 |
Бензол |
2941,17 |
1 |
Малеиновый ангидрид |
3404,15 |
|
2 |
Воздух в том числе: азот кислород |
31070,88
23831,06 7239,82 |
2 |
Малеиновая кислота |
125,97 |
|
3 |
Бензол |
117,63 |
|||
|
4 |
Вода |
1283,63 |
|||
|
|
|
|
5 |
Выхлопные газы в том числе: азот кислород углекислый газ |
23831,06 2027,12 3185,54 |
|
6 |
Потери ангидрида |
36,95 |
|||
|
Итого |
34012,05 |
Итого |
34012,05 |
||
1-10. Рассчитать расходные коэффициенты по бензолу и пропан-пропиленовой фракции газов крекинга, содержащих 30% об. пропилена и 70% об. пропана для производства фенола. Получение фенола из бензола и пропилена состоит из трех стадий:
C6H6 + СН2=СН-СН3 → С6Н5-СН(СН3)2
С6Н5-СН(СН3)2 + О2 → С6Н5-СН(СН3)2ООН
С6Н5-СН(СН3)2ООН → С6Н5ОН + (СН3)СО
Выход изопропилбензола из бензола составляет 90%, а выход фенола из изопропилбензола – 93%.
Молекулярные массы: бензола – 78, пропилена – 42, фенола – 94.
1-11. Рассчитать расходные коэффициенты в производстве технического карбида кальция СаО + 3С = СаО2 + СО. Технический карбид кальция имеет следующий состав: CaC2 - 78% , CaO – 15%, C – 3 %, прочие примеси – 4%. Известь содержит 96,5% СаО.
Содержание в коксе золы - 4% , летучих – 4%, влаги – 3%.
Молекулярные массы: CaC2 – 64, CаО – 56.
1-12. Рассчитать основные технологические показатели производства бензола методом парофазовой дегидрогенизации циклогексана:
- теоретические и фактические расходные коэффициенты;
- выходы продуктов на подаваемый и превращенный циклогексан;
- общую и избирательную конверсии циклогексана.
Химическая схема процесса.
С6Н12 ↔ С6Н6 + 3Н2
С6Н12 ↔ СН3С5Н9
Материальный баланс производства малеинового ангидрида.
-
Приход
Расход
Реагенты
т/сутки
Продукты
т/сутки
Циклогексан
503,16
Бензол
150
Циклогексан
32,113
Водород
11,538
Метилциклопентан
294,856
Потери
14,653
Итого
503,16
Итого
503,16
1.1. Аккумуляторную кислоту (концентрация 92,5% по Н2SO4) нужно разбавить водой до концентрации 38% H2SO4. Сколько нужно взять воды для получения 180 кг разбавленной кислоты?
1.2. Сколько нужно взять купоросного масла (96% Н2SO4) и серной кислоты с концентрацией 83%, чтобы получить 2800 кг 94%-й H2SO4?
1.3. Сколько нужно взять растворов поваренной соли с концентрацией 310 г/л и 230 г/л, чтобы получить 250 л раствора с концентрацией 280 г/л?
1.4. Азотную кислоту с концентрацией 58% нужно разбавить водой до концентрации 46%. Сколько нужно взять воды, чтобы получить 2 т разбавленной кислоты?
1.5. Влажность 150 кг каменного угля при хранении на складе изменилась: а) с 8,4 до 3,9%; б) с 0,2 до 4%. Как при этом изменилась масса угля?
1.6. Влажность 200 кг серного колчедана при хранении на воздухе изменилась с 3 до 6 мас.%. Как при этом изменилась масса колчедана?
1.7. Влажность 300 кг извести при хранении на воздухе изменилась с 2 до 5 мас.%. Как при этом изменилась масса извести?
1.8. Определить расход бурого угля (70 мас.% С), водяного пара и воздуха для получения 1000 м3 генераторного газа состава (об.%): СО 40, Н2 18, N2 42. Процесс газификации твердого топлива содержит две основные реакции:
С + Н2О = СО + Н2 и 2С + О2 = 2СО.
1.9. Определить расходные коэффициенты в производстве технического карбида кальция, содержащего (мас. %): СаС2 85, СаО 5, С 3, примеси остальное. Известь содержит 96,5% СаО, примеси остальное. Содержание в коксе (мас.%): золы 4, летучих 4, влаги – 3, остальное –углерод. Расчет вести на 1 т продукта. Реакция:
СаО + 3С = СаС2 + СО.
1.10. Рассчитать расходные коэффициенты при производстве 1 т фосфора путём разложения фосфоритного концентрата. Процесс описывается уравнением:
Са3(РО4)2 + 5С + 3SiO2 = 3CaOSiO2 + 2P + 5CO
Содержание Р2О5 в концентрате 25 мас.%, кокс содержит 94,5 мас.% углерода, степень превращения фосфора 0,85.
1.11. Рассчитать необходимый объем 68%-й H2SO4 для разложения 100 г апатитового концентрата, содержащего 39% Р2О5. Плотность H2SO4 (68%) 1,59 г/см3.
2Са5F(PO4)3 + 7H2SO4 = 3Ca(H2PO4)2 + 7CaSO4 + 2HF
1.12.
Рассчитать
состав шихты в производстве глинозёма
из боксита, соды и известняка методом
спекания. Исходный боксит содержит
(мас.%): Al2О3
–
50;
SiO2
–
10; Fe2O3
–
20. Мольное отношение компонентов (модуль)
в спеке: М1
=![]() ;
M2
=
;
M2
=
![]() .
Известняк содержит 90 мас.% СаСО3,
техническая сода – 96 мас.% Na2CО3.
Расчет вести на 1 т боксита.
.
Известняк содержит 90 мас.% СаСО3,
техническая сода – 96 мас.% Na2CО3.
Расчет вести на 1 т боксита.
1.13. Определить расходный коэффициент по техническому карбиду кальция в производстве aцетилена. Содержание СаС2 в техническом продукте 83%, степень превращения СаС2 в производстве равна 0,88.
1.14. Составить материальный баланс процесса газификации 1 т кокса, идущего по реакциям:
C + H2O = CO + H2 – 131 кДж
CO + H2O = CO + H2+ 42 кДж.
Содержание в коксе зольных примесей 3 мас.%, массовое соотношение пар: кокс = 1,5, степень превращения углерода в коксе 0,98, выход оксида углерода 0,90. Найти общее количество подведённого тепла.
1.15. Составить материальный баланс и рассчитать выход SO2 при обжиге 1 т руды, содержащей 22 мас.% серы в виде сульфида цинка (остальное несгораемые примеси), при подаче полуторократного избытке воздуха по отношению к стехиометрии реакции:
2ZnS + 3O2 =2ZnO + 2SO2
Содержание серы в огарке 0,5 мас.%.
1.16. При обжиге известняка образуется твёрдый продукт состава:
СаО СО2 Балласт
Вариант 1 92 2,4 остальное
Вариант 2 94 1,2 остальное
В исходном сырье содержится СаСО3 91 мас.% (вариант 1) и 89 мас.% (вариант 2). Определить расход известняка на 1 т целевого продукта в виде СаО и степень превращения СаСО3.
1.17. Обжиговый газ состава: SO2 8 об.% О2 12 об.%, остальное азот, подвергнут окислению на катализаторе. Степень превращения SO2 88. Рассчитать процентный состав газа после окисления.
1.18. Воздух, подводимый к доменной печи, содержит (об.%): O2 21,1; N2 77,2; водяных паров 1,6. Сколько потребуется добавить к воздуху кислорода, чтобы его концентрация стала равной 25 об.%?
1.19. Газовая смесь содержит в мол.% (мас.%): Н2 27,3 (44,9); О2 49,9 (25,4); СО2 5,3 (21,9); N2 17,5 (7,8). Количество смеси 350 кмоль (2750 кг). Рассчитать конечный состав смеси в мас.% (об.%), если удалено СО2 320 кг (146 м3), О2 2900 м3 (280 м3) и добавлено метана 37 кг (25 кмоль).
1.20. Рассчитать конечный состав газовой смеси, если её исходный состав в мас.% (об.%): СН4 16,5 (20,7); С2Н6 9,7 (22,9); О2 44,9 (18,6); N2 28,9 (37,8). Количество смеси 1000 кг (1000 м3). Каков конечный состав смеси в об.% (мас.%), если удалено: СН4 105 кг (150 м3); О2 300 м3 (150 кг); добавлено водяного пара 200 м3 (100 кг)?
1.21. Определить соотношение между Н2 и N2 в азотоводородной смеси на входе в реактор синтеза аммиака, если в газе на выходе из реактора содержится (об.%): NH3 17, N2 11, Н2 72.
1.22. Определить производительность колонны синтеза аммиака объёмом 4 м3, если объёмная скорость газа составляет 30000 ч1. Равновесная степень превращения реагентов, взятых в стехиометрическом соотношении 0,26, а выход аммиака 0,78.
1.23. В реакторе протекают реакции:
А + 2В = R, R + В = S, А + В = 2Т
Начальные концентрации (кмоль/м3): САо= 2; СВо= 2,3; СRо= СSо= СTо= 0, объемный расход смеси составляет 0,05 м3/с. Концентрации на выходе из реактора (кмоль/м3): СТ= 0,2; СS= 0,4; СА= 1,4. Определить степени превращения вещества В по всем трем реакциям и производительность по продукту R.
1.24. В реакторе протекают реакции:
А + В = R, А + А = S, 2S + В = Т + 2D, R + А = Т
Определить производительность реактора по веществам R и S при следующих условиях: САо=2; СВо=1,7; СRо= СSо= СTо= СDо= 0; СА=0,1; СВ=0,5;
СТ=0,15; СD=0,05 кмоль/м3; объемный расход реакционной смеси 0,01 м3/с.
1.25. В реакторе протекают реакции:
А + 2В = R, R + B = S, 3B = 2T, 2A + B = S + D
Концентрации (кмоль/м3): САо = 1; СRо = СSо = СTо = СDо = 0; СА = 0,44; СR = 0,05; СS = 0,33; СТ = 0,14. Скорость подачи исходных веществ 0,005 м3/ч. Определить производительность по исходному веществу В и по продукту D.
1.26. В реакторе в адиабатических условиях протекают реакции:
А + В = R + D, 2В = Р, 2R = S
Начальные концентрации реагентов (кмоль/м3): САо = 0,1; СВо = 0,3; СRо = СDо = СPо= СSо = 0. Концентрации веществ на выходе из реактора (кмоль/м3): Ср = 0,028; СS = 0,012; СD = 0,034. Тепловые эффекты реакций (Дж/моль): Qр1= 1,1.105; Qр2= 8,8. 104 и Qр3= 4,7.104. Плотность реакционной смеси 860 кг/м3, ее теплоемкость 2,85·103 Дж/(кг·град). Объемный расход смеси 0,026 м3/с. Определить производительность реактора по продукту R и температуру на выходе из реактора, если начальная температура 12оС.
1.27. В реакторе в адиабатических условиях протекают реакции:
2А + В = R, R + 2В = S, 3В = 2Т
Начальные концентрации реагентов (кмоль/м3): СRо = СSо = СТо = 0; САо = 0,1; СВо = 0,2. Выходные концентрации (кмоль/м3): СВ = 0,016; СS = 0,011; СT = 0,03. Тепловые эффекты реакций (кДж/моль): Qр1= 120; Qр2= 68 и Qр3= 47. Плотность реакционной смеси 850 кг/м3; теплоемкость смеси ср = 2,4103 Дж/(кгград), объемный расход Vо = 0,034 м3/с. Найти производительность реактора по продукту R и температуру на выходе из реактора, если Твх = 298 К.
1.28. Взаимодействие ацетилена с формальдегидом дает промежуточный продукт пропаргиловый спирт, а затем бутиндиол-1,4 по схеме:
С2Н2 + СН2О С3Н4О + СН2О С4Н6О2
Степень превращения по ацетилену составляет 0,98. Селективность по пропаргиловому спирту 0,66. Рассчитать необходимое количество аце-тилена и формальдегида для получения 350 кг/ч пропаргилового спирта.
1.29. Для реакции, протекающей в жидкой фазе
А + 2В = 2R,
определить степень превращения xВ и состав реакционной смеси (СА, СВ, СR) при xА = 0,45 и: а) САо = 1, СВо = 2; б) САо = 1, СВо = 1 кмоль/м3.
1.30. Определить состав реакционной смеси в конце процесса для реакции
А+3В = 2R,
протекающей в жидкой фазе, если xА = 0,2; xВ = 0,2; CВо = 5 кмоль/м3.
1.31. В газовой фазе протекает реакция без изменения объема
А = 3R
Определить состав реакционной смеси на выходе из реактора, если CАо = 1 кмоль/м3, xА = 0,5.
1.32. В газовой фазе при постоянном давлении протекает реакция
А + В = 3R
Определить состав реакционной смеси в мольных долях, если NАо = NВо = 1 кмоль, xА = 0,9.
1.33. Дана реакция:
2A + 3B = R
С целью более полного использования вещества А в реактор подается 2 кратный избыток В по сравнению со стехиометрией реакции. Определить xВ, если xА = 0,9.
1.34. Для проведения реакции дегидратации этилового спирта
2С2Н5ОН = (С2Н5)2О + Н2О
взято исходное количество спирта, равное 24 моль, получено 8 моль эфира. Рассчитать состав полученной реакционной смеси, степень превращения реагента и выход продукта.
1.35. Протекают две параллельные реакции:
2А = R и A = 3S
Определить выход продукта R, степень превращения реагента А и селективность, если на выходе из реактора известны количества молей веществ: NA = 2; NR= 3; NS = 3.
1.36. Протекают последовательные реакции:
А = 2R и R = S
Определить степень превращения, выход и селективность по продукту R, если известен конечный состав реакционной смеси (кмоль/м3): СА = 1; СR = 2; СS = 2.
1.37. Протекают две параллельные реакции:
2А = R и А = 3S
Определить выход продукта R, степень превращения реагента А и интегральную селективность, если на выходе из реактора концентрации (кмоль/м3): СА= 2; СR = 3; СS= 3,5.
1.38. Окисление аммиака воздухом до оксида азота как целевого продукта сопровождается протеканием ряда побочных реакций. Общее превращение аммиака можно представить в виде схемы, состоящей из 4 реакций:
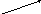 1
NO
1
NO
N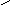

 H3
4 2
H3
4 2
3 N2
Селективность по NO равна 0,92, степень окисления аммиака 0,98. Определить, сколько дополнительно образуется азота, если на процесс поступает аммиачно-воздушная смесь в количестве 1 т при концентрации аммиака 9 об.%.
1.39. Определить степень превращения соды и выход продукта при получении 10 т 40%-го раствора NaОН известковым способом:
Na2CO3 + СаО +Н2О = 2NаОН + СаСО3
2NаНСО3 = Nа2СО3 + СО2 + Н2О,
если для производства взято 5,75 т содового сырья, содержащего 95% Nа2СО3 и 4% NаНСО3.
1.40. Для двух параллельных жидкофазных реакций 1-го порядка
А = R и А = S
определить интегральную селективность и выходы по продуктам R и S, если начальная концентрация реагента А равна 1,42 кмоль/м3, общая степень превращения 0,89, а концентрация продукта R 0,438 кмоль/м3.
1.41. Для двух последовательных реакций А R S определить интегральную селективность по продукту R, выход этого продукта и общую степень превращения реагента А, если после окончания реакции концентрации веществ в смеси составили (кмоль/м3): CА= 0,217; CR= 0,569; CS= 0,241.
1.42. При проведении двух последовательных реакций первого порядка гидратации ацетилена и дегидратации ацетальдегида:
С2Н2 + Н2О СН3СНО
2СН3-СНО СН3-СН=СН-СНО + Н2О
из 1 моль ацетилена и 10 моль водяного пара получено 0,4 моль ацетальдегида и 0,025 моль кротонового альдегида. Рассчитать общую и частные степени превращения (по каждой реакции) ацетилена, состав полученной реакционной смеси, интегральную селективность по ацетальдегиду и выход ацетальдегида.
1.43. При проведении последовательной реакции дегидрирования
С4Н10 С4Н8 С4Н6
частные степени превращения бутана в бутилен и бутадиен составляют соответственно 0,38 и 0,04. Рассчитать состав полученной реакционной смеси, общую степень превращения бутана, интегральную селективность и выход по бутилену, если исходное количество бутана 21 моль.
1.44. Рассчитать расход бензола и пропан-пропиленовой фракции газов крекинга (30 об.% пропилена и 70 об.% пропана) для производства 1 т фенола, если выход изопропилбензола из бензола составляет 90%, фенола из изопропилбензола через стадию окисления изопропилбензола в гидропероксид 93%. Молекулярные массы: бензола 78, пропилена 42, пропана 44, фенола 94. Получение фенола состоит из трех стадий:
С6Н6 + CH2CHCH3 C6H5CH(CH3)2
C6H5C(CH3)2OOH C6H5OH + C(CH3)2O
1.45. Рассчитать расход аммиака и воздуха на 1 т моногидрата HNO3, если степень окисления NH3 в NO равна 0,96, степень абсорбции оксидов азота 0,98. Расход воздуха учитывать только в реакциях окисления NH3 и NO. Брутто-реакция:
NH3 + 2O2 = HNO3 + H2O.
1.46. Рассчитать расход аммиака и воздуха на 1 т 50%-й азотной кислоты при степени окисления аммиака 0,95 и степени абсорбции оксидов азота 0,96. При расчёте расхода воздуха учитывать только стехиометрию реакций:
NH3 NO NO2 HNO3.
1.47. Рассчитать количество и состав газа, получаемого при окислении 900 м3 аммиачно-воздушной смеси, содержащей 6 мас.% аммиака в воздухе. Степень окисления аммиака равна 0,97, выход оксида азота равен 95%. Считать, что аммиак окисляется до оксида азота и до азота.
1.48. Нагрузка на реактор синтеза аммиака составляет 2000 м3/ч азотоводородной смеси стехиометрического состава, находящейся под давлением 2,5 МПа и при температуре 700 К. Содержание аммиака в газе на выходе из реактора составляет 20 об.%, тепловой эффект реакции 112 кДж/моль. Рассчитать состав газовой смеси на выходе из реактора и количество выделенного тепла.
1.49. Определить количество аммиака, требуемое для производства 100 т/год азотной кислоты, и расход воздуха на окисление аммиака, если цех работает 355 дней в году, выход оксида азота 0,97, степень абсорбции оксидов азота 0,92, содержание аммиака в сухой аммиачно-воздушной смеси 9,5 об.%
1.50. Газификация кокса, содержащего (мас.%): С 96,5; H2O 3,5, с водяным паром осуществляется по реакциям:
С + Н2 O = СО + Н2
СО + Н2О = СО2 + Н2
Степень превращения углерода равна 0,93, селективность процесса по СО 0,88. Рассчитать состав полученного газа и составить материальный баланс процесса газификации 1 т кокса указанного состава. Водяной пар поступает в двукратном избытке по отношению к стехиометрии реакции.
1.51. Составить материальный баланс процесса газификации 1 т кокса, идущего по реакциям:
C + H2O = CO + H2 – 131 кДж
CO + H2O = CO2 + H2+ 42 кДж.
Содержание в коксе зольных примесей 4 мас.%, массовое соотношение пар:кокс = 1,8:1, степень превращения углерода в коксе – 0,90, выход оксида углерода – 0,85. Найти общее количество подведённого тепла.
1.52. Конверсия метана водяным паром до оксида углерода и водорода сопровождается поглощением 200 кДж тепла. В реактор поступает реакционная смесь в мольном соотношении «пар:метан», равном 3:1. Определить степени превращения метана и водяного пара, общее количество поглощенного тепла при переработке 10 м3/с исходной смеси, если содержание оксида углерода на выходе из реактора 10 об.%.
1.53. Составить тепловой баланс реактора для получения водорода каталитической конверсией метана по реакции
СH4 + H2O = CO + 3H2 – 206 кДж
Степень превращения метана равна 0,92, объемное отношение СH4:H2O в исходной парогазовой смеси составляет 2,8:1. Температура в зоне реакции 980оС, температура поступающих в реактор реагентов 130оС, потери тепла в окружающую среду составляют 5% от прихода тепла. Расчет вести на 1000 м3 водорода. Теплоемкости газов, кДж/(кмоль. град):
СH4 H2O CO H2
36,8 36,0 30,5 29,5
1.54. Составить материальный баланс процесса паровой конверсии метана
СH4 + H2O = CO + 3H2,
если степень превращения СH4 равна 0,95, мольное отношение H2O:СH4 = 3:1. Расчёт вести на 1000 м3 исходной парогазовой смеси.
1.55. Определить расход воздуха для дожигания 100 м3 отходящих газов состава (об.%):
СО СО2 О2 N2 Коэффициент Степень
избытка воздуха конверсии СО
Вариант 1 5,2 11,3 1,5 ост. 1,2 0,95
Вариант 2 7,2 10,1 1,5 ост. 1,3 0,90
Рассчитать состав газовой смеси после реакции:
2СО + О2 = 2СО2.
1.56. Определить расход сухого воздуха, количество и состав обжигового газа, количество и состав огарка при обжиге 1 т/ч флотационного колчедана, содержащего 38 мас.% серы. В колчедане выгорает 96% серы. Коэффициент избытка воздуха составляет 1,4 по отношению к стехиометрии реакции.
1.57. Рассчитать выход SO2 и определить количество выделенного тепла при обжиге 1000 кг серного колчедана, содержащего 41 мас.% серы при влажности 7,4 мас.%. Содержание серы в огарке 0,5 мас.%. Реакция:
4FeS2 +11O2 =2Fe2O3 +8 SO2+ 3415 кДж
1.58. Рассчитать количество тепла, выделяемое при переработке 1000 м3 сернистого газа состава: 10 об.% SO2 в воздухе и составить материальный баланс реактора окисления SO2 в SO3 Степень превращения SO2 равна 90%. Каким будет при этом состав смеси на выходе из реактора (в об.%). Реакция:
SO2 + О,5О2 = SO3+ 92000 Дж.
