
Лабораторные_работы_ Атомка / BOOKS / Практикум по атомной физике
.pdfМинистерство образования Республики Беларусь
ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ ЯНКИ КУПАЛЫ
С.А. Маскевич, Н.Д. Стрекаль, В.Е. Граков, А.А. Сокольский
Практикум по атомной физике
Учебное пособие для студентов физических и технических специальностей
Â2 частях
×.1. Боровская модель и квантово-механическое описание
строения атома
Гродно 1999
Ó Ä Ê 539.18(076)
ÁÊ Ê 22.383ÿ73
Ï69
Рецензенты: кандидат физико-математических наук, доцент А.Ю.Иванов;
кандидат физико-математических наук, доцент В.А.Картазаев.
Рекомендовано советом физико-технического факультета.
Ì31 Практикум по атомной физике: Учеб. пособие. В 2 ч.
×.1 – Боровская модель и квантово-механическое описание
строения атома: / С.А.Маскевич, Н.Д. Стрекаль, В.Е.Граков, А.А.Сокольский. — Гродно: ГрГУ, 1999. — 114 с.
ISBN 985-417-159-0(1)
ISBN 985-417-160-4
В практикуме приведены важные теоретические сведения и практические указания по выполнению 7 лабораторных работ практикума по атомной физике: по боровской модели атома, волновым свойствам микрочастиц, работы, связанные с компьютерным моделированием сложных физических экспериментов и численными методами решения квантово-механических задач. В приложении рассматриваются экспериментальные системы регистрации оптического излучения, их физическая классификация и описание базовых спектральных приборов, используемых при выполнении лабораторных работ. Пособие предназначено для студентов физических и технических специальностей.
ÓÄÊ 539.18(076) ÁÊÊ 22.383ÿ73
ISBN 985-417-159-0(1)
ISBN 985-417-160-4 © С.А.Маскевич, Н.Д.Стрекаль, В.Е.Граков, А.А. Сокольский, 1999
Â Â Å Ä Å Í È Å
Практикум по атомной физике является составной частью большого физического практикума для специальности «Физика», а также частью практикума по атомной, ядерной физике
èрадиационной безопасности для инженерных специальностей вузов. Целью практикума является самостоятельное выполнение студентами лабораторных работ по наиболее важным и представляющим определенные трудности для понимания разделам курса. Отличительной спецификой лабораторных работ по атомной физике является их субатомный уровень, требующий использования сложного экспериментального оборудования. Более того, наблюдение эффектов и явлений квантового характера не может быть осуществлено в рамках наглядных демонстраций для широкой аудитории. В связи с этим роль практикума по атомной физике возрастает значительно по сравнению с другими, поставленными по классическим разделами общей физики.
Практикум состоит из двух частей. Первая содержит теоретические сведения и описания лабораторных работ по физике атома в рамках боровской и строгой квантово-механической теории, вторая включает теорию и лабораторные работы по физике атомных явлений, а также необходимые справочные материалы.
Пособие состоит из глав, содержащих основные положения теории по наиболее важным разделам и подробное описание лабораторных работ: цель и постановку экспериментальных задач, пути их решения, практические упражнения с заданиями.
Âприложении приводятся физические принципы и классификация экспериментальных систем, используемых при выполнении типовых лабораторных заданий, описаны принципы действия некоторых спектральных приборов. Более подробные инструкции по выполнению лабораторных работ, как правило, предлагаются вниманию студентов непосредственно на рабочем месте в лаборатории.
При подготовке к лабораторным занятиям целесообразно помимо описания лабораторной работы изучить вопросы, входящие в соответствующую главу пособия, а также устройство
èпринцип действия предлагаемых приборов по приложению.
3
Глава 1
КОРПУСКУЛŸРНО-ВОЛНОВОЙ ДУАЛИЗМ. ПОСТУЛАТЫ БОРА. ОСНОВНЫЕ ПОЛОЖЕНИŸ КВАНТОВОЙ ТЕОРИИ АТОМА
1.1. Корпускулярно-волновой дуализм свойств материи
Проанализировав экспериментальные данные по фотоэлектрическому и фотохимическому действию света на вещество, А.Эйнштейн предложил фотонную теорию света, расширяющую и углубляющую квантовую гипотезу М.Планка. В соответствии с фотонной теорией электромагнитное поле (свет) представляет собой поток фотонов, во многом похожих на частицы. Они взаимодействуют с веществом как целое, обладают определенной энергией Еô = hv и импульсом рô = hv/c = h/l, где h — постоянная Планка; с — скорость света; v — частота; l — длина волны. В то же время для объяснения интерференционных и дифракционных явлений необходимо сохранить представление о волновой природе света. Так в физике возникла проблема кор- пускулярно-волнового дуализма.
В 1923 г. французский физик Луи де Бройль пришел к выводу, что корпускулярно-волновой дуализм присущ не только излучению, но и всем без исключения материальным частицам — электронам, протонам, атомам и т.д., причем количе- ственные соотношения между волновыми и корпускулярными свойствами частиц те же, что для фотонов: если частица имеет энергию Е и импульс р, то с ней связана волна, частота которой v = E/h, и длина волны
l = h/p. |
(1.1) |
1.2.Основные закономерности
âспектрах испускания и поглощения атомов
Êконцу прошлого века был накоплен обширный экспериментальный материал по спектрам испускания и поглощения атомных паров и газов, представляющих собой ансамбли слабо взаимодействующих атомов. Наиболее существенным в имеющихся экспериментальных данных было следующее.
1. Атомные спектры являются линейчатыми, т.е. состоят из узких, изолированных одна от другой линий.
4
2.Спектры разных элементов различны и строго индивидуализированы. По виду спектра можно однозначно определять элемент и производить элементный анализ сложных веществ.
3.Обычно в спектре испускания содержится больше линий, чем в спектре поглощения того же элемента. Все линии спектра поглощения совпадают по длинам волн с частью линий спектра испускания.
4.Частоты спектральных линий удовлетворяют комбина-
ционному принципу (В.Ритц, 1908 г.), который обычно форму-
лируется применительно к волновым числам. (Волновым чис-
~
ëîì í в спектроскопии называют величину, обратную длине
волны |
~ |
= 1/ ë |
и связанную с частотой v соотношением í = |
~ |
í |
cí , |
где с — скорость света.) В соответствии с комбинационным принципом Ритца для каждого атома можно найти дискретную последовательность положительных чисел T1, T2, T3, ..., называемых спектральными термами этого атома, таких, что волновые числа всех спектральных линий данного атома будут выражаться в виде разности каких-либо двух спектральных термов:
~ |
– Tn. |
|
í = Tm |
(1.2) |
5. Наиболее простую структуру имеет спектр атома водорода, длины волн в котором удовлетворяют обобщенной формуле Бальмера:
~ |
= RH |
2 |
2 |
(1.3) |
í º 1/lmn |
(1/m |
– 1/n ), |
m = 1,2,3,…; n = m+1, m+2, m+3, ….
В формуле Бальмера RH — некоторый коэффициент, который носит название постоянной Ридберга. Очевидно, формула Бальмера является частным случаем комбинационного принципа, причем водородные термы имеют вид
T |
= R / n2. |
(1.4) |
n |
H |
|
Удивительным представлялось отсутствие в спектре данного атома линий с кратными частотами, что явно противоречило основным положениям классической электронной теории. Решение проблемы было найдено Н.Бором, который предположил, что спектральные термы обусловлены существованием дискретных уровней энергии атома. Данное предположение хорошо сочеталось с квантовой теорией света, предложенной в 1905 г.
5
А.Эйнштейном. Действительно, если умножить уравнение (1.2)
на скорость света и постоянную Планка, то слева получится энер-
~
гия фотона hcí mn = hvmn, а справа вместо разности спектральных термов — разность соответствующих им значений энергии
Em = – hc Tm; En = – hc Tn. |
(1.5) |
Уравнение (1.2) принимает вид |
|
hvmn = En – Em, |
(1.6) |
откуда связь между термами Т1, Ò2, T3, ... и уровнями энергии E1, E2, E3, … очевидна.
1.3.Постулаты Бора
Â1913 г. Н.Бор сформулировал два постулата атомной физики.
1. Атомная система устойчива только для определенной совокупности состояния — «стационарных состояний», — которая в общем случае соответствует дискретной последовательно-
сти значений энергии атома E1, E2, E3,… Каждое изменение этой энергии связано с полным «переходом» атома из одного стационарного состояния в другое.
2. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с пере-
ходом, должно быть монохроматическим и иметь частоту vmn, определяемую соотношением (1.6).
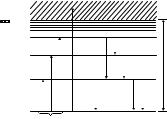
Исходя из постулатов Бора, можно построить диаграмму уровней энергии атома (рис. 1.1), которая придает наглядность комбинационному принципу. Обычно уровни энергии откладывают в линейном масштабе.
E
E =0 |
|
|
E |
|
|
E5 |
|
|
4 |
ν 43 |
|
E3 |
E |
|
|
|
W |
E2 |
ν 42ν |
|
|
32 |
|
E1 |
Èîíè- ν41 |
ν21ν 31 |
Возбуж- |
||
дение |
зация |
|
|
|
Ðèñ. 1.1
ν = |
1 |
(E -E ) |
||
h |
||||
31 |
3 |
1 |
||
ν 41= |
1 |
(E4 -E1) |
||
h |
||||
|
|
|
||
ν 32= |
1 |
(E3-E2) |
||
h |
||||
|
|
|
||
ν 42= |
1 |
(E4-E2) |
||
h |
||||
|
|
|
||
ν 43= |
1 |
(E4 -E3) |
||
h |
||||
|
|
|
||
6
1.4.Основные положения квантовой теории атома
Âосновном состоянии, которому отвечает минимальная
энергия Е1, атом находится сколь угодно долго. Все остальные состояния являются возбужденными. Процесс перевода атома
âтакое состояние называется возбуждением. В возбужденном состоянии атом обычно задерживается на сравнительно короткое время — порядка 10–8 с. Однако по атомным масштабам это время чрезвычайно велико. Оптическим фотонам отвечает частота около 1014 ñ–1, что соответствует 106 колебаниям для типичного случая ô = 10–8 ñ.
Из возбужденного атом переходит в основное состояние либо непосредственно, либо поэтапно через промежуточные возбужденные состояния. Каждой наблюдаемой спектральной линии соответствует переход между двумя уровнями энергии. На диаграмме (см. рис. 1.1) возможные переходы отмечены вертикальными стрелками, направления которых для случаев поглощения и испускания света противоположны. Частоты фотонов, соответствующих нескольким переходам, приведены на рисунке.
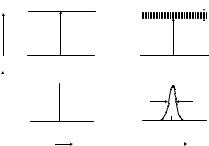
Если энергии двух энергетических уровней, между которыми происходит переход, известны точно, то и разность этих энергий также должна быть точно определяемой величиной. В этом случае наблюдалась бы линия, не имеющая ширины, характеризуемая точным значением частоты v и, следовательно, положением в спектре (рис. 1.2).
|
Энергия |
Интенсивность |
перехода |
Å2 |
Å2 |
∆ E |
Å1 |
Å1 |
|
|
|
∆ E |
Å2 -Å1 |
|
Å2 -Å1 |
Å |
|
Å |
a |
|
á |
|
Ðèñ. 1.2. |
|
Время жизни атома в возбужденном состоянии Dt связано c неопределенностью энергии этого состояния DЕ квантовомеханическим соотношением неопределенности Гейзенберга
7

|
∆ E∆ t = D / 2, |
(1.7) |
|||
èëè |
∆ E = |
D |
|
, |
|
2∆ |
|
|
|||
|
|
t |
|
||
ãäå DÅ è Dt — неопределенности энергии и времени жизни системы, D = h/2p. Если время жизни мало, то величина DЕ будет большой. Время жизни основного состояния обычно бесконеч- но велико, и его уровень определен точно. Ширина линии определяется величиной DЕ и на практике измеряется как ширина на половине высоты. На рис. 1.2 в соответствии с изложенным представлена некоторая гипотетическая линия поглощения, не имеющая ширины (рис. 1.2а), и реальная линия поглощения, имеющая ширину DЕ на половине высоты (рис. 1.2б).
Кроме естественного уширения за счет конечного времени жизни возбужденного состояния, спектральные линии могут уширяться и по другим причинам, например, в результате соударений, обменных химических реакций и т.д.
Начало отсчета энергии атома обычно выбирается таким образом, чтобы все ее дискретные значения: E1, E2, E3, …, отве- чающие связанным состояниям, были отрицательными. При положительных значениях энергии (Е > 0) атом распадается на положительный ион и электрон. Процесс удаления электрона из атома называется ионизацией. Поскольку в состояниях ионизации движения иона и электрона являются независимыми, их суммарная энергия E может принимать любые значения, т.е. не квантуется. Энергией ионизации Wi называется минимальная энергия, которую нужно сообщить атому, находящемуся в основном состоянии, для его ионизации. Из диаграммы (см. рис. 1.1) видно, что энергия ионизации равна по абсолютной величине энергии основного состояния атома:
Wi = 0 − E1 = E1.
Энергию ионизации обычно выражают в электронвольтах. В этом случае для нее часто употребляется термин потенциал ионизации.
В различных стационарных состояниях атом имеет и разную структуру (геометрическую конфигурацию). Таким образом, его переход из одного стационарного состояния в другое сопровождается изменением структуры. Наиболее существенные изменения происходят при ионизации, когда атом вообще лишается электрона.
8
Атом может быть ионизован в результате поглощения фотона с энергией hv, превышающей энергию ионизации Wi, ò.å. hv > Wi. Этот процесс носит название фотоионизации. Вырванный из атома электрон будет иметь кинетическую энергию hv – Wi. Процессом, обратным фотоионизации, является радиационная рекомбинация. В результате ее ион и электрон образуют атом в одном из связанных стационарных состояний, а освободившаяся энергия передается одному или нескольким фотонам.
Энергия, необходимая для возбуждения или ионизации атомов, может быть сообщена им не только при облучении светом определенной частоты, но и при неупругих столкновениях с другими частицами, когда кинетическая энергия последних превышает некоторую пороговую величину.
В частности, нагревание газа всегда сопровождается возбуждением (ионизацией) атомов при неупругих столкновениях с другими достаточно быстрыми атомами (а также с электронами, которые появляются в газе в результате ионизации). В этом случае говорят о термическом возбуждении (ионизации). По мере увеличения температуры Т быстро возрастает число атомов в каждом из возбужденных состояний. Населенность данного возбужденного состояния с энергией Еn определяется распределением Больцмана:
Nn/N1 ~ exp [–(En – E1)/kT], |
(1.8) |
ãäå Nn — число атомов в возбужденном состоянии; N1 — число атомов в основном состоянии; k - постоянная Больцмана. При комнатной температуре, для которой kT » 1/40 эВ, отношение Nn/N1 пренебрежимо мало. Поэтому холодный газ не испускает видимого света, если его атомы не возбуждены каким-либо способом. Малостью отношения Nn/N1 объясняется также и то, что в спектре поглощения холодного газа присутствуют только линии с частотами v21, v31, v41 и т.д., соответствующие переходам из основного состояния.
Объяснение устойчивости стационарных боровских орбит было дано вскоре после формулировки в 1923 г. французским физиком Луи де Бройлем гипотезы о волновых свойствах материи.
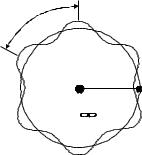
Следуя представлениям о волновом характере движения связанного с ядром электрона, М.Борн объяснил отсутствие излучения следующим образом. В результате орбитального движения электрона образуется стоячая волна де Бройля, вероятностное электронное облако разделяется на две равные части, колеблющиеся точно в противофазе. Электромагнитные волны,
9
создаваемые колебаниями двух частей электронного облака, также оказываются в противофазе и при интерференции взаимно гасятся.
Условие образования стоячей волны де Бройля на круговой орбите длиной 2pr имеет вид (см. рис. 1.3)
2pr=nlÁð, n=1,2,3,... (1.9)
λ ð Á
+ZA -e
MmA
Ðèñ. 1.3
Длина волны де Бройля lÁð определяется соотношением (1.1). С учетом (1.1) можно показать, что условие (1.9) аналогично условию квантования момента импульса орбитального электрона
meun rn = nD . |
(1.10) |
Квантовое условие (1.10), налагаемое на электрон в атоме, имеет простой смысл: разрешены лишь такие его движения, при которых момент импульса ln = meun rn составляет величину, кратную постоянной Планка D .
10
