
Расчёт конверсии метана / Расчет конверсии метана
.doc
5.2 Энтальпийный баланс ГТ
ii= jj
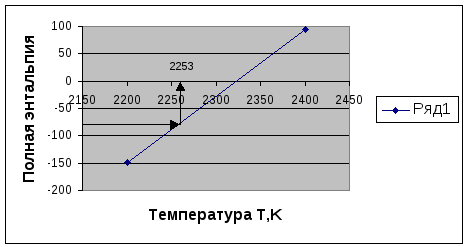
Мы получаем Т при которой выполняет баланс энергии
по методу графика
Т=2253=Тадиабат
5.3 Эксергетический анализ процесса горения
 адиабат
х
= j
хj
P2=P1=Po=1atp
адиабат
х
= j
хj
P2=P1=Po=1atp
iхi T1=298,16 T2=2305
При Т=2253 Кр1=1116,5 Kp2=1487,3
Константы равновесия получаются из справочника или исползяй форму
dlnKp= H (Применяем что Н(Т))

 dT
RT2
dT
RT2
X=0,029 Y=0,024
j хj (T=T2=2253o)
-
х= х +Cph(T2-To) -Toc .Cpsln(T2/To) + Toc.Rln(Pj/Po)
|
Вещества |
a |
b |
Cph |
Cps |
Мол |
P |
х МДЖ/КМоль |
х МДЖ/КМоль |
|
CO2 |
32,20 |
0,022 |
60,26 |
53,47 |
1,55 |
0,10 |
20,10 |
100,11 |
|
O2 |
31,50 |
0,003 |
35,33 |
34,40 |
0,081 |
0,0053 |
3,95 |
39,37 |
|
N2 |
27,90 |
0,004 |
33,00 |
31,77 |
11,12 |
0,720 |
0,70 |
45,35 |
|
OH |
29,00 |
0,06 |
105,53 |
87,00 |
0,062 |
0,004 |
42,20 |
182,61 |
|
H2 |
28,80 |
0,000 |
31,57 |
30,54 |
0,031 |
0,002 |
235,00 |
262,99 |
|
CO |
28,40 |
0,004 |
33,50 |
32,27 |
0,046 |
0,003 |
275,40 |
307,12 |
|
H2O |
34,30 |
0,002 |
34,85 |
34,23 |
2,54 |
0,17 |
8,60 |
51,80 |
j хj =837,8 МДЖ/ КМоль
-
iхi :
|
|
|
T=298.16 |
To=298.16 |
|
|
|
|
|
|
Вещества |
a |
b |
Cph |
Cps |
P |
Moль |
х МДЖ/КМоль |
х МДЖ/КМоль |
|
C3H8 |
1,72 |
0,271 |
82,52 |
-103,30 |
0,020 |
0,30 |
2149,00 |
2139,30 |
|
CH4 |
14,32 |
0,075 |
36,68 |
-74,80 |
0,046 |
0,70 |
830,00 |
822,40 |
|
O2 |
31,50 |
0,003 |
32,39 |
0,00 |
0,196 |
2,96 |
3,95 |
-0,088 |
|
N2 |
27,90 |
0,004 |
29,09 |
0,00 |
11,12 |
11,12 |
29,09 |
-0,056 |
iхi = 1216,6 МДЖ/КМоль
 адиабат
х
= j
хj
= 837,8/1216,6= 0,69
адиабат
х
= j
хj
= 837,8/1216,6= 0,69
iхi
6.Эксегетический анализ процесс теплообмена
х об/мен = хQ89 где
 хQ12
хQ12
хQ89=Qe89(1-Toc/T89)
хQ12= Qe12(1-Toc/T12)
T89=(T9-T8)/ln(T9/T8)=(1123-573)/ln(1123/573)=817,4оК
T12=(T2-T1)/ln(T2/T1)=(2253-1835)/ln(2253/1835)=2036,87 оК
 об/менх=
T12(1-Toc/T89)
=
0,74
об/менх=
T12(1-Toc/T89)
=
0,74
T89(1-Toc/T12)
7.Процесс течения на примере стуйного компрессора
Струйный компрессор – это техническое устроитство обеспечиваюшее повышение давления эктертируемого компонента
за счёт кинетической энергии эктертирющего агента
1
Пар Н2О






 2
5
2
5









 5
5
1



 2 4
2 4

 3 3
3 3
СН4
Р1=66 бар Т1=451оС=724оК eS=0,9 mоn=25,92 Kг/Кмоль
Р3=8 бар Т3=25оС=298оК mоCH4=5,76 Kг/Кмоль
W1=W3=W50 дS=0,82
Р2=Р3=Р4=8 бар
f2=f4

 Cрh=Cрs=37,7КДж/Кмоль.К
Cрh=Cрs=37,7КДж/Кмоль.К
К=1,3
 h=Cр.Т
M=17,6Kг/Кмоль
h=Cр.Т
M=17,6Kг/Кмоль
*Рассматрим часть 1-2s
ds=0; qe=0;d=0

 Tds=dh-vdp
h1-h2s=
k.RT1
1-(P2/P1)
(k-1)/k
где
R=R/18
Tds=dh-vdp
h1-h2s=
k.RT1
1-(P2/P1)
(k-1)/k
где
R=R/18
k-1
h1-h2s= 558,65 КДЖ/Кг
W2s=(2(h1-h2s))0,5=33,43 (M/C)
=w2д/w2s=(eS)0,5 w2д=31,71(M/C)
Баланс энергии
mоn(h1+w12/2) + mоCH4(h2+w32/2) = (mоn + mоCH4)(h5 + w52/2)
mоn.Cp.T1 + mоCH4.Cp.T3 = (mоn + mоCH4)Cp.T5
T5=638,80K
*Часть 2-4
Баланс сохранения импульса
mоn. w2д +P2.f2 = (mоn + mоCH4)w4 +P4.f4
Получаем w4= mоn* w2д/(mоn + mоCH4)=25,95(M/C)
Энергетический баланс
(mоn + mоCH4)(h4 +w42/2) = (mоn + mоCH4)(h5 +w52/2)
Cp.T4 + w42/2 =Cp.T5
Получаем T4=481,70K
*Часть 4-5s:
ds=0; qe=0;d=0
 h4-h5s=
k
RT4[1-(P5/P4)(k-1)/k]
h4-h5s=
k
RT4[1-(P5/P4)(k-1)/k]
k-1
дS=45s/e45=(h4-h5s)/(h4-h5)
h4-h5s=0,82.(h4-h5)= -276,1 КДЖ/Кг
 h4-h5s=
k
RT4[1-(P5/P4)(k-1)/k]
h4-h5s=
k
RT4[1-(P5/P4)(k-1)/k]
k-1
Получаем P5=23,4 бар
*ckх:
х см(P5,T5)=12,1 MДЖ/Кг
х H2O(P1,T1)= 16,5 MДЖ/Кг
х CH4(P3,T3)= 5,16 MДЖ/Кг
 ckх=
mосм.
х
см(P5,T5)
ckх=
mосм.
х
см(P5,T5)
mоH2O. х H2O(P1,T1) + mоCH4. х CH4(P3,T3)
ckх=0,84
8.Мноступенчатая компрессорная установка
Процесс повышения давления метана до давления Р8 осуществляется с помощью многоступенчатой компрессорной установки.
В холодильнике , охлаждающая вода берется из водооборотного цикла.
TS=0,8 Mex=0,95 Пер=1 n25o=h”-h’=2500 KДж /Кг
Т=11,5оК
8.1 Определение механической мощности
*Масса метана: m6=V6.MCH4/22,4=8.103.16/22,4=5,714[kг/c]
к= TS*Mex*Пер=0,76
e67=67s/к (1)
*Степень повышение давления:
3==(Pk/Pн)1/z=(P8/8 бар) P8=3,2Мпа
z 2
*Обший случай работа
 12s=z
k
RT1[1-(P2/P1)(k-1)/
zk]
12s=z
k
RT1[1-(P2/P1)(k-1)/
zk]
k-1
В этом случай
 67=
z
k RT6[1-(Pk/Pн)(k-1)/k]
=
2 *1,3*8314*300[1-(32/8)0,3/(2*1,3)]
67=
z
k RT6[1-(Pk/Pн)(k-1)/k]
=
2 *1,3*8314*300[1-(32/8)0,3/(2*1,3)]
 k-1
0,3*16
k-1
0,3*16
67= -2,34.105 ДЖ
e67 =67s/к = -3,1.105 ДЖ
Z= moCH4. e67= -1,77MBT
8.2.Определение массы воды при охлаждении
Qe12=mo(h2-h1) + Ze12
но mo(h2-h1)>> Ze12
Qe12=mo(h2-h1)=moCH4(hb-ha)
Qecd=moH2O(hd-hc)
Qeab= -Qecd
moCH4(hb-ha)= -moH2O(hd-hc)
moCH4(ha-hb)= moH2O(hd- hc)
m oH2O=
moCH4(ha-hb)
oH2O=
moCH4(ha-hb)
hd- hc
ТК moH2O мало зависит от Т
 moH2O=
moCH4(ha-hb) Td-Tc=11,5O
moH2O=
moCH4(ha-hb) Td-Tc=11,5O
СpH2O(Td-Tc)
moH2O= 296,96 кг/c
8.3.Определение Та
Определим температуру после охлаждения
TS=67s/e67=(h6-h7s)/(h6-h7)=(T6-T7s)/(T6-T7)
Где T7s=T6(Pk/Pн)(K-1)/ZK=352,0oK
TS=0,8=(300-352,0)/(300-Ta)
Ta=365,1oK
9.Паросиловой цикл Рекина
1835oK
480oK






BK
ПК
ПП







Р1=81 бар t1=472оС
из диаграма h1=3330KДж/Kг,s1=6,74KДж/Kг.K
P2=0,072 бар t2=40 оС
из диаграма h2=2570KДж/Kг,s1=6,14KДж/Kг.K
’S=0,95 нас=0,5
*Часть 1-2s
а)Обратимый процесс
ds=0; qe=0;d=0
q12s= h2s-h1 + 12s
12s=h1-h2s=760 KДж/Kг
б)Необратимый процесс
’S= (h1-h2)/( h1-h2s)=0,95
e12=0,95.760=722 KДж/Kг
h2=h1-0,95(h1-h2s)=2608 KДж/Kг
*Часть 2s-2’:
а) Обратимый процесс
dp=0 q2s2’=h2’-h2s+2s2' h2’=Cp.Tкин=4,187.40=167,48 KДж/Kг
б) Необратимый процесс
dp=0 q22’=h2’-h2+e22'
q22’ = - 2440,52 KДж/Kг
*Часть 2’- 4
а) Обратимый процесс
ds=0; qe=0;d=0
q2’4s= h4s-h2’ + 2'4s

 h4s=
h2’
+v(P1-P2).102=175,57
KДж/Kг
тк
v=0,001
h4s=
h2’
+v(P1-P2).102=175,57
KДж/Kг
тк
v=0,001
б) Необратимый процесс
нас=0,5=2'4s/e2'4=(h2’-h4s)/(h2’-h4)
e2'4=-16,18 KДж/Kг
h4=h2’- e2'4=183,66 KДж/Kг
*Часть 4-1
а) Обратимый процесс
dp=0 q4s1=h1-h4s+4s1= h1-h4s=3154,43 KДж/Kг
б) Необратимый процесс
dp=0 q e41=h1-h4+e41= h1-h4= 3146,3 KДж/Kг
Получаем таблицы
*Для обратимых процессов
|
|
Обратимый процесс |
|
|
Наим процесс |
q KДж/Kг |
,KДж/Kг |
|
1-2s |
0 |
760 |
|
2s-2' |
-2402,5 |
0 |
|
2'-4s |
0 |
-8,1 |
|
4s-1 |
3154,4 |
0 |
q= =751,9 KДж/Kмоль обрth= ц/q4s1=0,238
*Для необратимых процессов
|
|
Необратимый процесс |
|
|
Наим процесс |
q KДж/Kг |
,KДж/Kг |
|
1-2 |
0 |
722 |
|
2-2' |
-2440,52 |
0 |
|
2'-4 |
0 |
-16,2 |
|
4-1 |
3146,3 |
0 |
q=705,82 KДж/Kг=
необрth= ц/q e41=0,225
обрth > необрth
 хq4s1=
q4s1(1-Toc/T4s1)
хq4s1=
q4s1(1-Toc/T4s1)
T 4s1=
q4s1/(S1-S2’)
4s1=
q4s1/(S1-S2’)
Где S2’ =S’TT +TTT TKCpdT/T S2’=Cpln(TK/TTT)=0,572 KДж/Kг.K
 T4s1=518,90K
T4s1=518,90K

 хq4s1=1343,18
KДж/Kг
хq4s1=1343,18
KДж/Kг
QУТИЛ=Qe41=moТГ(h1835-h480)
m oТГ=noТГ.МТГ где
МТГ=М=27,98КГ/Кмоль
oТГ=noТГ.МТГ где
МТГ=М=27,98КГ/Кмоль
noТГ= ТГ.nB=4,61 Кмоль/c
moТГ=129,1КГ/c
h
 =Cp(T-To)
h=h.
=Cp(T-To)
h=h.
*При Т=1835о
|
Вещество |
СО2 |
Н2О |
N2 |
O2 |
|
Cp, KДж/Kмоль |
55,66 |
34,43 |
32,17 |
34,7 |
|
h, MДж/Kмоль |
85,55 |
52,92 |
49,45 |
53,33 |
h=53,8 MДж/Kмоль
*При Т=4800
|
Вещество |
СО2 |
Н2О |
N2 |
O2 |
|
Cp, KДж/Kмоль |
40,76 |
33,1 |
29,5 |
32,7 |
|
h, MДж/Kмоль |
7,42 |
6,02 |
5,37 |
5,95 |
h=5,69 MДж/Kмоль
Qe41=6209,2 MBT
Кроме этого Qe41= moH2O. q e41
moH2O=1,97.103КГ/c
9.1 Расчет механической мощности
Механическая мощность
Zц= moH2O. ц =1392,9 MBT
9.2 Термический К.П.Д
th= ц/q e41=0,225
9.3 Эксергетический К.П.Д
x= ц/хq4s1 =751,91/1343,18=0,56
10.Выводы
а)Расход топлива в топке трубчатой печи
VC3H8=0,3*0,3*22,4 =2,02 (M3/c)
VCH4 =0,7*0,3*22,4 =4,70 (M3/c)
VO2=2,958*0,3*22,4=19,88(M3/c)
VN2=11,12*0,3*22,4=74,72(M3/c)
V=101,31(M3/c)
б) Термический К.П.Д паросиловой установки
th=0,37
в) Эксергетический К.П.Д паросиловой установки
x= 10,6
В данной работе мы:
1) Рассмотрели полную схему получения технологического газа .
2)Выбрали оптимальные составляющие системы
3)Учли все технологические особенности данного процесса
4)Нашли КПД характеризующие процессы протекающие в данной системе.
5)Получили результаты вычислений, которые удовлетворяют физическим представлениям.
6)
Литература
1.Термодинамические расчеты основных процессов в энерго- химико-технологических системах
В.А.СМИРНОВ, Л.Ф. ШИБАЕВА, С.В.МИНОСЬЯНЦ Москва 1988
