
2 семестр / Экзамен - Вопросы - 2007 / PCHEXAM2_2007
.DOC
Кинетика одностадийных необратимых реакций нулевого, первого, второго и третьего порядков
Вопросы
-
Дайте определение скорости гомогенной реакции, протекающей при постоянном объеме. Зависит ли скорость реакции от выбора реагента, аналитически определяемого в системе? Напишите соответствующее выражение.
-
Дайте определение понятия «инвариантная скорость гомогенной реакции». Напишите выражения, связывающие инвариантную скорость реакции 2NO2Cl = 2NO2 + Cl2 со скоростями превращения или образования каждого из веществ, участвующих в реакции. Реакция протекает при постоянном объёме.
-
Дайте определение термина «молекулярность химической реакции», укажите группу реакций, для которой он имеет смысл. Какие значения может принимать молекулярность реакции и почему? Как связаны молекулярность и кинетическое уравнение реакции в дифференциальной форме?
-
Дайте определение терминов «частный порядок» и «полный порядок» химической реакции. Связаны ли молекулярность и порядок реакции, если да, то как и в каком случае?
-
Что такое константа скорости гомогенной реакции? Имеет ли размерность эта величина? От каких факторов зависит ее значение? Запишите дифференциальную и интегральную формы кинетического уравнения для односторонней гомогенной реакции первого порядка, назовите входящие в них величины.
-
Дайте определение термина «период полупревращения». Выведите формулу для расчета периода полупревращения исходного вещества в односторонней гомогенной реакции первого порядка, назовите все используемые величины.
-
Зависит ли период полупревращения в реакции второго порядка вида «A + B продукты» от исходных концентраций реагирующих веществ A и В при условии, что исходные концентрации одинаковы? Приведите обоснованный ответ.
-
Зависит ли период полупревращения в односторонней реакции первого порядка от исходной концентрации реагирующего вещества? Приведите обоснованный ответ.
-
Зависит ли период полупревращения в односторонней реакции третьего порядка вида «A + B + С продукты» от исходных концентраций реагирующих веществ A, B, C при условии, что исходные концентрации одинаковы? Приведите обоснованный ответ.
-
Для некоторой реакции второго порядка период полупревращения равен 10 минутам при начальной концентрации каждого из исходных веществ 0,1 моль/л. Изменится ли период полупревращения (и если да, то как?), если концентрация исходных веществ станет равной 0,2 моль/л? Приведите обоснование ответа.
-
В каком количественном соотношении находятся константы скорости двух реакций первого порядка, если известно, что период полупревращения первой реакции в пять раз больше, чем второй?
-
Приведите дифференциальную и интегральную формы кинетического уравнения односторонней гомогенной реакции первого порядка, протекающей при постоянных температуре и объеме. Назовите величины, входящие в эти уравнения. Выведите выражение для времени полупревращения исходного вещества в данной реакции.
-
Изобразите схематически кинетическую кривую исходного вещества для случая односторонней гомогенной реакции первого порядка, протекающей при постоянных температуре и объеме. Запишите математическое выражение, обосновывающее вид этой кривой. Чему равен тангенс угла наклона касательной к кривой по отношению к оси абсцисс? Укажите координаты, в которых зависимость, соответствующая кинетической кривой, линеаризуется.
-
Приведите дифференциальную и интегральную формы кинетического уравнения односторонней гомогенной реакции второго порядка «A + B продукты», протекающей при постоянных температуре и объеме. Концентрации реагирующих веществ A и B в момент начала реакции одинаковы. Назовите величины, входящие в эти уравнения. Выведите выражение для времени полупревращения исходного вещества в этой реакции.
-
Изобразите схематически кинетическую кривую исходных веществ для случая односторонней гомогенной реакции второго порядка вида «A + B продукты», протекающей при постоянных температуре и объеме (концентрации A и B в момент начала реакции одинаковы). Запишите математическое выражение, обосновывающее вид этой кривой. Чему равен тангенс угла наклона касательной к кривой по отношению к оси абсцисс? Укажите координаты, в которых зависимость, соответствующая кинетической кривой, линеаризуется.
-
Какие односторонние гомогенные реакции и при каких условиях могут проявлять нулевой порядок? От каких факторов зависит скорость этих реакций? Приведите кинетические уравнения в дифференциальной и интегральной формах для реакций нулевого порядка, назовите входящие в них величины. Изобразите схематически график зависимости концентрации исходного вещества и продукта от времени для случая реакции нулевого порядка. Выведите формулу для времени полупревращения исходного вещества.
-
Изменяется ли концентрация продукта реакции с течением времени, если реакция имеет нулевой порядок? Приведите обоснованный ответ. Какие односторонние гомогенные реакции и при каких условиях могут проявлять нулевой порядок?
-
Приведите пример односторонней гомогенной реакции третьего порядка. Запишите соответствующие кинетические уравнения в дифференциальной и интегральной формах для частного случая стехиометрического соотношения концентраций исходных веществ в момент начала реакции. Назовите величины, входящие в эти уравнения. Выведите формулу для времени полупревращения.
-
Сравните на одном графике кинетические кривые исходных веществ для односторонних гомогенных реакций нулевого, первого и второго порядков при численно совпадающих константах скорости и одинаковых начальных концентрациях реагентов. Запишите соответствующие кинетические уравнения в интегральной форме и назовите входящие в них величины. Какая из этих реакций закончится быстрее при прочих равных условиях?
-
Перечислите известные вам интегральные методы определения порядка реакции. Для одного из методов назовите исходные данные и основные этапы процедуры расчета. Какой порядок определяется этим методом – «концентрационный» или «временной»?
-
Что такое "концентрационный порядок" гомогенной реакции и в чём его отличие от "временного порядка"? На что указывает различие этих величин, найденных в независимых повторных опытах для одной и той же реакции?
-
Запишите уравнение, используемое при аналитическом определении порядка реакции методом Оствальда-Нойеса и назовите входящие в него величины. Какой порядок реакции может быть определен данным методом – «концентрационный» или «временной»? Приведите обоснованный ответ.
-
Запишите основное уравнение дифференциального метода Вант-Гоффа для определения порядка гомогенной реакции. Назовите величины, входящие в это уравнение. Приведите графики, используемые при определении порядка реакции данным методом.
-
Для определения порядка реакции ее кинетическое уравнение должно быть предварительно формально приведено к виду
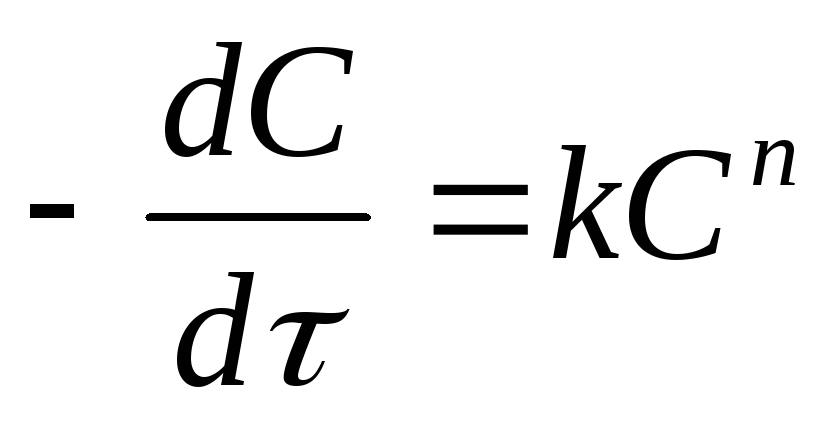 .
Какие практические приемы (условия
проведения опытов) позволяют сделать
это применительно к односторонней
гомогенной реакции? Какой порядок при
этом будет получен – частный или полный?
.
Какие практические приемы (условия
проведения опытов) позволяют сделать
это применительно к односторонней
гомогенной реакции? Какой порядок при
этом будет получен – частный или полный?
Типы задач
-
Расчет концентрации реагента или продукта односторонней реакции порядка 0, 1, 2, 3 в заданный момент времени с использованием интегральной формы кинетического уравнения (для порядков 2, 3 – частный случай стехиометрического соотношения исходных концентраций реагентов).
-
Расчет времени достижения заданной концентрации реагента или продукта односторонней реакции порядка 0, 1, 2, 3 с использованием интегральной формы кинетического уравнения (для порядков 2, 3 – частный случай стехиометрического соотношения исходных концентраций реагентов).
-
Расчет времени достижения заданной степени превращения реагента (в том числе времени полупревращения) в односторонней реакции порядка 0, 1, 2, 3 с использованием интегральной формы кинетического уравнения (для порядков 2, 3 – частный случай стехиометрического соотношения исходных концентраций реагентов).
-
Расчет константы скорости по результатам кинетического опыта (исходная концентрация реагента и концентрация или степень превращения в заданный момент времени) для односторонней реакции порядка 0, 1, 2, 3 с использованием интегральной формы кинетического уравнения (для порядков 2, 3 в частном случае стехиометрического соотношения исходных концентраций реагентов).
-
Расчет константы скорости односторонней реакции первого порядка по времени полупревращения.
-
Сравнение концентраций или времен достижения заданной степени превращения для двух реакций одного порядка (0, 1, 2 или 3) при известных константах скорости и исходных концентрациях.
-
Расчет скорости или константы скорости односторонней реакции по дифференциальной форме кинетического уравнения порядка 0, 1, 2 или 3.
-
Определение порядка односторонней реакции по результатам кинетического опыта методом подбора. Исходные данные – временная зависимость концентрации или общего давления (для газофазных реакций) или любой величины, пропорциональной концентрации. Расчет константы скорости.
-
Определение порядка односторонней реакции методом Оствальда-Нойеса.
Кинетика сложных (обратимых, параллельных, последовательных) двухстадийных реакций первого порядка
Вопросы
-
В чём заключается принцип независимости протекания элементарных стадий? Для описания каких реакций он применяется? Приведите любой известный вам пример практического использования этого принципа.
-
Запишите систему дифференциальных кинетических уравнений, описывающую обратимую гомогенную реакцию первого порядка
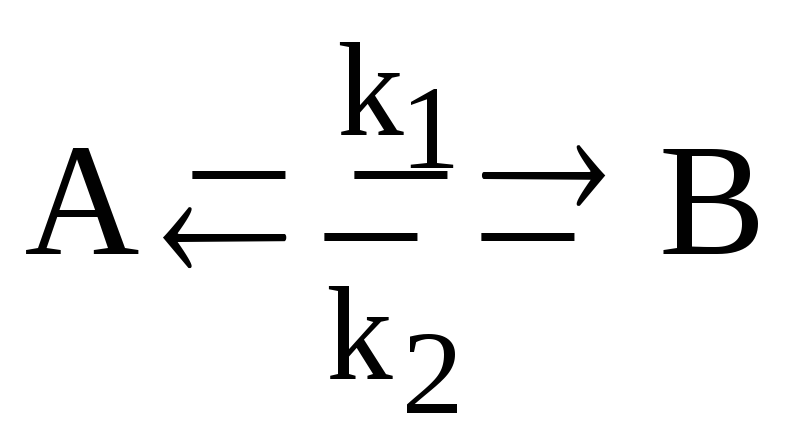 с константами скорости прямой и обратной
реакций k1
и k2
соответственно. Приведите схематическое
изображение соответствующих кинетических
кривых для случая k1
<
k2.
Запишите выражения для константы
равновесия, выраженной через равновесные
концентрации и константы скорости
стадий.
с константами скорости прямой и обратной
реакций k1
и k2
соответственно. Приведите схематическое
изображение соответствующих кинетических
кривых для случая k1
<
k2.
Запишите выражения для константы
равновесия, выраженной через равновесные
концентрации и константы скорости
стадий. -
Запишите систему дифференциальных кинетических уравнений, описывающую обратимую гомогенную реакцию первого порядка
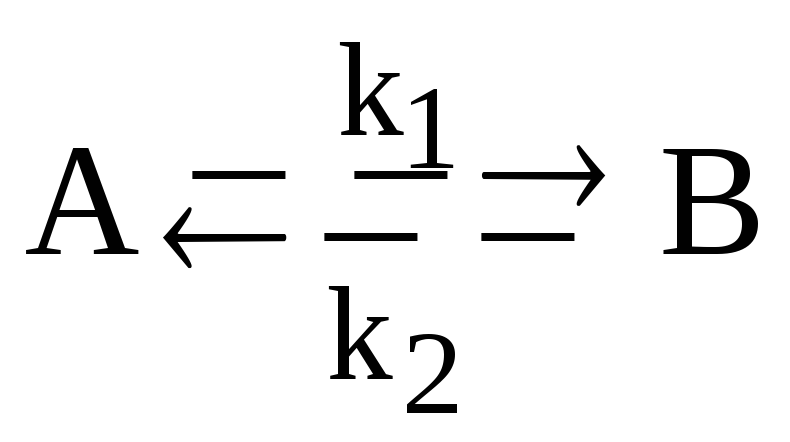 с константами скорости прямой и обратной
реакций k1
и k2
соответственно. Приведите схематическое
изображение соответствующих кинетических
кривых для случая k1
>
k2.
Запишите выражения для константы
равновесия, выраженной через равновесные
концентрации и константы скорости
стадий.
с константами скорости прямой и обратной
реакций k1
и k2
соответственно. Приведите схематическое
изображение соответствующих кинетических
кривых для случая k1
>
k2.
Запишите выражения для константы
равновесия, выраженной через равновесные
концентрации и константы скорости
стадий. -
Запишите систему дифференциальных кинетических уравнений, описывающую обратимую гомогенную реакцию первого порядка
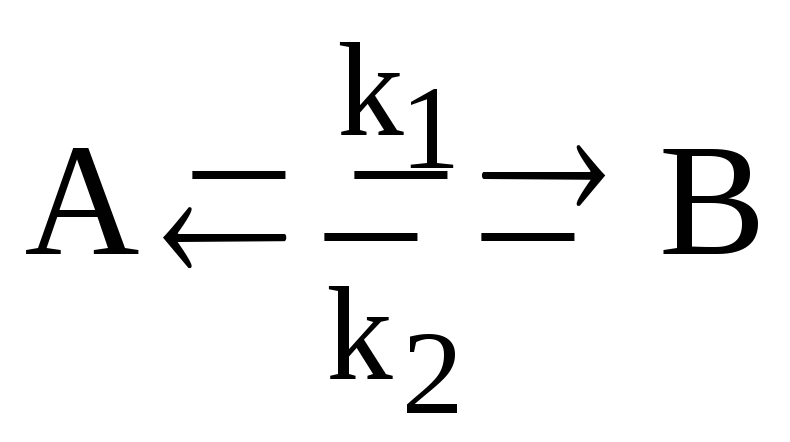 с константами скорости прямой и обратной
реакций k1
и k2
соответственно. Приведите схематическое
изображение соответствующих кинетических
кривых для случая k1
k2.
Запишите выражения для константы
равновесия, выраженной через равновесные
концентрации и константы скорости
стадий.
с константами скорости прямой и обратной
реакций k1
и k2
соответственно. Приведите схематическое
изображение соответствующих кинетических
кривых для случая k1
k2.
Запишите выражения для константы
равновесия, выраженной через равновесные
концентрации и константы скорости
стадий. -
Запишите уравнение для суммы констант скорости стадий обратимой гомогенной реакции первого порядка
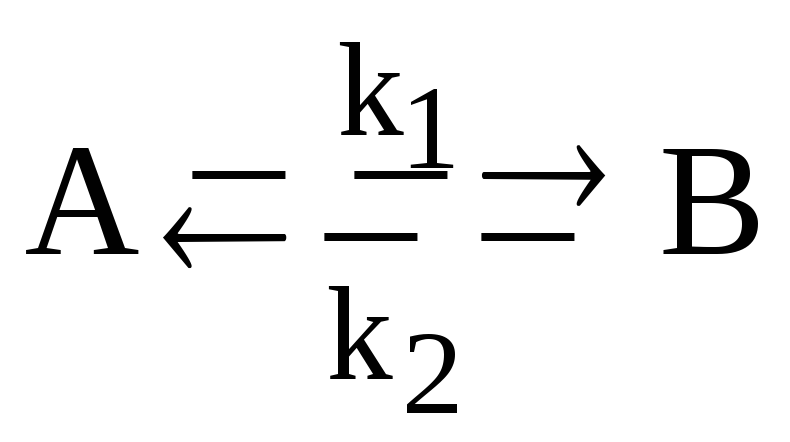 и назовите входящие в него величины.
Какие экспериментальные данные
необходимы для определения каждой из
констант скорости и как их можно
получить?
и назовите входящие в него величины.
Какие экспериментальные данные
необходимы для определения каждой из
констант скорости и как их можно
получить? -
Запишите систему дифференциальных кинетических уравнений, описывающую параллельные гомогенные реакции первого порядка A B, A D с константами скорости k1 и k2 соответственно. Приведите схематическое изображение соответствующих кинетических кривых. Чем определяется соотношение концентраций продуктов B и D в каждый момент времени после начала реакции, если в момент ее начала в системе присутствовало только вещество A?
-
Запишите систему дифференциальных кинетических уравнений, описывающую последовательные гомогенные реакции первого порядка A P B с константами скорости k1 и k2 соответственно. Приведите схематическое изображение соответствующих кинетических кривых для случая k1 < k2. Чем определяется максимальная концентрация промежуточного вещества P и время её достижения?
-
Запишите систему дифференциальных кинетических уравнений, описывающую последовательные гомогенные реакции первого порядка A P B с константами скорости k1 и k2 соответственно. Приведите схематическое изображение соответствующих кинетических кривых для случая k1>>k2. Чем определяется максимальная концентрация промежуточного вещества P и время её достижения?
-
Запишите систему дифференциальных кинетических уравнений, описывающую последовательные гомогенные реакции первого порядка A B + C, B D с константами скорости k1 и k2 соответственно. Приведите схематическое изображение соответствующих кинетических кривых для случая, когда в момент начала реакции в системе присутствовало только вещество A. Константы скорости стадий – величины одного порядка.
-
Для необратимой реакции первого порядка, происходящей по двум одновременно протекающим направлениям: A B (с константой скорости k1) и A C (с константой скорости k2), изобразите схематически на одном графике кинетические кривые для всех участников процесса для случая, когда k1 = 2.k2. Поясните, как из экспериментальных данных определить каждую из констант скорости.
-
Для необратимой реакции первого порядка, происходящей по двум одновременно протекающим направлениям: A B (с константой скорости k1) и A C (с константой скорости k2), изобразите схематически на одном графике кинетические кривые для всех участников процесса для случая, когда k1 = 0,5.k2. Поясните, как из экспериментальных данных определить каждую из констант скорости.
-
Для обратимой реакции первого порядка:
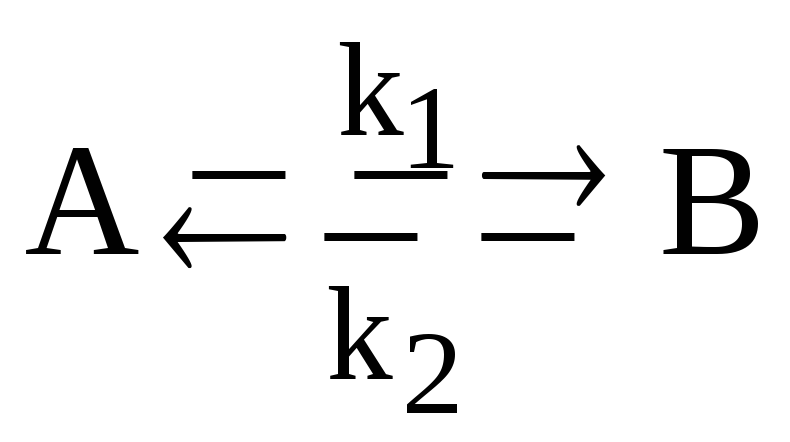 представьте графически кинетические
кривые для компонентов А и В для случая,
когда k1
= 5.k2.
Поясните, как из экспериментальных
данных определить каждую из констант
скорости.
представьте графически кинетические
кривые для компонентов А и В для случая,
когда k1
= 5.k2.
Поясните, как из экспериментальных
данных определить каждую из констант
скорости. -
Для обратимой реакции первого порядка:
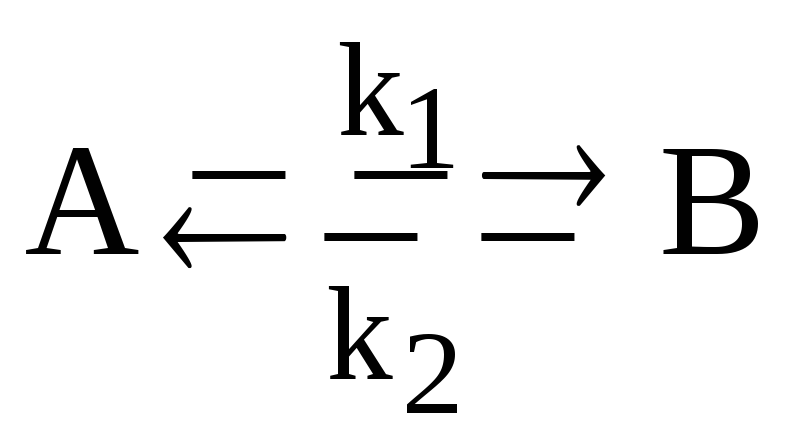 представьте графически кинетические
кривые для компонентов А и В для случая,
когда k1
= 0,3.k2.
Поясните, как из экспериментальных
данных определить каждую из констант
скорости.
представьте графически кинетические
кривые для компонентов А и В для случая,
когда k1
= 0,3.k2.
Поясните, как из экспериментальных
данных определить каждую из констант
скорости.
Типы задач
-
Расчет концентраций веществ или степени превращения в заданный момент времени для реакции, включающей две параллельные стадии первого порядка. Известны начальные концентрации и константы скорости стадий.
-
Расчет констант скорости стадий реакции, включающей две параллельные стадии первого порядка. Известны начальные концентрации и концентрации в заданный момент времени. Продукты реакции в момент ее начала в системе отсутствуют.
-
Расчет концентраций веществ или степени превращения в заданный момент времени для реакции, включающей две последовательные стадии первого порядка. Известны начальные концентрации и константы скорости стадий.
-
Расчет концентраций веществ или степени превращения в заданный момент времени для обратимой реакции, включающей две стадии первого порядка. Известны начальные концентрации и константы скорости стадий.
-
Расчет констант скорости стадий обратимой реакции первого порядка по результатам кинетического опыта (зависимость концентрации от времени).
Температурная зависимость скорости химических реакций
Вопросы
-
Как зависит константа скорости реакции от температуры? Приведите дифференциальную и интегральную формы соответствующего уравнения, используемого наиболее часто. Назовите величины, входящие в эти уравнения.
-
Сформулируйте эмпирическое правило Вант-Гоффа, используемое в кинетическом описании химических реакций. Запишите соответствующее уравнение, назовите используемые величины, укажите ограничения применимости этого уравнения.
-
Запишите уравнение Аррениуса в дифференциальной и интегральной формах. Справедливо ли это уравнение для скорости химической реакции? Поясните, почему. При каком условии (допущении) чаще всего выполняется интегрирование уравнения Аррениуса? Справедливо ли это условие в общем случае?
-
Что такое энергия активации? Опишите основные этапы определения энергии активации из экспериментальных данных. Приведите соответствующий график в Аррениусовых координатах. Назовите все используемые величины.
-
Объясните физический смысл понятия «энергия активации элементарной химической реакции». Интерпретируйте его с помощью энергетической диаграммы химической реакции. Что означает понятие «координата химической реакции»?
-
Дайте определение понятия «энергия активации». Вычислите энергию активации некоторой реакции, скорость которой удваивается при повышении температуры с 295 К до 305 К. Изобразите схематически соответствующий график в Аррениусовых координатах.
-
Дайте определение понятия «энергия активации». Представьте схематически в Аррениусовых координатах температурные зависимости констант скорости для двух реакций, энергии активации которых отличаются примерно в два раза. Приведите обоснование построения.
-
При некоторой температуре T1 константы скорости двух реакций практически одинаковы. Будут ли различаться (и если да, то как?) константы скорости этих реакций при температуре T2 > T1, если энергия активации первой реакции больше, чем энергия активации второй реакции. Приведите обоснованный ответ.
-
Какой минимум экспериментальных данных необходим для оценки энергии активации реакции? Как можно получить эти данные? Назовите основные этапы расчета энергии активации из этих данных.
-
Изобразите схематически график зависимости, которым можно воспользоваться для определения энергии активации реакции. Напишите соответствующую расчетную формулу и назовите входящие в нее величины.
-
Во сколько раз изменится скорость реакции при повышении температуры от 25oC до 50 oC, если энергия активации реакции равна 90 кДж/моль? Рассчитайте температурный коэффициент Вант-Гоффа для этой реакции.
-
В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 10 оС до 20 оС или при нагревании от 210оС до 220 оС? Приведите обоснование ответа с использованием уравнений Вант-Гоффа и Аррениуса. Энергию активации считайте постоянной.
-
При сравнении двух реакций обнаружено, что скорость первой увеличивается в три раза при нагревании от 27оС до 37оС. Скорость второй реакции увеличивается также в три раза, но при нагревании от от 727оС до 737оС? Какая из реакций имеет большую энергию активации? Ответ подтвердите расчетом.
Типы задач
-
Расчет константы скорости химической реакции при заданной температуре по уравнению Аррениуса (даны энергия активации и предэкспоненциальный множитель).
-
Расчет энергии активации и предэкспоненциального множителя в уравнении Аррениуса по зависимости константы скорости реакции от температуры.
-
Расчет константы скорости (или времени полупревращения) химической реакции при заданной температуре по значениям константы скорости при двух других температурах. Используется уравнение Аррениуса, предполагается постоянство энергии активации.
-
Оценка константы скорости реакции при заданной температуре с использованием эмпирического правила Вант-Гоффа.
-
Расчет температурного коэффициента Вант-Гоффа по значениям константы скорости реакции при двух температурах.
-
Расчет энергии активации при заданной температуре по температурной зависимости константы скорости реакции с использованием уравнения Аррениуса в дифференциальной форме.
-
Расчет изменения времени достижения заданной степени превращения (в том числе времени полупревращения) при увеличении или уменьшении температуры. Дан порядок односторонней реакции, параметры уравнения Аррениуса и, возможно, начальная концентрация (при порядке, отличном от 1).
-
Расчет температуры, при которой односторонняя реакция первого порядка завершится за определенное время. Даны время завершения реакции при другой температуре и энергия активации реакции. Под временем завершения реакции понимается время достижения какой-либо высокой степени превращения (99% или 99,9% или более).
Используемые таблицы: Справочник табл. 131, 132.
Теории кинетики
Вопросы
-
Перечислите основные положения теории активных соударений. Запишите уравнения, выведенные на основе этой теории, описывающие скорость и константу скорости реакции между двумя одинаковыми частицами. Назовите все используемые величины. Какие исходные данные требуются для расчета скорости реакции с использованием этих уравнений?
-
Перечислите основные положения теории активных соударений. Запишите уравнения, выведенные на основе этой теории, описывающие скорость и константу скорости реакции между двумя разными частицами. Назовите все используемые величины. Какие исходные данные требуются для расчета скорости реакции с использованием этих уравнений?
-
Запишите уравнения, позволяющие вычислить предэкспоненциальный множитель в уравнении Аррениуса для бимолекулярной реакции по теории активных соударений. Какие исходные данные требуются для этого расчета? В силу каких причин результат этого расчета может отличаться от полученного в экспериментах? Как учитывается это отличие?
-
Что такое стерический фактор? В какой теории он используется и с какой целью? Как можно вычислить стерический фактор, основываясь на экспериментальных данных о кинетических характеристиках процесса?
-
Теория активных соударений позволяет предсказать величину предэкспоненциального множителя для бимолекулярных реакций, основываясь только на информации о свойствах реагирующих молекул. Укажите, о каких именно свойствах идет речь. Какое из приведенных ниже чисел близко к верхнему пределу теоретически ожидаемой величины предэкспоненциального множителя при комнатной температуре (300К): 1015, 1011, 107 или 104 л/(моль.с)? Ответ подтвердите расчетом.
-
Перечислите основные положения теории переходного состояния, сопровождая их соответствующей кинетической схемой. Запишите основное уравнение этой теории (для константы скорости) и назовите входящие в него величины.
-
Определите смысл понятий «координата реакции», «истинная энергия активации», «активированный комплекс» в терминах теории переходного состояния.
-
Запишите реакции, представляющие схему механизма процесса в рамках теории переходного состояния. Исходя из этой схемы и основного уравнения теории, выведите выражение для скорости реакции, которое включает концентрации исходных веществ.
-
Как раскрывается физический смысл предэкспоненциального множителя в уравнении Аррениуса в терминах теории переходного состояния? Приведите соответствующее уравнение и назовите входящие в него величины.
-
Константа скорости мономолекулярного распада активированного комплекса с образованием продуктов реакции не зависит от типа реакции и от природы реагирующих веществ. Приведите выражение, представляющее названную величину, как функцию температуры. Объясните, почему скорость реакции, тем не менее, зависит от типа реакции и природы реагирующих веществ.
-
Значение константы скорости мономолекулярного распада активированного комплекса с образованием продуктов реакции при комнатной температуре составляет 6,2.1012 с-1 и не содержит никаких признаков индивидуальности химического процесса. Объясните, почему константа скорости реакции, тем не менее, зависит от природы реагирующих веществ. Ответ подтвердите анализом соответствующего уравнения теории переходного состояния.
-
Для реакции разложения органического вещества в газовой фазе, происходящей по схеме «А продукты», была исследована зависимость периода половинного превращения от начального давления (концентрации) реагента при постоянной температуре. Оказалось, что при малых давлениях период полупревращения линейно уменьшался с повышением исходной концентрации. В то же время, при высоких давлениях время полупревращения не зависело от начального давления (концентрации) реагента. Объясните механизм наблюдаемых явлений с помощью схемы Линдемана.
-
Назовите условия, при которых реакция разложения (а также изомеризации) вещества в газовой фазе (типа «А продукты») при термическом механизме активации протекает по второму порядку. Приведите обоснование ответа.
-
Назовите условия, при которых реакция разложения (а также изомеризации) вещества в газовой фазе (типа «А продукты») при термическом механизме активации протекает по первому порядку. Приведите обоснование ответа.
-
Какие кинетические особенности реакций объясняет схема Линдемана? Запишите и прокомментируйте соответствующие кинетические уравнения.
-
Реакции термического разложения некоторых органических веществ в газовой фазе протекают как реакции второго порядка при малых парциальных давлениях реагента и как реакции первого порядка при высоких парциальных давлениях. Как объясняется этот эффект с помощью схемы Линдемана?
-
По какому механизму протекают реакции рекомбинации двух атомов или свободных радикалов в одну частицу в газовой фазе? Приведите объяснение, запишите соответствующие уравнение элементарной стадии и кинетическое уравнение скорости реакции в дифференциальной форме. Укажите частные порядки и полный порядок реакции.
