
- •«Ухтинский государственный технический университет»
- •Оглавление Часть ι
- •Тема 1: Происхождение магматических, осадочных, метаморфических пород. Минеральный и химический составы пород, их изменение под воздействием выветривания скальных пород………………………………….91
- •1. Формирование и состав горных пород
- •2. Неорганические материалы с высокотемпературной обработкой
- •2.1 Керамические материалы
- •2.2 Силикаты
- •2.3 Металлы
- •3. Минеральные вяжущие вещества
- •3.1 Воздушные вяжущие вещества
- •3.2 Гидравлические вяжущие вещества
- •3.3 Бетоны
- •4. Строительные материалы органического происхождения
- •4.1 Древесина
- •4.2 Полимеры
- •4.3 Битумы
- •5. Лакокрасочные материалы
- •6. Создание композиционных материалов
- •Часть ιι
- •1.Происхождение горных пород.
- •16. Укрепление поверхности строительных материалов
- •Задача № 1
- •Задача №2
- •Задача №3
- •Лариса Алексеевна Ерохина
2.2 Силикаты
Свободная кремневая кислота легко образует коллоидные растворы, поэтому в осадке может быть только частично. Осадок – бесцветный студень состава mSiO2∙ nH2O, где m и n меняются в зависимости от условий осаждения. Когда m>1, это соответствует образованию поликремневых кислот, производными которых считаются многие минералы. Основной формой существования свободной кремневой кислоты в водном растворе является слабая ортокремневая кислота – H4SiO4. Соли кремневых кислот называют силикатами. Они могут быть образованы и метакремневой или диортокремневой кислотой и отличаются большим разнообразием.
Кремнезём является основой химического состава силикатов. Основной природной формой диоксида кремния является минерал кварц с плотностью 2,65 г/см3. Горный хрусталь является чистым и крупным кристаллом природного кварца. Кварцевый песок является продуктом разрушения горных пород, загрязнённых примесями. Он является и одним из важнейших строительных материалов, ежегодное мировое потребление которого исчисляется сотнями миллионов тонн. На долю свободного диоксида кремния приходится около 12% массы земной коры. Ещё большее количество SiO2 (~43% от массы земной коры) химически связано в составе различных горных пород.
Наиболее устойчивой полиморфной модификацией кварца в нормальных условиях является α-кварц, при температуре 573°С он переходит в другую модификацию с изменением объёма – β-кварц. При температуре 867°С он опять переходит в γ-кварц (тридимит) и при температуре 1470°С ещё раз меняет модификацию на β-кристобалит, который устойчив вплоть до температуры плавления кварца 1723°С. Кроме кристаллической формы есть в природе осадочные породы органогенного происхождения, основу которых составляет аморфный диоксид кремния (диатомиты, трепел, опал).
В основе структур всех модификаций кремнезёма лежит кремнекислородный тетраэдр, где атом кремния окружен четырьмя атомами кислорода (Рис.2). Образуется трёхмерная полимерная структура, обеспечивающая высокую прочность, твёрдость и температуру плавления. Тетраэдры объединяются друг с другом общими вершинами, возникает силоксановая связь Si-O-Si, где атом кислорода называют мостиковым.
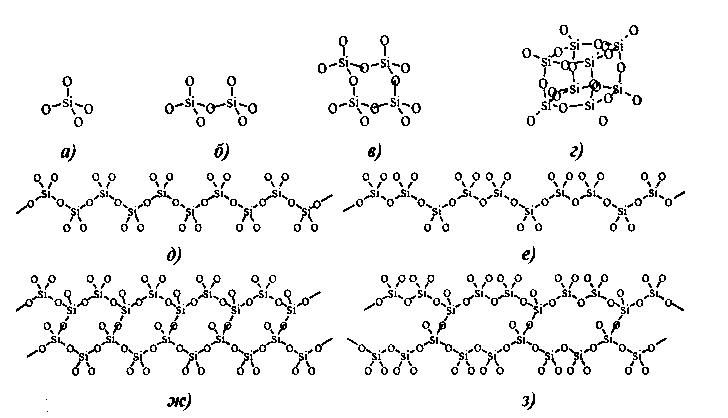
Рис.2 Примеры строения силикатов[2]
а) ортосиликат, б) диортосиликат, в) циклотетрасиликат, г) бициклооктосиликат, д) пироксеновая цепочка, е) волластонитовая цепочка, ж) амфиболовая лента, з) ксонотлитовая лента.
Кремнезём инертен, в воде практически нерастворим, реагирует с фтороводородной кислотой и при кипячении со щелочами, образует соли кремневой кислоты – силикаты: SiO2 + 2NaOH = Na2H2SiO4.
Характерной чертой кремнезёма как кислотного окисла является способность его молекул соединяться не только со щелочными окислами, но и между собой, т.е. полимеризоваться.
Мелко раздробленный диоксид кремния быстро растворяется при кипячении с растворами щелочей. Обычно процесс ведут в автоклаве, где кроме высокой температуры повышено давление. По мере накопления в растворе SiO2 образуется вначале ортосиликат, который переходит в более полимеризованные силикаты – Na2SiO3. Так получают жидкое стекло.
Другой способ перевода кремнезёма в раствор состоит в сплавлении его со щёлочными карбонатами, из которых при высокой температуре выделяется углекислый газ: SiO2 + Na2CO3 = Na2SiO3 + CO2
Этот процесс широко используется в промышленности для получения силикатного стекла. Суммарный процесс образования обычного стекла может быть выражен уравнением:
Na2CO3 + 6SiO2 + CaCO3 = Na2O· CaO· 6SiO2 + 2CO2.
Если бы стекло варилось только из двуокиси кремния, то его производство потребовало бы высоких температур, так как температура плавления двуокиси кремния выше 1700°С. Для понижения температуры плавления в сырьевую смесь вводят соду или сульфат натрия.
Алюмосиликаты – это силикаты, в которых часть атомов кремния в тетраэдрах SiO4 замещена на атомы алюминия. Так как алюминий трёхвалентен, а кремний – четырёхвалентен, в их структурах появляются дополнительные катионы металлов – Na+, K+, Mg2+ или Ca2+. С такой заменой в природе образовались полевые шпаты, которые входят в состав многих горных пород.
Аморфное состояние твёрдых тел отличается от кристаллического в первую очередь неполной упорядоченностью структуры – отсутствием в ней дальнего порядка (Рис.3). Внутри аморфной структуры выделяют стеклообразное состояние, которое относят к твёрдым аморфным материалам, получаемым глубоким переохлаждением жидкостей. Застывая, получается стекло с характерными свойствами аморфных тел: изотропией, отсутствием определённой точки плавления, прозрачностью. По своей структуре стёкла ближе к жидкостям. Если их не поризуют, они плотны. Структурные различия между стеклообразным и кристаллическим состояниями вещества с ковалентной решёткой демонстрирует рисунок 3, где показано строение кристаллического и стеклообразного кремнезёма.
В стеклообразном кремнезёме относительно небольшое изменение части валентных углов между связями Si-O-Si приводит к заметному искажению последовательности соединения кремнекислородных тетраэдров. Вместо правильных шестиугольных «окон» в слое получается набор несимметричных «окон» с количеством атомов кремния в них от 4 до 8.
Практически любая жидкость (даже вода) может быть переведена в стеклообразное состояние при достаточно быстром охлаждении. Например, при скорости охлаждения 105-107 градусов в секунду многие металлические сплавы могут быть получены в стеклообразном состоянии (металлические стёкла или аморфные металлы).
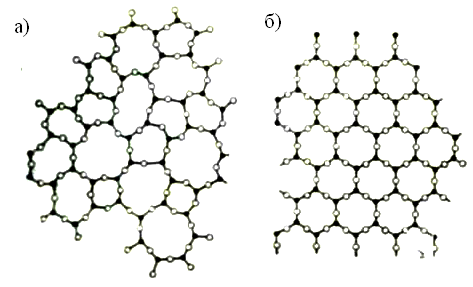
Рис. 3 Схема строения аморфной (а) и кристаллической (б) структуры [2].
Стекло
Формование стеклоизделий осуществляют на специальных стеклоформующих машинах с использованием различных методов. Толстое листовое стекло формуют прокатом, оконное листовое стекло, трубы, стекловолокно – вытягиванием, стеклянная посуда, тара – прессованием, сортовая посуда, узкогорлая тара – выдуванием. Для производства высококачественного листового стекла применяют флоат-процесс, при котором расплавленную стекломассу разливают на поверхность расплавленного олова. Плотность стекла более чем в два раза ниже плотности раскалённого олова, стекломасса растекается по его поверхности, образуя абсолютно плоский слой любой толщины. Слой стекла охлаждают, отверждают и извлекают с поверхности олова. При этом олово остаётся жидким.
Для получения стёкол с особыми свойствами в состав шихты вводят неорганические добавки, которые в расплавленной стекломассе растворяются и входят в его структуру. Их делят на стеклообразующие и модифицирующие. К стеклообразующим относят B2O3, Al2O3, P2O5, As2O5, V2O5 и др. В структуре стекла атомы кремния замещают модифицирующие атомы металлов: K2O, MgO, BaO, ZnO, PbO и др. Каждый оксид изменяет свойства стекла: оксиды бора, алюминия и цинка повышают химическую стойкость стекла, оксиды алюминия и магния – прочность и термостойкость, оксиды фосфора, свинца, бария и цинка снижают температуру размягчения стекла, оксиды свинца и бария ещё повышают его коэффициент преломления (в хрустале). Стекло, состоящее из двух компонентов: 75% SiO2 и 25% Na2O, применять почти невозможно из-за малой химической устойчивости, оно растворяется в воде. Такой состав идёт для изготовления жидкого стекла. Для производства строительных стёкол и улучшения физико-химических свойств в состав сырьевой смеси вводят до 4% оксида магния (в виде доломита) и до 2% оксида алюминия (в виде полевых шпатов, каолина). Вводят не все перечисленные стеклообразующие вещества разом, а в зависимости от назначения стекла. Например, введение в состав стекломассы трёхокиси мышьяка As2O3, селитры, сульфата натрия, хлорида натрия, окиси сурьмы значительно увеличивает прозрачность стекла. В их присутствии закись железа переходит в окись, менее окрашивающая стекломассу. Бор облегчает прохождение ультрафиолетовых лучей сквозь стекло – это увиолевое стекло, а окись церия их задерживает. Такое стекло необходимо для библиотек, витрин магазинов.
Высокоотражающие стёкла получают нанесением на поверхность стекла тонких плёнок металлов (Fe, Ni, Gr) или оксидов (NiO2, Cо3O4, Al2O3 + ZnO). Многие оксиды придают стеклу окраску. Например, Gr2O3, FeO + Fe2O3 – зелёную, Gr2O3 – жёлтую, CoO – синюю, Mn2O3 – фиолетовую, CoO + B2O3 – розовую, Cu2O – красный цвет и др.
Всё большее распространение для теплозащиты помещений получают так называемые низкоэмиссионные стёкла, покрытые тонкой плёнкой специального теплоотражающего материала, например серебра. Такие стёкла хорошо пропускают внутрь помещений солнечный свет, но отличаются высоким коэффициентом отражения, благодаря чему тепло, получаемое внутри помещения, отражается от стекла обратно в помещение, а не излучается наружу.
Физические и физико-механические свойства силикатных стёкол разнообразны. В зависимости от состава плотность может колебаться от 2,2 (кварцевое стекло) до 8,0 г/см3 (свинцово-силикатное). Это прочные, но хрупкие материалы. Наибольшая прочность характерна для малощелочных алюмосиликатных стекол, наименьшая – для боро- и свинцовосиликатных стекол. Прочность стекла при сжатии в зависимости от состава находится в пределах 600 – 12500 МПа, при растяжении доходит до 10000 МПа. Термическая устойчивость стекла определяется его коэффициентом линейного расширения: чем он меньше, тем выше его термическая устойчивость. Наименьший коэффициент линейного расширения имеет кварцевое стекло – 5,8 · 10-7 град-1. Коэффициент линейного расширения оконного стекла находится в пределах 80-120·10‾7град-1. В зависимости от химического состава коэффициент теплопроводности стекла находится в пределах 0,36-0,83 Вт/м°С.
На стекло, используемое в строительстве, неизбежно действует вода. От её воздействия на поверхности стекла очень медленно начинается процесс выщелачивания: образуются тонкие прозрачные плёнки или белые непрозрачные налёты. Это гель кремнекислоты. Его можно смыть и стекло становится прозрачным. Но если было взаимодействие с едкими щелочами, смыть такую плёнку не удаётся, стекло теряет прозрачность.
При попадании влаги на поверхностный слой стекла происходит гидролиз входящих в его состав силикатов. Едкие щёлочи, образующиеся в результате гидролиза, хорошо растворимы, поэтому они вымываются водой, а кремневая кислота образует защитный гелеобразный слой. Этот слой и предохраняет внутренние слои стекла от гидролиза и разрушения. В виде тонкого порошка стекло уже при обычных условиях медленно реагирует с водой. При этом из структуры стекла выщелачивается в основном оксид натрия, переходя в раствор в виде гидроксида, а в остающемся твёрдом каркасе стекла место катионов натрия замещают атомы водорода в составе силанольных групп:
≡SiONa + H2O → ≡SiOH + NaOH.
В случае полного завершения реакции получают в твёрдом остатке каркасный гидросиликат кальция:
SiOH + 2NaOH + CaCO3 → CaO · SiO2 · nH2O + Na2CO3.
Добавляя в шихту или в тонкоизмельченный стеклянный бой специальные пенообразователи, выделяющие при варке стекла газ и вспучивающие стекломассу (мелкодисперсный углерод, карбид кремния SiC, мел CaCO3, пиролюзит MnO2 и др.) получают пеностекло – стеклообразный теплоизоляционный материал. Вспенивают стекло при 700-900°С, получают пеноматериал с плотностью 0,15-0,5 г/см3, отличающийся высокой водостойкостью, теплостойкостью (до 400°С) и морозостойкостью.
Ситаллы – это продукты направленной кристаллизации стекла при его термической обработке. Их называют стеклокерамикой. Это частично закристаллизованные стёкла с объёмной концентрацией кристаллических фаз от 20 до 95%. Микрокристаллы имеют размер до 200 мкм, образуются при введении катализатора (оксидов титана, хрома, никеля, железа, металлов платиновой группы) в расплав стекломассы. Изменяя состав стекла, тип катализатора и режим термообработки, получают ситаллы с различными кристаллическими фазами и заданными свойствами. Технология производства ситаллов включает стадии варки стекла, формовки изделий и специальной термической обработки. Первые две стадии проводят обычными методами, третья стадия проходит в два этапа. Первый – при температуре размягчения стекла, когда зарождаются кристаллы, и второй – отжиг изделий при более высокой температуре, но ниже температуры плавления стекла. Эта температура наиболее благоприятна для развития кристаллов, определяющих свойства готового изделия. От кристаллических веществ того же состава ситаллы отличаются пониженной хрупкостью и повышенной прочностью, в особенности – на изгиб. От стекла их отличает повышенная твёрдость, износостойкость, химическая и термическая устойчивость. Максимальная рабочая температура ситаллов превышает 1300°С. В строительстве широко используются ситаллы, полученные с использованием металлургических шлаков (шлакоситаллы), зол – отходов ТЭЦ (золоситаллы) или горных пород (петроситаллы). Большинство их по химическому составу относится к силикатам или алюмосиликатам кальция и магния с участием оксидов натрия и железа. Их отличает высокая прочность, твёрдость, повышенная истираемость и стойкость к химическим и термическим воздействиям.
Стеклянное волокно получают из расплава стекла, вытекающего через фильеры (отверстия диаметром от 2,5 до 6 мм), расположенные в дне выработочной части печи. Образуется стеклянная нить, наматываемая на барабан, вращающийся со скоростью 150-400 оборотов в минуту.
Другой способ – дутьевой, когда стеклянный расплав раздувается паром. Этим способом получают короткое волокно, используемое для получения теплоизоляционных изделий.
Стеклянное волокно используется главным образом в электротехнической промышленности, а также для тепло- и звукоизоляции. Скреплённое различными связующими (крахмал, полимеры, гипс, цемент, металл) стеклянное волокно армирует матрицы и получают такие композиционные материалы как: стеклогипс, стеклобитум, стеклопласт и др. Из стеклобитума изготавливают мягкую кровлю, кислотоустойчивые сосуды, звукоизоляционные изделия. Обработкой стеклянных нитей полимерами удалось получить материалы, обладающие большей прочностью, чем обычная сталь.
Стеклянное волокно с большим содержанием двуокиси кремния или глинозёма, а также чисто кварцевое служит для изоляции аппаратов, подвергающихся кратковременному или длительному воздействию высоких температур. Стеклянное волокно, насыщенное оксидами бора, кадмия, свинца и висмута, служит для изготовления легковесных экранов для защиты от тепловой радиации, нейтронов и радиоактивного излучения.
Протягивание стальных стержней при 1200°С под давлением до 150 кг/см2 стало возможным только после применения стеклянного волокна в качестве смазки.
