
Курсовая работа - Кузнецов - Благодер - 2005 / Курсовик
.doc
Р оссийский
Химико-Технологический Университет
оссийский
Химико-Технологический Университет
им. Д.И. Менделеева
Кафедра общей и неорганической химии
Курсовая работа по теме: «Определение констант устойчивости комплексов в водном растворе»
Проверил: Кузнецов В.В..
Выполнил: Благодёр А.
Группа: О-44
Вариант: №13
Москва-2005
Задание
По данным рН-метрического титрования системы Ni2+- En – H2O получны следующие данные:
|
V титранта, мл |
pH1 |
pH2 |
|
0 |
2,02 |
2 |
|
1 |
4 |
5 |
|
2 |
5,5 |
6,5 |
|
3 |
5,9 |
7 |
|
4 |
6,4 |
8 |
|
5 |
6,8 |
8,8 |
|
6 |
7,2 |
9,2 |
|
7 |
7,9 |
9,8 |
|
8 |
8,8 |
10,5 |
|
9 |
10,2 |
10,9 |
|
10 |
10,9 |
11 |
|
11 |
11,2 |
11,2 |
|
12 |
11,5 |
11,5 |
Титрант – NaOH 0,16 М
Объём колбы – 50 мл.
Составы аликвот:
|
Опыт |
C(En) |
C(HCl) |
C(Ni2+) |
|
1 |
0,0125 |
0,028 |
0,003 |
|
2 |
0,0125 |
0,028 |
0 |
Требуется рассчитать константы устойчивости существующих в растворе комплексов.
Решение
Часть 1 определение констант протонирования лиганда
По данным рН строим кривую титрования:
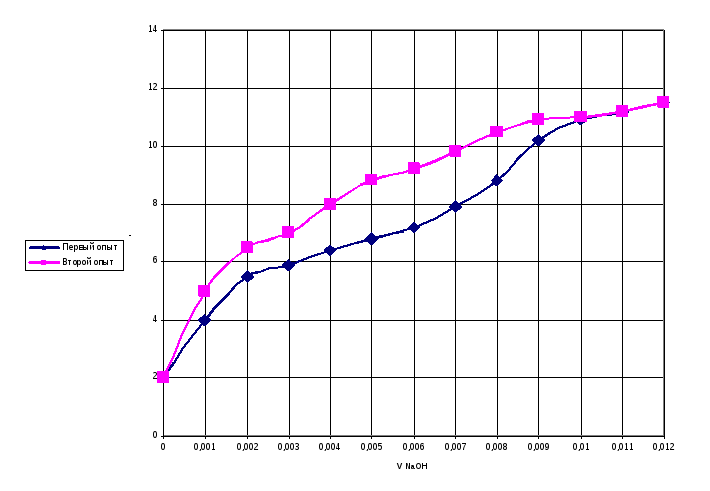
Определяем концентрацию избыточной кислоты: так как реакция протонирования
En+2H+=H2En
протекает нацело, то можно определить концентрацию кислоты в избытке:
С(HCl)изб=С(HCl)исх-2С(En)
С(HCl)изб=0.028-2*0.0125=0.003 моль/л
Определяем объём щёлочи пошедшей на титрование избыточной кислоты:
Vк*С(HCl)изб=VNaOHизб*C(NaOH)
VNaOHизб= Vк*С(HCl)изб/ C(NaOH)
VNaOHизб=0,05*0,003/0,16= 0, 9375 мл
Для титрования раствора не содержащего металла определяем общеаналитические концентрации кислоты, щёлочи и лиганда с учётом разбавления титрантом
С(NaOH)=C(NaOH)исх*Vскорр/Vобщ
С(En)= С(En)исх*V/Vобщ
Vобщ=Vк+Vтитранта
Результаты внесены в таблицу:
-
Vскор, л
С(NaOH), моль/л
С(H2En), моль/л
-0,0009375
-0,003
0,0125
6,25E-05
0,000196078
0,012254902
0,0010625
0,003269231
0,012019231
0,0020625
0,006226415
0,011792453
0,0030625
0,009074074
0,011574074
0,0040625
0,011818182
0,011363636
0,0050625
0,014464286
0,011160714
0,0060625
0,017017544
0,010964912
0,0070625
0,019482759
0,010775862
0,0080625
0,021864407
0,01059322
0,0090625
0,024166667
0,010416667
0,0100625
0,026393443
0,010245902
0,0110625
0,028548387
0,010080645
Рассчитаем степень оттитрованности
![]()
и функцию Бьерума для процесса протонирования лигандов
![]()
Результаты расчёта в таблице:
|
Vскор, л |
С(NaOH), моль/л |
С(H2En), моль/л |
a |
[H+], моль/л |
[OH-], моль/л |
z |
|
-0,0009375 |
-0,003 |
0,0125 |
-0,24 |
0,01 |
1E-12 |
1,44 |
|
6,25E-05 |
0,000196078 |
0,012254902 |
0,016 |
0,00001 |
0,000000001 |
1,983184 |
|
0,0010625 |
0,003269231 |
0,012019231 |
0,272 |
3,16228E-07 |
3,16228E-08 |
1,727976 |
|
0,0020625 |
0,006226415 |
0,011792453 |
0,528 |
0,0000001 |
0,0000001 |
1,472 |
|
0,0030625 |
0,009074074 |
0,011574074 |
0,784 |
0,00000001 |
0,000001 |
1,216086 |
|
0,0040625 |
0,011818182 |
0,011363636 |
1,04 |
1,58489E-09 |
6,30957E-06 |
0,960555 |
|
0,0050625 |
0,014464286 |
0,011160714 |
1,296 |
6,30957E-10 |
1,58489E-05 |
0,70542 |
|
0,0060625 |
0,017017544 |
0,010964912 |
1,552 |
1,58489E-10 |
6,30957E-05 |
0,453754 |
|
0,0070625 |
0,019482759 |
0,010775862 |
1,808 |
3,16228E-11 |
0,000316228 |
0,221346 |
|
0,0080625 |
0,021864407 |
0,01059322 |
2,064 |
1,25893E-11 |
0,000794328 |
0,010985 |
|
0,0090625 |
0,024166667 |
0,010416667 |
2,32 |
1E-11 |
0,001 |
-0,224 |
|
0,0100625 |
0,026393443 |
0,010245902 |
2,576 |
6,30957E-12 |
0,001584893 |
-0,42131 |
|
0,0110625 |
0,028548387 |
0,010080645 |
2,832 |
3,16228E-12 |
0,003162278 |
-0,5183 |
По полученным значениям строим график
зависимости z=f(pH)
и методом полуцелых значений определим
ступенчатые константы протонирования.
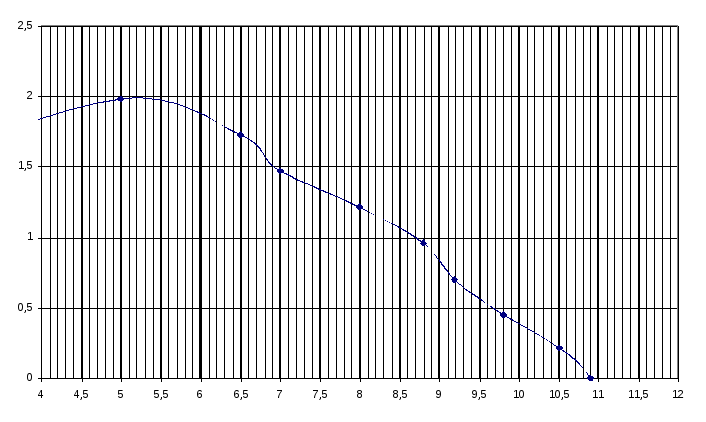
lgK2H= 6.9 K2H= 7943282,34
lgK1H= 9.7 K1H= 5011872336,27
Метод полуцелых значений неточен, потому уточняем значения констант по формуле
![]() ,
,
где z – основность кислоты,
i – номер константы протонирования
при a=0-1 i=2
при a=1-2 i=1
Результаты сведены в таблицу:
|
a |
[H] |
[OH] |
z |
lgK1 |
lgK2 |
K1 |
K2 |
|
-0,24 |
0,01 |
1E-12 |
1,44 |
- |
1,895265 |
- |
78,57143 |
|
0,016 |
0,00001 |
0,000000001 |
1,983184 |
- |
6,766914 |
- |
5846746 |
|
0,272 |
3,16228E-07 |
3,16228E-08 |
1,727976 |
- |
6,927511 |
- |
8462731 |
|
0,528 |
0,0000001 |
0,0000001 |
1,472 |
- |
6,951308 |
- |
8939394 |
|
0,784 |
0,00000001 |
0,000001 |
1,216086 |
- |
7,440357 |
- |
27564938 |
|
1,04 |
1,58489E-09 |
6,30957E-06 |
0,960555 |
10,18653146 |
- |
1,54E+10 |
- |
|
1,296 |
6,30957E-10 |
1,58489E-05 |
0,70542 |
9,579244527 |
- |
3,8E+09 |
- |
|
1,552 |
1,58489E-10 |
6,30957E-05 |
0,453754 |
9,719432751 |
- |
5,24E+09 |
- |
|
1,808 |
3,16228E-11 |
0,000316228 |
0,221346 |
9,953726992 |
- |
8,99E+09 |
- |
|
2,064 |
1,25893E-11 |
0,000794328 |
0,010985 |
8,94558056 |
- |
8,82E+08 |
- |
|
2,32 |
1E-11 |
0,001 |
-0,224 |
- |
- |
- |
- |
|
2,576 |
6,30957E-12 |
0,001584893 |
-0,42131 |
- |
- |
- |
- |
|
2,832 |
3,16228E-12 |
0,003162278 |
-0,5183 |
- |
- |
- |
- |
|
Среднее значение |
9,676903258 |
7,021522 |
4,75E+09 |
10508058 |
|||
После статистической обработки результатов получаем, что
K1H=4,75E+09±36,87
K1H=10508058±3,39
Получаем, что
β1H=K1H= 4752293531
β2H=K2H* K1H = 4,99374E+16
Строим распределительную диаграмму для выхода протонированных форм по формуле
Результаты сведены в таблицу и отражены в распределительной диаграмме:
|
pH |
[H+] |
α0 |
α1 |
α2 |
|
2,02 |
0,009549926 |
2,00249E-13 |
9,51642E-06 |
0,999990484 |
|
4 |
0,0001 |
1,98363E-07 |
0,009426794 |
0,990573008 |
|
5,5 |
3,16228E-06 |
0,000153904 |
0,231288462 |
0,768557633 |
|
5,9 |
1,25893E-06 |
0,001025007 |
0,487113398 |
0,511861596 |
|
6,4 |
3,98107E-07 |
0,018685765 |
0,888002423 |
0,093311812 |
|
6,8 |
1,58489E-07 |
0,115509258 |
0,870001604 |
0,014489137 |
|
7,2 |
6,30957E-08 |
0,248856818 |
0,746195802 |
0,00494738 |
|
7,9 |
1,25893E-08 |
0,56998175 |
0,429303282 |
0,000714968 |
|
8,8 |
1,58489E-09 |
0,869315267 |
0,130641321 |
4,34113E-05 |
|
10,2 |
6,30957E-11 |
0,943542435 |
0,056450097 |
7,46771E-06 |
|
10,9 |
1,25893E-11 |
0,954628485 |
0,045366748 |
4,76716E-06 |
|
11,2 |
6,30957E-12 |
0,970886103 |
0,029111966 |
1,93016E-06 |
|
11,5 |
3,16228E-12 |
0,985193943 |
0,014805565 |
4,9198E-07 |
Часть2 Определение констант устойчивости комплекса
Определяем функцию Фрониуса для процесса протонирования лигандов в каждой точке для первого опыта.
![]() ,
,
а так же вспомогательную функцию:
![]()
Результаты свели в таблицу:
-
V, л
pH
[H+], моль/л
f
φ
0
2,02
0,009549926
4,55439E+12
9,10873E+12
0,001
4
0,0001
499849002,8
999222774,3
0,002
5,5
3,16228E-06
514402,8441
1013775,617
0,003
5,9
1,25893E-06
85129,19234
164273,6016
0,004
6,4
3,98107E-07
9807,463056
17721,00398
0,005
6,8
1,58489E-07
2008,55797
3261,928173
0,006
7,2
6,30957E-08
499,6537303
697,4580099
0,007
7,9
1,25893E-08
68,74237183
75,65691276
0,008
8,8
1,58489E-09
8,657314687
7,782751707
0,009
10,2
6,30957E-11
1,300048255
0,300247059
0,01
10,9
1,25893E-11
1,059835745
0,05984366
0,011
11,2
6,30957E-12
1,029986933
0,029988921
0,012
11,5
3,16228E-12
1,015028571
0,01502907
Определяем функцию Бьерума для процесса комплексообразования:
![]() ,
,
где CL и CM определены с учётом разбавления
С(Ni2+)= С0(Ni2+)*Vк/Vобщ
Концентрацию свободного лиганда CL определяем из условия материального баланса по протонам:
СH=[H+]+[HEn+]+2[H2En]=[ H+]+β1[H+][En]+ 2β2[H+]2[En]=[H+]+[L]φ
[L]=(CH-[H+])/ φ=((2-a)*C(En)-[H+])/ φ
Результаты расчётов сведены в таблицу:
|
V, л |
C(Ni2+) |
C(H2En) |
[En] |
pL |
n |
|
0 |
0,003 |
0,0125 |
2,02554E-15 |
14,69346 |
1,091639 |
|
0,001 |
0,002941176 |
0,012255 |
2,42326E-11 |
10,6156 |
0,048376 |
|
0,002 |
0,002884615 |
0,012019 |
2,04839E-08 |
7,688588 |
0,51385 |
|
0,003 |
0,002830189 |
0,011792 |
1,05661E-07 |
6,976087 |
0,988506 |
|
0,004 |
0,002777778 |
0,011574 |
7,94181E-07 |
6,100081 |
1,362664 |
|
0,005 |
0,002727273 |
0,011364 |
3,34432E-06 |
5,475692 |
1,703671 |
|
0,006 |
0,002678571 |
0,011161 |
1,12653E-05 |
4,948257 |
2,065265 |
|
0,007 |
0,002631579 |
0,010965 |
6,49282E-05 |
4,187567 |
2,470605 |
|
0,008 |
0,002586207 |
0,010776 |
0,00026584 |
3,57538 |
3,27677 |
|
0,009 |
0,002542373 |
0,010593 |
- |
- |
- |
|
0,01 |
0,0025 |
0,010417 |
- |
- |
- |
|
0,011 |
0,002459016 |
0,010246 |
- |
- |
- |
|
0,012 |
0,002419355 |
0,010081 |
- |
- |
- |
Строим график зависимости n=f(pL) и методом полуцелых значений определяем ступенчатые константы устойчивости:
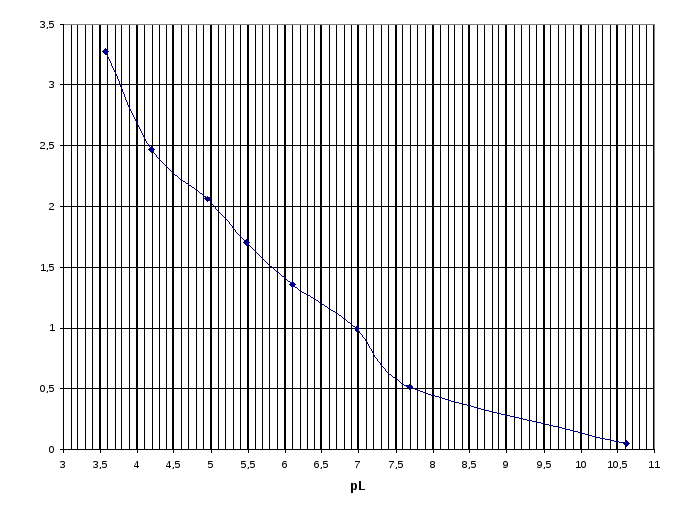
Получаем из графика что:
lgKуст3= 4,15 Kуст3= 1,41E+04
lgKуст2= 5,83 Kуст2= 6,76E+05
lgKуст1= 7,75 Kуст1= 5,62E+07
β1=Куст1= 5,62E+07
β2=Куст1* Куст2= 3,80E+13
β3=Куст1* Куст2* Куст3= 5,37E+17
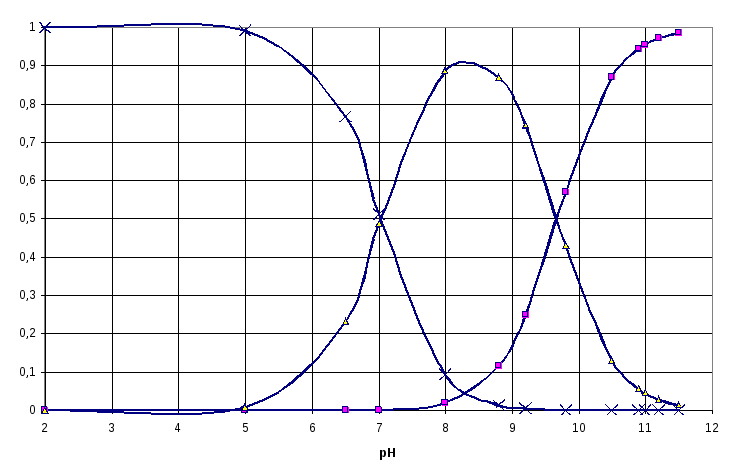
Строим распределительную диаграмму для форм комплекса в растворе:
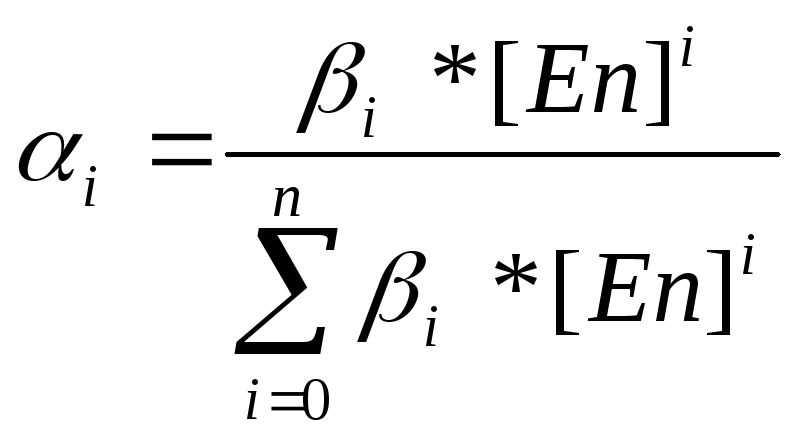
Результаты сведены в таблицу и отражены в распределительной диаграмме:
|
V, л |
pH |
[H+], моль/л |
[En], моль/л |
pL |
α0 |
α1 |
α2 |
α3 |
|
0 |
2,02 |
0,009549926 |
2,02554E-15 |
14,69346 |
1,00E+00 |
1,14E-07 |
1,56E-16 |
4,46E-27 |
|
0,001 |
4 |
0,0001 |
2,42326E-11 |
10,6156 |
9,99E-01 |
1,36E-03 |
2,23E-08 |
7,63E-15 |
|
0,002 |
5,5 |
3,16228E-06 |
2,04839E-08 |
7,688588 |
4,61E-01 |
5,31E-01 |
7,36E-03 |
2,13E-06 |
|
0,003 |
5,9 |
1,25893E-06 |
1,05661E-07 |
6,976087 |
1,36E-01 |
8,07E-01 |
5,76E-02 |
8,60E-05 |
|
0,004 |
6,4 |
3,98107E-07 |
7,94181E-07 |
6,100081 |
1,43E-02 |
6,39E-01 |
3,43E-01 |
3,85E-03 |
|
0,005 |
6,8 |
1,58489E-07 |
3,34432E-06 |
5,475692 |
1,58E-03 |
2,96E-01 |
6,70E-01 |
3,17E-02 |
|
0,006 |
7,2 |
6,30957E-08 |
1,12653E-05 |
4,948257 |
1,61E-04 |
1,02E-01 |
7,75E-01 |
1,23E-01 |
|
0,007 |
7,9 |
1,25893E-08 |
6,49282E-05 |
4,187567 |
3,22E-06 |
1,17E-02 |
5,15E-01 |
4,73E-01 |
|
0,008 |
8,8 |
1,58489E-09 |
0,00026584 |
3,57538 |
7,82E-08 |
1,17E-03 |
2,10E-01 |
7,89E-01 |
|
0,009 |
10,2 |
6,30957E-11 |
- |
- |
- |
- |
- |
- |
|
0,01 |
10,9 |
1,25893E-11 |
- |
- |
- |
- |
- |
- |
|
0,011 |
11,2 |
6,30957E-12 |
- |
- |
- |
- |
- |
- |
|
0,012 |
11,5 |
3,16228E-12 |
- |
- |
- |
- |
- |
- |
