
Методы галогенирования в тонком органическом синтезе
.pdf
|
|
Br2 |
|
N |
Br |
N |
Br3 |
H |
|
H |
|
CH3 |
|
NaOH |
|
|
SONH2 Br2 |
|
|
CH3 |
|
SONHBr |
|
8.АНАЛИЗ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ.
1)Для описанных в литературе соединений – определение температур кипения или плавления.
2)Хроматографические методы.
3)ИК-, УФ-, ЯМР-спектроскопия (для фторсодержащих соединений), масс-спектрометрия.
4)Проба Бельштейна – окрашивание пламени в зеленый цвет при внесении в него медной проволоки со следами хлорсодержащего соединения.
9.МЕТОДЫ ДЕГАЛОГЕНИРОВАНИЯ.
9.1.Замещение галогена на гидроксильную группу.
Фтор не замещается (связь C-F практически не гидролизуется); бром замещается легче, чем хлор; в случае йода одновременно с замещением происходит конкурирующая реакция элиминирования.
38
4HCl  MnO2
MnO2  Cl2
Cl2  MnCl2
MnCl2  2 H2O
2 H2O
16 HCl  2KMnO4
2KMnO4  5Cl2
5Cl2  2KCl
2KCl  2MnCl2
2MnCl2  8H2O
8H2O
14HCl  K2Cr2O7
K2Cr2O7  3Cl2
3Cl2  2KCl
2KCl  2CrCl3
2CrCl3  7H2O
7H2O
Перед использованием Cl2 сушат, пропуская через концентрированную серную кислоту или над пятиокисью фосфора. Процесс проводят, барботируя газообразный хлор через жидкое вещество, или выдерживают твердое вещество в атмосфере хлора. Но чаще всего пропускают хлор через раствор веществ в инертных для действия хлора растворителях (четыреххлористый углерод, ледяная уксусная кислота, нитробензол и др.). По завершении реакции остаток хлора необходимо удалить пропусканием через реакционную массу тока воздуха, диоксида углерода или обработкой раствором восстановителя, например:
Cl2  NaHSO3
NaHSO3  H2O
H2O  2 HCl
2 HCl  NaHSO4
NaHSO4
Так как газообразный Cl2 трудно взвесить, берут расчетное количество реагентов, из которых его получают. Можно контролировать количество связанного хлора, взвешивая реакционную массу.
Для проведения реакций галогенирования хлор активируют фотохимически (при облучении светом с длиной волны около 360 нм), термически или каталитически.
В зависимости от условий и соотношения реагентов хлорирование может происходить с разной степенью глубины:
CH4 Cl2, hν CH3Cl Cl2, hν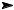 CH2Cl2 Cl2, hν
CH2Cl2 Cl2, hν
 CHCl3 Cl2, hν
CHCl3 Cl2, hν CCl4
CCl4
11
www.mitht.ru/e-library

При высоких температурах (свыше 400˚С) атака хлором происходит в соответствии с количеством атомов водорода в заместители, независимо от природы замещаемой группы:
|
Cl2, t |
|
|
|
CH3 |
|
|
|
CH |
|
CH3 |
|
CH3CH2CH3 |
|
CH3CH2CH2Cl |
|
|
|
|
|
|
|
|||
|
|
|
|
|
||||||||
|
(1) |
|
|
|
|
|
Cl (2) |
|||||
Соотношение продуктов (1):(2)= 3:1
При более низких температурах наиболее легко замещаются третичные атомы водорода, затем вторичные и, наконец, первичные. Соотношение скоростей замещения водорода на хлор в данном случае составляет 4,43:3,25:1,0 соответственно.
Затраты энергии на отрыв атома водорода представлены в табл. 2.
Табл.2. Энергия отрыва атомов водорода в алканах.
Атом водорода |
Е, ккал/моль |
первичный |
96 |
вторичный |
94 |
третичный |
89 |
2.1.1. Хлорирование алканов.
Происходит только по радикальному гомолитическому механизму:
Cl2 |
hν |
2 Cl |
|
|
|
|
|
||
Cl |
CH4 |
HCl |
CH3 |
|
CH |
Cl2 |
CH Cl |
Cl |
|
3 |
|
3 |
|
|
Cl |
CH Cl |
HCl |
CH2Cl |
и т.д. |
|
3 |
|
|
|
12
му механизму и проводятся в присутствии инициаторов цепных процессов (обычно пероксиды или УФ-облучение). Таким образом, функция N-бромсукцинимида сводится к обеспечению образования брома в низкой стационарной концентрации.
N-бромсукцинимид бромирует фенол в пара-положение, а хлорангидриды карбоновых кислот – избирательно в α- положение.
Комплексным соединением брома является диоксандибромид. 1,4-Диоксан – гигроскопическая жидкость, хорошо растворимая в воде и органических растворителях. С бромом, образует устойчивый кристаллический комплекс C4H8O2·Br2, являющийся удобным реагентом в реакциях бромирования:
O |
O |
Br2 |
. Br |
|
2 |
O |
O |
Этот электрофильный агент имеет большой объем, и атака орто-положения фенола делается маловероятной:
OH |
|
OH |
|
O |
|
|
. Br |
2 |
|
|
|
|
O |
|
Br
В тонком органическом синтезе для бромирования используют также и другие комплексные соединения брома и галогенированные амиды:
37
www.mitht.ru/e-library

При взаимодействии фосгена со спиртами образуются сложные эфиры двух типов – полные (карбонаты) и неполные (хлоругольные, или хлорформиаты), последние одновременно являются и сложными эфирами, и хлорангидридами.
7.ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, ИСПОЛЬЗУЕМЫЕ КАК МЯГКИЕ ГАЛОГЕНИРУЮЩИЕ РЕАГЕНТЫ.
Широко применяемым бромирующим агентом является N- бромсукцинимид:
O |
|
|
O |
|
NH |
Br2 |
NaOH |
N Br |
NaBr H2O |
|
||||
O |
|
|
O |
|
Этот реагент способен к селективному заместительному бромированию алкенов и алкилбензолов в аллильное и бензильное положения соответственно:
O
N Br |
Br |
O
В качестве реакционной среды обычно используют неполярные растворители (CCl4). Реакции протекают по радикально-
36
Препаративная ценность радикального цепного хлорирования ограничена, так как селективность реакции невелика, и во всех случаях образуется смесь моно- и полихлорзамещенных соединений. Для получения монозамещенных продуктов процесс приходится вести в избытке углеводорода при малой глубине превращения.
При наличии в молекуле алкана электроноакцепторной группы хлор стремится заместить наиболее удаленный от нее атом водорода:
CH3CH2CF3 Cl2, hν ClCH2CH2CF3 Cl2, hν
ClCH2CH2CF3 Cl2, hν Cl2CH2CH2CF3
Cl2CH2CH2CF3
Это объясняется электрофильностью радикала хлора.
2.1.2. Хлорирование олефинов.
Реакция протекает по типу электрофильного присоединения с образованием вицинальных дихлорпроизводных. Поскольку индуктивный +I эффект метильных групп повышает доступность электронов π-связи, с ростом их числа увеличивается скорость реакции присоединения хлора. Так, реакционная способность увеличивается в следующем ряду: этилен < пропилен < изобутилен < тетраметилэтилен. При температурах выше 300˚С олефины вступают с галогенами в реакции замещения с сохранением непредельной связи, так как продукт присоединения в данных условиях элиминируется с образованием двойной связи:
CH2 CH2 Cl2 |
300 o |
CH2 CH Cl HCl |
Гомологи этилена реагируют в аллильном положении:
CH2 CH CH3 |
Cl2 |
CH2 CH CH2Cl |
∆ |
Данная реакция используется в синтезе глицерина:
13
www.mitht.ru/e-library

CH2 |
|
CH |
|
CH2Cl |
|
1.CaO |
CH2 |
|
CH |
|
CH2OH |
HOCl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
2. H+ |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
CH2 |
|
|
CH |
|
|
CH2 |
CaO |
|
CH |
CH CH |
OH- |
||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|||
|
|
|
Cl |
OH |
OH |
|
|
|
|
O |
OH |
|
|
|||||||||
CH2 CH CH2
OH OH OH
Хлорирование алкенов по аллильному положению используют также в синтезе метилового эфира метакриловой кислоты:
CH |
C CH |
Cl |
CH2 |
C |
CH2 |
1.CaO |
2 |
|
|||||
3 |
2 |
|
|
|
|
2. H+ |
|
CH |
|
Cl |
CH3 |
||
|
3 |
|
|
|
|
|
|
CH2 |
C CH2 |
[O] |
O |
C C CH |
|
|
|
|
|
|
|
2 |
|
OH |
CH3 |
|
|
HO |
CH |
|
|
|
|
|
|
3 |
O C C CH2
H3CO CH3
2.1.3. Хлорирование алкинов.
Позволяет получать вицинальные дихлоралкены или тетрахлорзамещенные алкены:
|
|
|
|
|
|
100-170 o Cl |
H |
Cl2 |
|
|
Cl |
Cl |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
C C |
|
|
|
|
|
|
|
|
|
||||
HC |
|
CH |
|
|
|
Cl2 |
|
|
|
H |
|
C |
|
C |
|
H |
|||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
H |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
Cl |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
14 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
6.3. Фосген (COCl2).
Фосген представляет собой полный хлорангидрид угольной кислоты. Это низкокипящая жидкость (т.кип. 8.2˚С) с запахом прелого сена, очень ядовит (вызывает отек легких), образуется в качестве примеси при фотохимическом окислении хлороформа при его неправильном хранении.
В промышленности фосген получают радикальным хлорированием монооксида углерода в реакторе, заполненном активированным углем:
CO |
|
|
|
Cl2 |
hν |
COCl2 |
|
|
|
|
|||
Cl2 |
|
hν |
2 Cl |
|
||
|
|
|||||
Cl
 CO
CO  COCl
COCl
COCl
 Cl2
Cl2  COCl2
COCl2  Cl
Cl
В лаборатории фосген получают, прикапывая олеум к четыреххлористому углероду:
|
|
|
|
|
125 o |
|
|
|
O |
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CCl4 |
|
|
|
2 SO3 |
|
COCl2 |
|
|
|
Cl |
|
|
S |
|
O |
|
|
S |
|
Cl |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
||||||||
Примеры использования фосгена:
RNH2  COCl2
COCl2  RNHCOCl
RNHCOCl  HCl
HCl
C6H5CH2OH  COCl2
COCl2  C6H5CH2OCOCl
C6H5CH2OCOCl  HCl
HCl
R |
C |
O |
|
|
COCl |
|
|
R |
C |
O |
CO2 |
|||
OH |
|
|
Cl |
|||||||||||
|
|
|
2 |
|
|
|
|
|
|
|||||
CH2 |
|
CH2 |
|
|
|
COCl |
|
|
|
Cl |
CH |
CH |
C O |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
2 |
|
|
|
|
2 |
2 |
Cl |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
35 |
|
|
|
|
|
www.mitht.ru/e-library

Хлороксид фосфора используют для замещения карбонильной группы в амидах кислот:
CH3 |
CH |
|
3 |
|
POCl3 |
N O |
-HCl |
N Cl |
|
H |
H |
CH3 |
|
N
Карбоксильная и сульфогруппа обычно устойчивы к дейст-
вию POCl3:
HO C COOH |
POCl3 |
Cl C COOH |
|
Более реакционноспособными являются соли сульфокислот:
SO3Na |
SO2Cl |
|
POCl3 |
34
2.1.4. Взаимодействие хлора с ароматическими соединениями.
А) По радикальному механизму происходит присоединение хлора к незамещенному бензолу в довольно жестких условиях:
|
|
|
|
|
Cl |
|
|
Cl |
|
|
|
Cl, hν |
|
|
H |
Cl2, hν |
|
H |
Cl, hν |
|
|
|
|
|
|
|
|
Cl |
.......... |
|
|
|
|
|
|
|
|
H |
|
|
|
H |
H |
|
H |
Cl |
|
|
|
|
|
Cl |
Cl |
Cl |
H |
|
|
||
|
|
H |
H |
и другие изомеры |
|||||
|
|
|
|
||||||
|
Cl |
|
|
Cl |
Cl |
|
Cl |
||
|
H |
|
H |
|
|
||||
|
|
|
|
|
|
||||
Cl |
|
|
|
Cl Cl |
|
|
|
||
|
Cl |
H |
|
H |
|
|
|
||
|
|
H |
|
|
H |
|
|
|
|
Для алкилзамещенных бензолов гомолитическое хлорирование направлено в боковую цепь:
CH3 |
CH |
Cl |
CHCl2 |
CCl |
3 |
|
2 |
|
|
|
|
Cl2, hν |
|
Cl , hν |
|
Cl , hν |
|
|
|
2 |
|
2 |
|
Продукты гомолитического хлорирования толуола широко используются в качестве синтонов для синтеза лекарственных соединений. Кроме того, из бензилхлорида получают бензиловый спирт и цианистый бензил, из бензилидендихлорида – бензойный альдегид, из бензотрихлорида – бензоилхлорид.
Б) Замещение в ароматическое кольцо протекает по электрофильному механизму.
15
www.mitht.ru/e-library
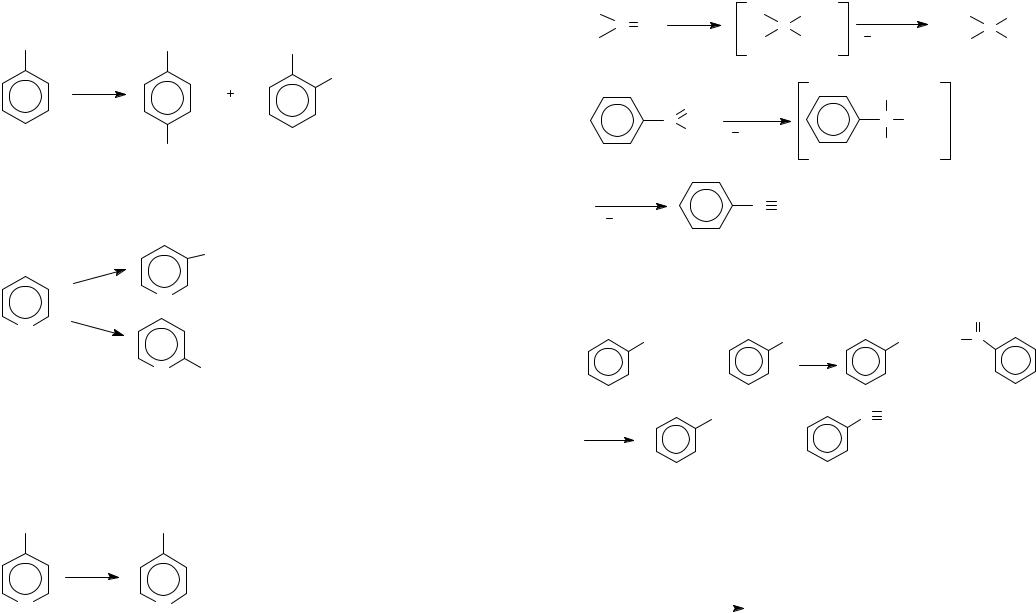
Преимущественно атака идет по пара-положению:
CH3 |
CH |
CH |
|
3 |
|
|
|
3 |
|
Cl2 |
Cl |
|
|
|
|
AlCl3 |
|
|
Cl 70% |
30% |
2.1.5. Взаимодействие хлора с гетероароматическими соединениями.
Cl2 |
Cl |
|
|
200 o |
N |
Cl2 |
|
N |
|
400 o |
|
|
N Cl |
Такая ориентация при введении хлора связана с тем, что в пиридине в α- и γ-положениях относительно атома азота электронная плотность ниже, чем в β-положении.
При наличии в пиридине алкильного заместителя хлорирование направлено в боковую цепь:
CH3 |
CCl3 |
|
Cl2 |
N |
N |
16
R1 |
|
|
PCl |
R1 |
|
OPCl4 |
|
R |
1 |
Cl |
R2 |
C |
O |
5 |
|
C |
|
POCl3 |
|
C Cl |
|
|
R2 |
Cl |
R2 |
|||||||
|
|
|
O |
PCl5 |
|
|
Cl |
|
|
|
|
|
|
|
|
C NH2 |
|
|
|
||
|
|
|
C |
POCl3 |
|
|
|
|
||
|
|
|
NH |
|
|
|
|
|
||
|
|
|
2 |
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C N
2HCl
Реакция Брауна – превращение аминов в галогениды действием PCl5 или PBr5 на бензоильные производные первичных и вторичных аминов:
|
|
O |
(CH2)4NH2 |
COCl |
(CH2)4NH С |
+ |
|
|
1) PBr5 |
(CH2)4Br |
C N |
+ |
|
|
2) ∆ |
|
|
|
|
6.2. Галогеноксиды фосфора (POX3).
Чаще всего используют хлороксид фосфора (POCl3), получаемый по реакции:
PCl5 |
|
|
|
H2O |
|
POCl3 |
|
|
2 HCl |
|
|
|
|
|
|
||||
|
|
|
|
|
|
33
www.mitht.ru/e-library

2 P |
|
|
|
3 X2 |
|
2 PX3 |
2 X2 |
2 PX5 |
|
|
|
|
|
||||
|
|
|
|
|
|
(ж.) |
|
(тв.) |
X = Cl, Br
PBr3 можно использовать как в готовом виде, так и получать непосредственно в реакционной смеси (in situ) из брома и красного фосфора.
PI3 - неустойчив, его готовят непосредственно перед использованием и не перегоняют; или используют в момент выделения, вводя в реакцию смесь йода и красного фосфора. PCl3 находит ограниченное применение из-за низкой нуклеофильности хлорид-аниона. Более активным хлорирующим агентом является PCl5, однако при этом может происходить окисление спиртов свободным хлором, образующимся из PCl5 при повышенной температуре:
PCl5  PCl3 + Cl2
PCl3 + Cl2
Примеры использования:
3 ROH |
|
|
|
|
|
PCl3 |
|
|
|
|
|
|
|
|
|
|
|
3 RCl |
|
|
H3PO3 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
3 RCH |
COOH |
|
|
|
|
PCl |
|
|
|
|
|
|
|
|
3 RCH |
COCl |
|
|
|
H3PO3 |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
3 CH3 |
|
CH(CH2)3CH3 |
|
|
|
|
PI3 |
|
|
|
|
3 CH3 |
|
CH(CH2)3CH3 |
|
|
|
H3PO3 |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
OH |
|
|
|
|
|
|
|
|
|
∆ |
|
|
|
|
|
|
|
|
|
|
|
I |
||||||||||||||||||||||
ROH |
|
|
|
|
|
|
|
P |
|
|
|
|
I |
|
|
|
|
|
|
|
|
RI |
|
|
|
|
H3PO4 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
PX5 используют для замещения карбонильной группы в альдегидах, кетонах, амидах с получением гем-дихлорпроизводных:
32
Пятичленные гетероциклы обладают повышенной реакционной способностью по отношению к хлору:
|
|
|
|
|
Cl |
|
Cl |
|
Cl |
|
|
|
Cl2 |
|
|
|
2 |
|
|
|
|
|
|
N |
0 o |
Cl |
N |
Cl |
Cl |
N |
Cl |
H |
|
|
H |
|
|
H |
|
|
|
|
|
|
|
Cl |
H Cl |
|
Cl2 |
|
|
|
Cl2 |
H |
|
|
|
|
|
H |
H |
||
S |
|
Cl |
S |
Cl |
|
Cl |
S Cl |
2.1.6. Взаимодействие хлора со спиртами.
С метанолом и третичными спиртами реакция не идет. С высшими спиртами образуются алкилгипогалогениты:
ROH |
|
|
|
Cl2 |
|
R |
|
O |
|
Cl |
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
2.1.7. Хлорирование альдегидов и кетонов.
Осуществляется в α-положение по отношению к карбонильной группе:
|
|
CH |
|
C |
|
R |
Cl2 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
C |
|
C |
|
R |
||||||||||||
|
|
|
|
H+или OH- |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
Cl O |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
В случае несимметричных кетонов галогенированию в первую очередь подвергается группа CH, затем СН2 и в последнюю очередь СН3; при этом обычно получают смесь продуктов. В альдегидах иногда замещается атом водорода в альдегидной группе.
17
www.mitht.ru/e-library

В условиях основного катализа одно α-положение в кетоне галогенируется полностью, т.е., все атомы водорода при α- углеродном атоме замещаются на галоген. Если одной из групп является метильная, имеет место галоформная реакция:
|
|
O |
Cl2 |
|
|
OH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH3 |
C |
|
|
Cl3C |
|
C |
|
R |
|
|
|
|
|
|
||
OH- |
|
|
|
|
|
|
|
|||||||||
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O- |
|||||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
Cl C |
RCOOH |
|
|
|
|
Cl3CH |
|
|
|
RCOO- |
||||
|
|
|
|
|
|
|
|
|
||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В условиях кислотного катализа реакцию легко остановить после замещения первого атома водорода на хлор. Галоформная реакция используется для качественного определения метилкетонов, для получения иодо- и бромоформа, карбоновых кислот.
2.1.8. Хлорирование карбоновых кислот.
Данная реакция протекает трудно. В условиях свободнорадикальных реакций, так как хлор-радикал представляет собой электрофильный агент, преимущественно атакуется β- углеродный атом:
CH CH |
2 |
|
COOH |
Cl2, hν |
CH2 |
|
CH2 |
|
COOH |
||
|
|
|
|||||||||
|
|
|
|||||||||
3 |
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||||
|
|
|
|
|
|
||||||
Для хлорирования карбоновых кислот в α-положение к карбонильной группе реакцию проводят в основной среде в присутствии йода и красного фосфора. Фактически, в реакцию вступает не сама кислота, а ее галогенангидрид, который затем гидролизуется:
R |
|
CH CH |
COOH |
Cl2 |
R |
|
CH2 |
|
CH |
|
COOH |
||
|
|
|
|
||||||||||
|
|
||||||||||||
2 |
2 |
|
P, I2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Cl |
||||
|
|
|
|
|
|
|
|
|
|
||||
18
Сульфурилхлорид – наиболее часто используемый реагент для радикального хлорирования, который даже при обычном освещении или слабом нагревании (в отличие от молекулярного хлора) распадается на радикалы:
SO2Cl2 |
|
SO2Cl |
Cl |
||
RH |
Cl |
a |
R |
HCl |
|
R |
SO2Cl2 |
RCl |
SO2Cl |
||
|
|||||
b
RSO2Cl  Cl
Cl
Направление реакции (а) или (b) зависит от условий реакции и от структуры R: при слабом нагревании – (а), при более сильном – (b).
O |
SO2Cl2 |
O |
C6H5CH2C |
|
C6H5CH C |
CH3 |
|
CH3 |
|
|
Cl |
6. ИСПОЛЬЗОВАНИЕ ФОСФОРСОДЕРЖАЩИХ ГАЛОГЕНИДОВ.
6.1. Фосфоргалогениды (PX3, PX5).
Удобным методом синтеза галогенпроизводных из спиртов и кислот является использование галогенидов фосфора (PI3, PBr3, PCl3, PCl5). Основное достоинство этого метода заключается в образовании значительно меньшего количества побочных продуктов (алкенов и продуктов перегруппировок).
Галогениды фосфора получают взаимодействием галогенов с красным фосфором:
31
www.mitht.ru/e-library

|
SOCl2 |
O |
|
|
O |
|
|
|
|
ROH |
R |
S O |
R |
S O |
RCl |
SO2 |
|||
HCl |
|
||||||||
Cl |
Cl |
|
|
||||||
|
|
|
|
|
|
|
Эту реакцию часто используют в тонком органическом синтезе для получения алкилхлоридов и хлорангидридов кислот (гораздо более реакционноспособных, чем сами кислоты), в том числе и в синтезе лекарственных веществ:
C6H5CH OH |
SOCl2 C H CH |
Cl |
HCl |
SO |
2 |
||
C2H5 |
6 |
5 |
C |
H |
|
||
|
|
|
2 |
|
5 |
|
|
Cl |
|
|
Cl |
|
|
|
|
|
SOCl2 |
|
|
|
HCl |
SO2 |
|
OCH2COOH |
|
|
OCH2COCl |
|
|
||
Применение хлористого тионила как хлорирующего агента удобно тем, что в качестве побочных продуктов образуются газообразные вещества (SO2 и HCl). Выделение хлорсодержащего продукта, таким образом, сводится к отгонке избытка хлористого тионила и растворителя.
Аналогичным образом реагируют SOBr2 и SOF2, которые получают обменными реакциями хлористого тионила с бромистым или фтористым калием.
5.2. Сульфурилхлорид (SO2Cl2).
Сульфурилхлорид получают в промышленности:
SO2 |
|
|
|
Cl2 |
hν |
SO2Cl2 |
|
|
|
|
|||
|
|
|
|
|
|
30 |
2.2. Бромирование.
Бром – это темно-коричневая жидкость с плотностью 3.12 г/мл (т.пл. 57˚С, т.кип. 59˚С). Его легко дозировать при проведении реакций. Однако, бром дороже хлора, и его чаще используют в лаборатории, чем в промышленности. Бром менее активен, чем хлор, но более селективен в радикальных реакциях и в реакциях электрофильного замещения. Реакции с молекулярным бромом аналогичны реакциям хлорирования, но поскольку атом брома имеет больший диаметр, наблюдаются и различия.
2.2.1. Присоединение молекулярного брома по кратным связям.
При наличии 1-2 заместителей при кратной связи идет присоединение брома:
|
|
|
|
|
Br2 |
|
|
|
Br |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
C |
|
COOH |
HC |
|
C |
|
COOH |
|||
|
|
|
|
|||||||||
|
|
|
|
|
||||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
||||||
При большем числе заместителей присоединения галогена по двойной связи не происходит:
19
www.mitht.ru/e-library

|
Br |
Br |
|
C C |
Br2 |
C C |
|
Br |
|||
|
Br |
Cl2
Cl
C C
Cl
2.2.2. Реакции замещения.
Замещение водорода в алкилароматических соединениях в реакциях с молекулярным бромом протекает аналогично хлорированию:
CH3 |
CH2Br |
Br2
hν
Вотличие от реакции с Cl2, скорость замещения второго атома водорода на бром гораздо ниже, а трибромметилбензол вообще не образуется.
Впромышленности при бромировании (чаще, чем при хлорировании) используют, так называемое, окислительное галоге-
20
Реакция галогеноводородов с циклическими эфирами часто используется для получения многофункциональных соединений:
O |
|
|
|
|
HBr |
|
|
|
CH2 |
|
|
|
CH2 |
|
Br |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
HCl |
|
|
|
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
Cl |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
O |
|
|
|
|
|
|
OH |
||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
5. ИСПОЛЬЗОВАНИЕ СЕРОСОДЕРЖАЩИХ ГАЛОГЕНИДОВ.
5.1. Тионилхлорид (SOCl2).
Тионилхлорид получают в реакциях: Лабораторный метод:
SO2 |
|
|
|
PCl5 |
|
|
SOCl2 |
|
|
POCl3 |
||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
Промышленный метод: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
SO |
3 |
|
|
|
|
|
S Cl |
|
|
SOCl |
2 |
|
|
|
|
SO2 |
|
|
|
S |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Тионилхлорид используют для взаимодействия с гидроксилсодержащими соединениями. Реакции протекают по механизму внутримолекулярного нуклеофильного замещения SNi: сначала образуется алкилсульфит, затем из алкилсульфита образуется внутренняя ионная пара; вторая стадия протекает внутримолекулярно с сохранением исходной конфигурации:
29
www.mitht.ru/e-library
