
- •Анықтамалар
- •Нормалық сілтемелер
- •1 Әдеби шолу
- •1.1 Zygophyllacae (парнолистник) тұқымдасты Zygophyllum (парнолистник) тектес өсімдігі туралы жалпы мағлұмат.
- •1:5 Немесе 1:10 су-метанол; су-этанол
- •Флавоноидтар мен сапониндердің хроматографиялық әдістері
- •2.Зерттеу нәтижелері мен оларды талқылау
- •2.1 Шикізат сапалығын анықтау
- •2.2 Хлороформды экстракттағы заттарды анықтау
- •2.2.1 Май қышқылының сандық талдауы
- •2.3 Этилацетатты экстракттағы заттарды анықтау
- •2.4 Бутанолды экстрактағы заттарды анықтау
- •2.5 Сулы қалдық құрамындағы заттарды анықтау
- •2.5.1 Амин қышқылдарының сандық анықталуы
- •3.Тәжірибелік бөлім
- •3.1 Әдістер мен материалдар
- •3.2 Сапалық сараптама жүргізуге арналған әдістемелер
- •3.2.1 Ылғалдылықты анықтау
- •3.2.3 Экстрактивті заттарды анықтау
- •3.2.4 Шикізaттың құрамынан микроэлементтерді aнықтау
- •3.3 Сандық анализ жүргізуге арналған әдістемелер
- •3.3.1 Май қышқылдарының сандық анализі
- •Қорытынды
- •Қолданылған әдебиеттер
- •Ниғметова Әсемгүл
- •Реферат
Флавоноидтар мен сапониндердің хроматографиялық әдістері
Белгілі бір еріткіштер жүйесінде арнайы айқындағыштар (УК - жарық, аммиак буы, ЖАК) қолданылуы арқылы екі жүйелі қағазды хроматография әдісі агликондар мен гликозидтерді ажыратуға, вициналды гидроксилді топтарды (ЖАК-пен жасыл-көк түс) айқындауға мүмкіндік береді. Жеке қосылыстарды идентификациялау үшін қағазды хроматографиямен қатар жұқа қабатты хроматографиясыда қолданылады.
Қағазды хроматографияның ерекшелігі: көрінетін ультракүлгін жарықта көптеген қосылыстардың табиғи бояуы, оңай біліну флаваноидты қосылыстарды қағазда жеңіл тануға мүмкіндік береді. Басқа тәсілмен салыстырғанда бұл әдістің артықшылығы және оны ауыстыруға болмайтындығы, оның оңайлығында және басқа заттардың микрошамалы заттармен жұмыс істеу мүмкіндігінде [34].
Қолданатын заттың хроматограммасы Rf шамасымен анықталады. Бұл шама зерттелетін заттың жүрген жолының, еріткіш фронты өткен жолының қатынасына тең. Флаваноид құрылысын Rf шамасының өзгеру шамасы бойынша жорамалдауға болады. Әртүрлі флаваноидтық қосылыстардың спирттегі еріткіштердің сулы жүйесіндегі байқалған заңдылықтары мынадай:
Спиртті жүйеде флаваноидтарға гликозидтерінің мәні оған сәйкес болатын агликондар мәнінен төмен. Сулы жүйеде керісінше, яғни гликозидтердің мәндері олардың олардың агликондарына қарағанда жоғары.
Молекуладағы гликозидтің қант компонентінің өсу саны еріткіштің спирттік жүйедегі Rf мәнін кемітеді, ал сулы жүйеде өсіреді.
Гидроксил топтарының өсу саны спирттік және сулы жүйеде Rf мәнін кемітеді.
Гидроксил топтарының метокси топқа алмасуы спирттік Rf мәнін өсіреді, ал сулы жүйеде Rf мәнін кемітеді [35].
Жұқа қабатты хроматография флавоноидтардың күрделі қоспаларын бөлудің нақты әдістерінің бірі. Жұқа қабатты хроматографияны бөлуде полиамид ең көп қолданылады, және де келесі заңдылықтар қарастырылады:
Флавоноидты гликозидтер агликондарға қарағанда күштірек сорбцияланады;
Агликондардың сорбциялық белсенділігі гидроксилді топтардың санына ғана емес, олардың орналасуына да байланысты болады. 3-ОН тобы 5-ОН тобына қарағанда сорбциялануға белсендірек. –ОН тобының сорбциялық белсенділігіне байланысты мынадай қатар құруға болады: 3-OH < 3'-OH, (5'-OH) <5-OH<4'-OH <7-OH
Гликозидтер мен полярлы агликондарды бөлу үшін метанол-сірке қышқылы-су (18:1:1), су-бутанол-метанол (70:15:10) еріткіштер жүйесі сәйкес келеді. Полярсыз жоғары метоксилденген полиамидті жазықтықта агликондарды препараттық бөлуде еріткіштер жүйесі ретінде толуол-бензол- метанол (30:90:1,5) қолданылады.
Изофлавоноидтарды анықтау үшін еріткіштер жүйесі ретінде қолданылады: Na2CO3 –СН3СООН-HCI- Н2О (3:6:1:1), изопропанол-су (3:2; 22-78; 1:3), сірке қышқылы-су (10-60%). Метокси тобы көп кездесетін кейбір изофлавондар үшін полярсыз еріткіштер жүйесі қолданылады: бензол-лигроин-метанол-су (50:50:1:50), хлороформ- лигроин-метанол-су (2:1:7:5).
Зерттелетін шикізатта флавоноидтарды алдын-ала анықтау үшін түсті реакциялар қолданылады.
Полифенолды қосылыстар комплекс түзуші және диазоттау реакциясына түседі. 1%-ды алюминий хлоридімен реакциясы
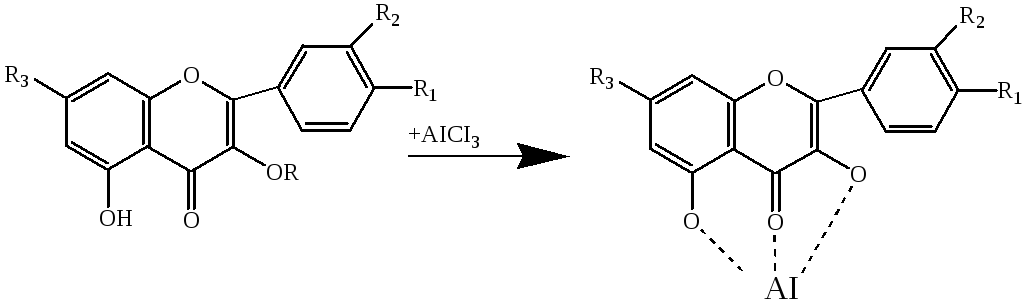

Флавондарды, халкондарды, изофлавондарды және аурондарды анықтауға мүмкіндік береді; флавондар сары түске, халкондар қызыл түске, изофлавондар қоңыр-сары түске, ал аурондар қызғылт-сары түске боялады. Флаваноидтардың аммиак буында айқындалуы арнайы сапалық реакция емес, көрсеткіш реакция болады, себебі, кумариндер, антрахинондар және т.б. карбонилді қосылыстар айқындалады. Флаваноидтарға арнайы сапалық реакция «антоциоанды сынама» болады – тұз қышқылы қатысындағы магниймен тотықсыздану реакциясы, бұл кезде қызғылт-сарыдан шие-қызыл түске дейін боялған флавил тұздары – антоцианиндер түзіледі [36].

Сапониндердің жалпы санын тазалаудың кеңінен таралғаны – хроматографиялық әдістер. Құрамында карбоксилді топтары бар гликозид ілеспелі заттардан, сонымен бірге минералды қоспалардан ионалмастырғыш хроматография арқылы бөле алады. Сапониндердің жалпы санын хроматографиялық тазалауды алюминий оксидінде, силикагельде, белсендірілген көмірде жүргізеді.
Табиғи қосылыстардың (амин қышқылдары, көмірсулар және т.б.) басқа да кластарынан сапониндер үшін ерекшелігі элюирлеудің әмбебап жүйесі жоқ. Бейтарап сапониндер үшін көбірек келетін жүйелер:
н-бутил спирті – этил спирті – су;
н-бутил спирті – сірке қышқылы – су (әртүрлі қатынастарда, жоғары қабат);
хлороформ – метил спирті – су (65:35:10).
Хроматограммаларда өңдеу үшін сапониндердің түсті реакцияларын жүргізгендегі реактивтерді қолдануға болады. Осылайшы, стероидты сапониндерді анықтау үшін хроматограмманы бірінші 1%-ды SbCl3 спиртті ерітіндісімен өңдейді, сосын кепкеннен кейін Н2SО4-ын сірке ангидридімен сары дақтар түзеді.
Тритерпенді сапониндерді анықтау үшін 20%-ды Н2SО4 ерітіндісін қолданады. Хроматограмманы осы ерітіндімен өңдеген соң t=115-1200С температурада 15 минут бойы қыздырғанда күлгін дақтар пайда болады. Сонымен бірге SbCl3-ті SbCl5 іздерімен қаныққан хлороформ ерітінділерін қолдануға болады, ол тритерпенді сапониндерде қызғылт-күлгін түсті береді.
Басқа да гликозидтер сияқты сапониндер құрылысын анықтауда агликон мен көмірсу бөліктерінің құрылысы, сонымен қатар көмірсу жасаушысының агликонға қосылу тәсілімен орны анықталды [37].
Жұқа қабатт хроматография. Сулы немесе спиртті сығындысымен силикагельде немесе алюминий оксидінде сәйкес ерітінділер жүйесінде хроматографиялайды. Бейтарап сапониндерге жиі н-бутанол-сірке қышқылы-су, қышқыл сапониндерге н-бутанол-әр түрлі қатынастағы сулы аммиакты қолданады. Жүйені тәжірибе жүзінде алады. Сапониндерді хроматограммада әртүрлі қышқыл реагенттерді концентрлі күкірт қышқылы, сірке қышқылы, сірке ангидриді, 25% фосфорлы молибден қышқылының ерітіндісі, үшхлорлы сүрме (сурьма) және тағы басқаларды кобальт хлоридінің, ванилиннің, пара-диметиламин-бензальдегид және т.б. қатысында сепкенде анықталады.
Тритерпенді сапониндер қызғылт немесе қоңыр-күлгін дақтар түрінде түседі.
Стероидты сапониндер хроматограммада 1% үшхлорлы сүрме ерітіндісі, концентрлі күкірт қышқылы және сірке ангидридімен сары (спиростанды) дақтар (Санье реакциясы) береді. Қазіргі кезде шикізатта сапониндердің бар болуын ең нақты – хроматографиялық әдіс көрсетеді.
Өсімдік шикізатында сапониндерді анықтау үшін қолданылатын реакцияларды үш топқа бөлуге болады:
сапониндердің физикалық қасиеттеріне негізделген реакциялар;
сапониндердің химиялық қасиеттеріне негізделген реакциялар;
сапониндердің биологиялық қасиеттеріне негізделген реакциялар.
Бірінші реакциялар тобына көбік түзу реакциясын (сынама) жатқызуға болады. Бұл тек сезімтал сынама болып қана қоймай, сонымен бірге өздеріне тән қасиет болып келеді, өйткені өсімдіктерде мұндай көбік түзуге қабілеті бар заттар кездеспейді.
Сапалық реакциялардың екінші тобына сапониндердің тұндыру және түсті реакцияларды жатқызуға болады.
Сапониндер сулы ерітінділерден барий, магний гидроксидтерімен темір тұздармен, қорғасын ацетатымен тұнбаға түседі. Сонымен қатар тритерпенді сапониндер – орташа, ал стероидты – негізгі қорғасын ацетатымен тұнады.
Спиртті сығындыдан (ерітіндіден) стероидты және тритерпенді сапониндер холестериннің холестеридтер түріндегі спирттік ерітіндісін қосқанда тұнбаға түседі.
Жүректі гликозидтерге тән стероидты сапониндер Либерман – Бурхард реакциясын береді.
Сапониндердің сапалық реакциясы үшін, сыйымдылығы 100 мл-лік колбаға 1 г өсімдік шикізатын салады да, үстіне 1 мл су құйып, кері тоңазытқышқа жалғап, сулы моншада 10 минут қыздырады. Колба суғаннан кейін ерітіндіні сүзіп алып, қыздырады. Ар қарай сапалық реакцияларды жасауға пайдаланылады.
Көбіктүзілу (беру) реакциясы. Екі сынауық алып, біреуіне 5 мл 0,1 н НСl, ал екіншісіне 5 мл 0,1 н NaOH құяды. Әрқайсысына 2-3 тамшы сығынды (алынған экстракт) қосып, қатты шайқайды. Өсімдік құрамында тритерпенді сапониндер бар екенін екі сынауықта да көлемді және тұрақты көбіктердің түзілгенінен байқауға болады. Егер өсімдік құрамында стероидты тобы бар сапониндер болатын болса, онда оны сілтілік ортада түзілген көбіктердің көлемі мен тұрақтылығы жағынан бірнеше есе көптігінен ажыратуға болады.
Лафон реакциясы. 2 мл сулы сығындыға 1 мл концентрлі күкірт қышқылын, 1 мл этил спиртін және 1 тамшы 10%-ды темір сульфатының ерітіндісін қосып, қыздырады. Қыздырған кезде көк-жасыл түс пайда болады.
Либерман-Бурхард реакциясы. Бұл реакцияны жүргізу үшін зерттелетін затты сірке қышқылында (леденая) ерітеді де, үстіне сірке ангидриді және концентрлі күкірт қышқылының қоспасын (50:1) қосады. Бірнеше уақыттан кейін қызғылт түстен жасыл және көк түске дейін өзгереді.
Эритроциттердің гемолизі. 1 мл изотоникалық ерітіндінің тұндырындысына 1 мл 2% эритроциттердің өлшендісін қосады. Қан мөлдір, ашық қызыл түс береді (гемолиз) [38].
