
Некоторые следствия из Второго Закона Термодинамики и их практическое применение для экономии энергоресурсов в химической технологии
Лейтес Иосиф Лазаревич.
Член Межправительственной Комиссии при ООН по изменению климата
(Leading author of IPCC –International Panel on Climate Change)
Россия, Москва, 109651, Донецкая ул., дом 12, кв. 84. Тел.:8 (095) 357 70 16, 8 (916) 638 79 24 (моб.) e-mail: leites@rol.ru
-
Введение.
Ниже приведены без доказательства некоторые известные следствия из Второго Закона Термодинамики, наиболее важные для решения задачи экономии энергоресурсов.
-
Энергозатраты ( точнее потери эксергии) могут быть минимальными, а в пределе равными нулю в термодинамически обратимых, или, что то же самое, квазистатических процессах, то есть в процессах, протекающих в пределе с нулевой движущей силой на всем их протяжении. Это условие является необходимым, но недостаточным. На анализе таких процессов основан так называемый квазистатический метод, подробно рассмотренный в автором в книге «Второй Закон и его 12 заповедей» [1].
-
Достаточным условием является не простое уменьшение движущей силы, а проведение процесса с получением максимальной полезной работы. Это возможно при проведении процесса при противодействии. В противном случае уменьшение движущей силы приводит лишь к увеличению габаритов аппаратов. В дальнейшем это положение названо принцип противодействия, который рассмотрен и в этом докладе..
-
В
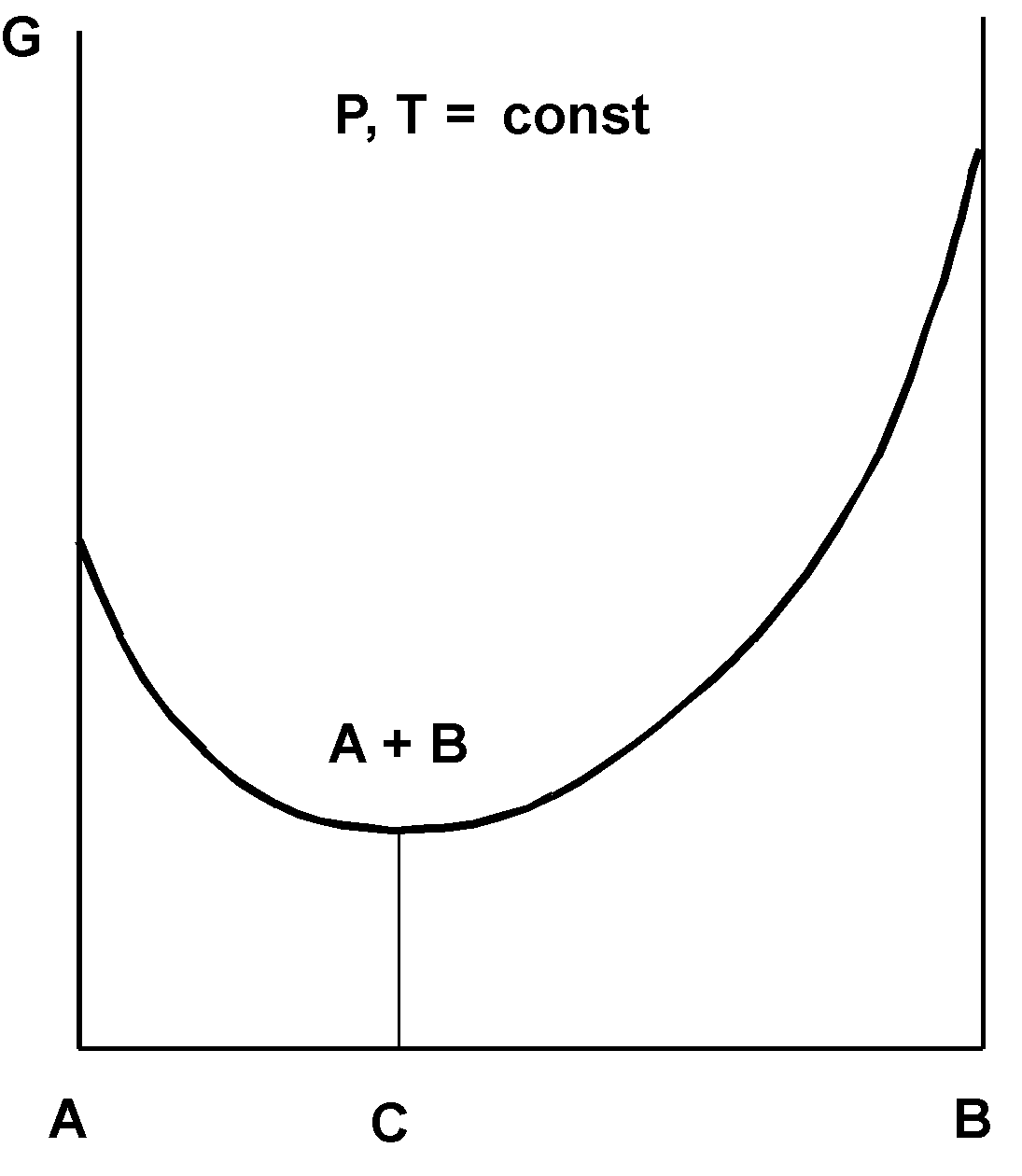
Рис. 1. Изменение энергии Гиббса G при протекании химически обратимой реакции. A, В – исходные компоненты, C – равновесная смесь.
се самопроизвольные химические процессы протекают в направлении уменьшения энергии Гиббса G (изобарно-изотермического потенциала [2](см. рис. 1). Если это изменение энергии Гиббса удаётся хотя бы частично рационально использовать для получения полезной работы, то процесс соответственно приближается к термодинамически обратимому. Но разность между энергией Гиббса в данном состоянии Gi и при равновесии G*
G = Gi – G* (1)
есть обобщенная движущая сила процесса (в частных случаях это может быть парциальное давление, концентрация компонента и т.д.). Следовательно, как указано выше, для экономии энергоресурсов следует вести процесс при минимальной разности энергий Гиббса в каждой точке аппарата. На анализе движущих сил основан так называемый метод движущих сил, целью которого, как и других указанных выше методов является снижение энергозатрат. Примеры его практического применения также рассмотрены в книге [1].
-
Некоторые характерные ошибки химиков-технологов.
-
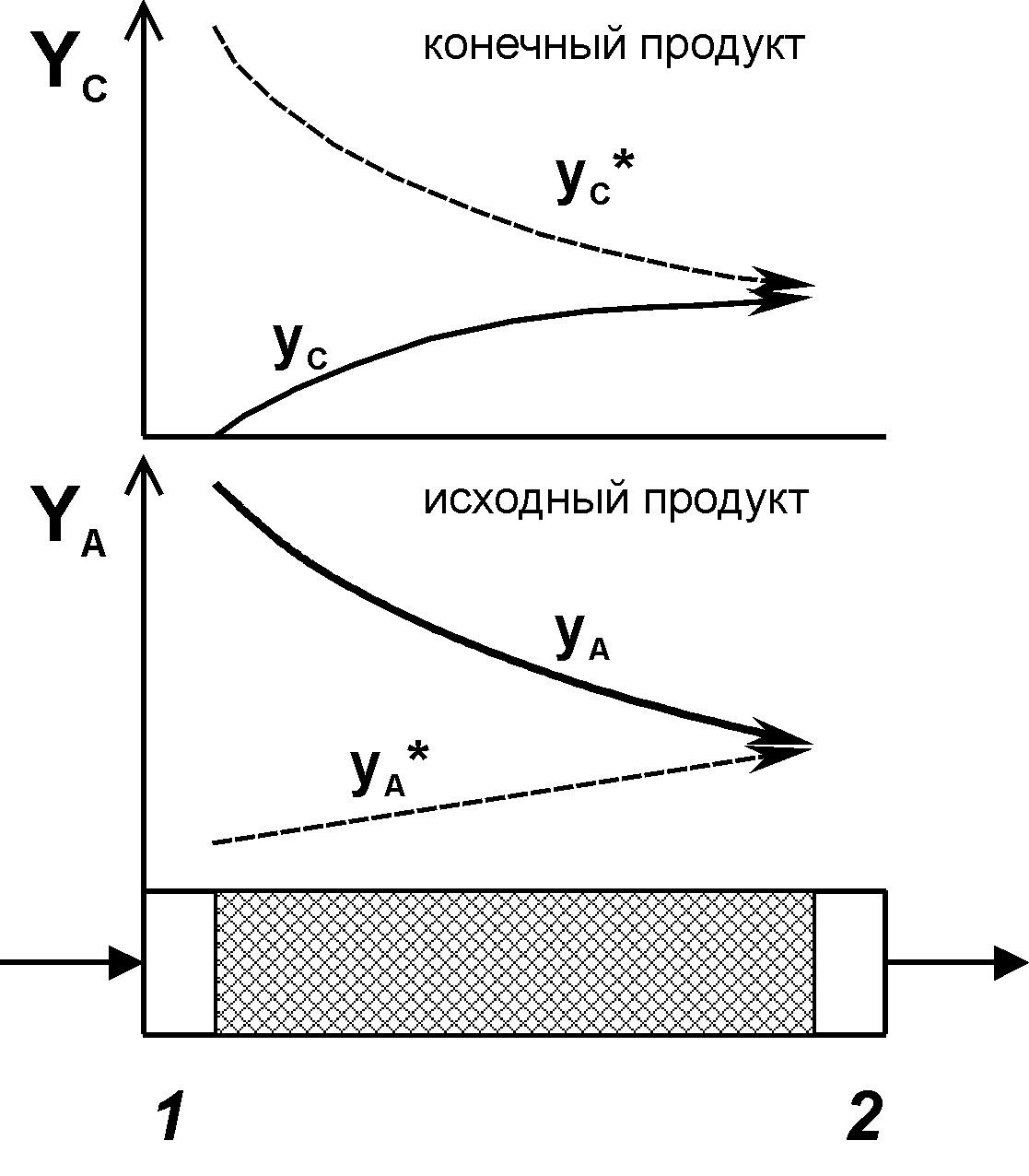
В тех процессах, в которых ставится задача достигнуть равновесия на выходе из аппарата, (см, например, рис. 2 и рис. 3) разработчики удовлетворены тем, что их катализатор (абсорбер и т.д.) позволяет решить эту задачу. При этом чаще всего забывают о том, что движущая сила на входе в реактор (рис. 2) или в его средней части (рис. 3) весьма велика. Следовательно, велика термодинамическая необратимость процесса и, соответственно, велики нерациональные потери энергии Гиббса и связанные с ними потери эксергии. Действительно, основное уравнение для эксергии Ех:
-
Ex = H – T0S . (2)
В
Рис.
2. Классический
пример термодинамически необратимого
пути протекания обратимой химической
реакции, т.е. при больших потерях
энергии Гиббса. yА
– концентрация исходного реагента
А;
yА*
– равновесная концентрация реагента
А;
yС
– концентрация конечного продукта
С;
yС*
– равновесная концентрация продукта
С;
1
– вход реагентов; 2
– выход реагентов.
Рис.
3. Зависимость
рабочей (1)
и равновесной (2)
концентрации СО2
в очищаемом газе от степени карбонизации
Х,
моль СО2/моль
МЭА, при абсорбции СО2
под давлением раствором МЭА концентрацией
20%.

Сравним это уравнение с уравнением для энергии Гиббса (изобарно-изотермического потенциала) [2, 3]:
G = H – TS . (3)
Сравнение уравнений (2) и (3) показывает, что энергия Гиббса – это максимальная полезная работа при заданных параметрах процесса, в частности, температуре Т и давлении Р, а эксергия – это работа с учетом результатов термодинамически обратимого взаимодействия с окружающей природной средой, имеющей, в частности, температуру Т0. Поэтому целесообразно выразить эксергию через энергию Гиббса [3, 4]:
Ex = G + (T – T0)S . (4)
И затем, пользуясь уравнением
G = –ST + VP (5)
и связью энтропии и частной производной от энергии Гиббса по температуре:
![]() , (6)
, (6)
можно исключить энтропию:
![]() ,
или
,
или
![]() . (7)
. (7)
Из уравнения (7) следует, что изменение эксергии в ходе реакции может быть и больше и меньше, чем изменение энергии Гиббса в зависимости от того, как отличается температура Т реакции от температуры Т0 окружающей среды и от знака производной (G/T)P. Соответственно, и эксергия, которая может быть нами получена в ходе реакции и полезно использована, может быть и больше, и меньше убыли энергии Гиббса.
Широко распространённое заблуждение о «неизбежности» потерь от термодинамической обратимости химических реакций является следствием непонимания сути проблемы и неумения находить инженерные методы её решения. К тому же создатели массообменной аппаратуры довольны – чем больше движущая сила, тем меньше число теоретических тарелок и меньше высота аппарата.
-
П

Рис. 4. Традиционная задача оптимальной поверхности теплообменника. 1 – денежные затраты на энергию; 2– денежные затраты на теплообменник с учетом срока службы; 3 – сумма затрат.

Рис. 5. Температуры потоков при теплообмене. а – G(1-3)·c(1-3)= G(2-4)·c(2-4). Равномерная движущая сила. б – G(1-3)·c(1-3) < G(2-4)·c(2-4). Неравномерная движущая сила. в – G(1-3)·c(1-3) > G(2-4)·c(2-4). Неравномерная движущая сила.
оскольку нулевая движущая сила является недостижимым идеалом для энергетика и преступным для экономиста в связи с необходимостью бесконечно больших капитальных затрат, дальнейший путь проектировщика сводится в лучшем случае к важной, но тривиальной задаче – к оптимизации по минимуму денежных затрат, см, например, рис. 4.
Однако, слишком часто забывают важное требование – движущая сила должна быть равномерной. Это позволяет при одинаковой поверхности тепло- или массообмена уменьшить энергетические затраты либо при одинаковых энергозатратах снизить капитальные затраты. Один из случаев сильно неравномерной движущей силы при прямоточном химическом процессе уже показан на рис. 2. Рассмотрим другой, весьма распространённый случай – рекуперация тепла горячего потока при нагревании другого потока с более высокой теплоёмкостью (или большего количества нагреваемого потока). Этот случай показан на рис. 5в. На холодном конце теплообменника разность температур в точках 4 и 1 близка к нулю и так называемые «потери» тепла близки к нулю. Однако из-за существенно более низкой температуры в точке 3 по сравнению с температурой в точке 2 потери эксергии велики.
Нетрудно показать, что потери эксергии тепла при теплообмене Еx равны:
 ,
где
,
где
![]() . (8)
. (8)
Из уравнения (8) видно, что если G2C2-4 = G3C1-3,(равномерная движущая сила, рис. 5а), то потери эксергии меньше, чем при неравномерной движущей силе (5б,в).
Что касается поверхности теплообмена, то достаточно вспомнить, что при равномерной движущей силе средняя ее величина равна средней арифметической величине, которая всегда выше средней логарифмической величине, которую необходимо использовать при неравномерной движущей силе. В итоге в первом случае можно сэкономить не только в энергетических затратах, но и на поверхности теплообмена.
