
Вьюник. Лекция № 5
.pdf
Передумови створення ТБА Електрон Модель атома Резерфорда Теорiя Бора
Теорiя Бора
Постулати Бора
Для визначення швидкостi e¯та радiуса кругової орбiти Бор
приєднав ще одну умову: центробiжну силу |
mv |
2 |
прирiв- |
|||||||
r |
|
|||||||||
няв центрострiмкiй |
eǫ |
силi притягання e¯ до ядра: |
||||||||
r2 |
||||||||||
mv2 |
= |
eε |
|
(2) |
|
|
|
|
|
|
|
r |
r2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
Потiм Бор звiв до квадрата рiвняння (1) i виключив v iз рiвнянь (1), (2). Пiсля вiдповiдних перетворень одержав вираз для радiуса квантового круга
m2v2r2 = |
h2 |
n2, |
mv2 |
= |
e2 |
|
|
|||||||||||
4π2 |
|
|
r2 |
|
||||||||||||||
|
|
|
|
|
|
|
r |
|
|
|
|
|||||||
mv2 = |
|
h2n2 |
|
|
, mv2 = |
e2 |
|
|
||||||||||
4π2mr2 |
r |
|
||||||||||||||||
|
h2n2 |
|
|
|
|
|
||||||||||||
|
|
= |
e2 |
|
, |
rn = |
|
h2n2 |
(3) |
|||||||||
4π2mr2 |
r |
4π2e2m |
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||
21/35
Передумови створення ТБА |
Електрон |
Модель атома Резерфорда |
Теорiя Бора |
Теорiя Бора
Постулати Бора
◦ |
◦ |
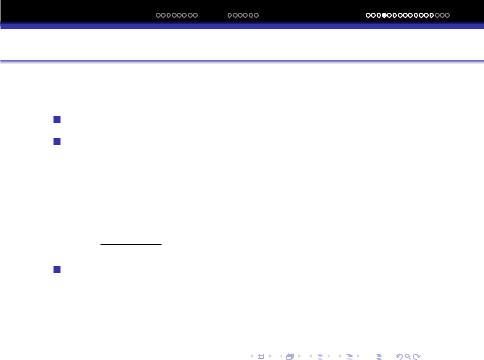
rn = 0,53n2A, |
r1 = 0.53A. |
Iз рiвняння (3) витiкає, що радiуси можливих кругових орбiт вiдносяться як квадрати натуральних чисел r1 : r2 : r3 : ...rn = 12 : 22 : 32 : ...:n2
Цi круги називаються квантовими кругами. Для других гi-
дрогенподiбних атомiв, якi мають лише по одному e¯,
h2n2 rn = 4π2me2Z.
Подiбним чином одержимо рiвняння для швидкостi електрона по вiдповiднiй круговiй орбiтi.
22/35
Передумови створення ТБА |
Електрон |
Модель атома Резерфорда |
Теорiя Бора |
Теорiя Бора
Постулати Бора
Для цього iз рiвнянь (1) та (2) виключимо радiус:
mvr = |
|
h |
|
n |
(4), |
r = |
hn |
|
|
|
|
|||||
2π |
2πmv |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
mv2 |
= |
e2 |
|
, r = |
|
e2 |
= > |
hn |
= |
e2 |
, |
||||
|
r2 |
|
mv2 |
2πmv |
mv2 |
|||||||||||
|
r |
|
|
|
|
|
|
|
|
|||||||
Звiдси |
|
vn |
= 2πe2 |
(5) |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
hn |
|
|
|
|
|
|
|
|
|
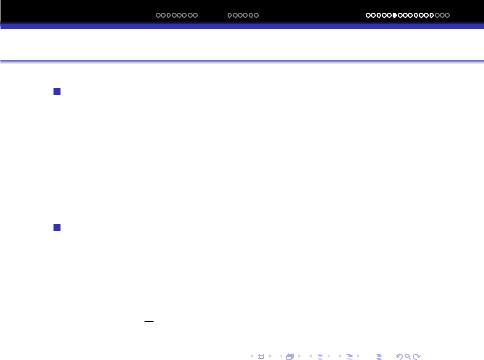
v1 : v2 : v3 : ...:vn = 1/1 : 1/2 : 1/3 : ...:1/n ,
v1 = 2.187·106 м/сек. Швидкостi електрона на вiдповiдних квантових орбiтах обернено пропорцiйнi числам натурального ряду.
23/35
Передумови створення ТБА |
Електрон |
Модель атома Резерфорда |
Теорiя Бора |
Теорiя Бора
Постулати Бора
Перша кругова орбiта (n= 1) найбiльш стабiльна. В нормальному станi атома гiдрогену електрон рухається тiльки по нiй.
На других орбiтах e¯ рухається тiльки тодi, коли якиминебудь зовнiшнiми силами (швидкими iонами, e¯, свiтловими коливанями i т. iнш.) вiн вибитий iз своєї нормальної (n= 1) орбiти.
3-iй постулат Бора: Якщо e¯ рухається по якiй-небудь дальнiй орбiтi сходить з неї i переходить (падає) на яку-небудь ближню орбiту, вiн завжди втрачає квант енергiї (hν) у виглядi монохроматичного випромiнювання, тобто у виглядi
електромагнiтної свiтлової хвилi певної довжини λ,(λ·ν = c) = > ν = λc .
24/35
Передумови створення ТБА Електрон Модель атома Резерфорда Теорiя Бора
Теорiя Бора
Постулати Бора
Eд −Eбл = hν = > ν = |
Eд − Eбл |
(6) , λ = c |
|
h |
(6a) |
||||
h |
|
|
Eд − Eбл |
||||||
, |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Eд − Eбл−? Eд = Eкiн + Eпот |
= |
mvд2 |
+ Aiон |
− |
e2 |
, (7), |
|||
|
|
||||||||
|
|
|
|
2 |
|
|
rд |
|
|
де Aiон – робота iонiзацiї – це робота переносу електрона з квантового рiвня (n= 1) на нескiнчено далеку вiдстань;
e2 |
– робота переноса e¯ з орбiти з rд на нескiнчено далеку |
||||||||||||||||||
|
rд |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вiдстань. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Eбл = |
mvбл2 |
+ |
Aiон − |
e2 |
|
(7a) . |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
2 |
|
m |
|
rбл |
|
1 |
|
1 |
|
|
|||||||
Eд − Eбл = |
|
|
|
Vд2 − Vбл2 |
+ e2 |
|
|
|
− |
|
|
|
(8) |
||||||
2 |
|
r |
r |
д |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
бл |
|
|
|
|
||
25/35
Передумови створення ТБА Електрон Модель атома Резерфорда Теорiя Бора
Теорiя Бора
Постулати Бора
Пiдставимо в рiвняння (8) значення rn iз рiвняння (3) та значення vn iз рiвняння (5), одержимо рiвняння:
Eд − Eбл = |
|
2π2me |
4 |
h |
1 |
|
− |
|
1 |
i + |
4π2me |
4 |
h |
1 |
|
|
− |
1 |
i = |
||||||||||||||||||||||||||
|
2 |
|
|
2 |
2 |
2 |
|
|
|
2 |
2 |
||||||||||||||||||||||||||||||||||
|
2π2me |
4 |
|
|
|
|
|
|
|
h |
|
|
|
|
|
nд |
|
nбл |
|
|
|
h |
|
|
|
|
|
nбл |
|
|
nд |
||||||||||||||
|
h |
1 |
|
− |
1 |
|
+ |
2 |
− |
2 |
i = |
2π2me |
4 |
h |
1 |
|
− |
|
1 |
i; |
|||||||||||||||||||||||||
2 |
|
2 |
2 |
|
2 |
2 |
2 |
|
|
2 |
2 |
||||||||||||||||||||||||||||||||||
|
h |
|
nд |
|
|
|
nбл |
|
|
|
nбл |
|
nд |
|
|
h |
|
|
|
|
|
nбл |
|
|
|
|
nд |
|
|
|
|||||||||||||||
ν = |
2π2me |
4 |
|
1 |
|
− |
|
1 |
|
|
= 3.29 ·1015 |
|
1 |
|
|
− |
|
1 |
|
|
(9) |
||||||||||||||||||||||||
3 |
|
2 |
2 |
|
2 |
|
|
2 |
|||||||||||||||||||||||||||||||||||||
|
|
|
h |
|
|
|
nбл |
|
nд |
|
гц |
|
|
|
|
|
|
|
nбл |
nд |
|
гц |
|||||||||||||||||||||||
n – Бор назвав головним квантовим числом. Формула (9) дає можливiсть розрахувати частоти монохроматичного випромiнювання атомом гiдрогену у випадку, якщо e¯ збитий якими-небудь силами на 2, 3, 4 i т. iн. орбiти повертається на першу.
26/35
Передумови створення ТБА |
Електрон |
Модель атома Резерфорда |
Теорiя Бора |
Теорiя Бора
В цьому випадку ми отримаємо набiр частот, яким на спектрограмi вiдповiдає група лiнiй, яка називається спектраль-
◦
ною серiєю з довжиною хвилi λ (1216 910A).
Око фiксує лише свiтловi коливання з довжиною хвилi λ =
◦
7600−3800A. Тому їх можна зафiксувати (виявити) з допомогою фотоплiвки або флуоресцiруючого екрану.
Ця серiя лiнiй лежить в так званiй УФ-областi спектра. Вона називається серiєю Лаймана.
Якщо електрон завжди повертається на другу орбiту, то в спектроскопi повина з‘явитися нова серiя лiнiй-серiя Баль-
◦
мера з λ = 6564 − 3648A. Вона здебiльшого розмiщена у видимiй областi спектра.
27/35

Передумови створення ТБА |
Електрон |
Модель атома Резерфорда |
Теорiя Бора |
Теорiя Бора
При поверненi e¯завжди на 3-тю квантову орбiту з‘являється нова серiя спектральних лiнiй серiя Пашена з довжиною
◦
хвилi λ = 18760 −8208A, яка розмiщена в IЧ частинi спектра.
Якщо атом гiдрогену побудований так, як це собi уявляв Бор та, якщо 2-ий постулат правильний, то спектр атома H повинен складатися iз ряду серiй.
В кожнiй серiї частоти коливань окремих променiв повинi розраховуватися за формулою (9). Серiя Браккета (4), серiя Пфунда (5), серiя Хампфрi (6).
28/35
Передумови створення ТБА |
Електрон |
Модель атома Резерфорда |
Теорiя Бора |
Теорiя Бора
Оптичний спектр атома H як результат експеримента
Оптичний спектр атома H як результат прямого дослiду.
Спектр атома H лiнiйчатий. Iснує декiлька серiй (6).
Вкожнiй серiї у напрямку вiд IЧчастини до УФ-частини спектру iнтервали змiнюються спочатку великими стрибками, а потiм усе меншими i меншими, а в кiнець зливаються.
Взалежностi вiд чутливостi (розрiшення) серiя Бальмера мiстить до 25 лiнiй.
Майже повне спiвпадiння теоретично розрахованих i експериментально одержаних спектрiв свiдчить про те, що схема утворення спектра атома H, запропонована Бором близька до iстини.
29/35
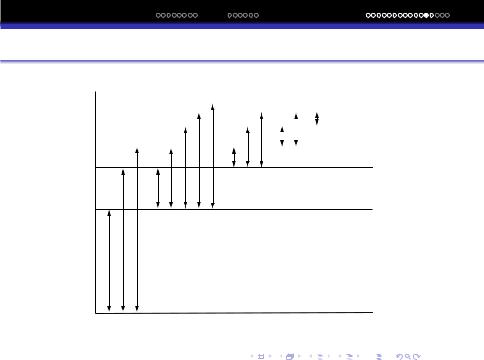
Передумови створення ТБА Електрон Модель атома Резерфорда Теорiя Бора
Теорiя Бора
Оптичний спектр атома H як результат експеримента
n = ∞ |
|
|
|
|
|
|
|
n = 6 |
|
|
|
|
|
|
|
|
|
с. Пфунда |
|
n = 5 |
|
|
|
|
|
||
|
|
|
|
n = 4 |
|
|
с. Браккета |
|
|||
|
|
|
|
|
серія Пашена |
||
n = 3
серія Бальмера
n = 2
серія Лаймана
n = 1
30/35
