
Часть 2
.PDFГлава 2. Дистрофии |
73 |
Инфильтрация — избыточное проникновение продуктов обмена из крови
илимфы в клетки или межклеточное вещество с последующим их накоплением в связи с недостаточностью ферментных систем, метаболизирующих эти продукты. Например, инфильтрация грубодисперсным белком эпителия проксимальных канальцев почек при нефротическом синдроме, инфильтрация холестерином и липопротеидами интимы аорты и крупных артерий при атеросклерозе.
Декомпозиция (фанероз) — распад ультраструктур клеток и межклеточного вещества, ведущий к нарушению тканевого (клеточного) метаболизма
инакоплению продуктов нарушенного обмена в ткани (клетке). Таковы жировая дистрофия кардиомиоцитов при дифтерийной интоксикации, фибриноидное набухание соединительной ткани при ревматических болезнях.
Извращенный синтез — синтез в клетках или тканях веществ, не встречающихся в них в норме. Например, синтез аномального белка амилоида в клетке и аномальных белково-полисахаридных комплексов амилоида в межклеточном веществе; синтез белка алкогольного гиалина гепатоцитом (тельца Мэллори); синтез гликогена в эпителии узкого сегмента нефрона при сахарном диабете.
Трансформация — образование продуктов одного вида обмена из общих исходных продуктов, которые идут на построение белков, жиров и углеводов. Например, трансформация компонентов жиров и углеводов в белки, усиленная полимеризация глюкозы в гликоген.
Инфильтрация и декомпозиция — ведущие морфогенетические механизмы дистрофии, часто последовательные стадии их развития. Однако в некоторых органах и тканях в связи с их структурно-функциональными особенностями преобладает какой-либо один из морфогенетических механизмов: инфильтрация в эпителии почечных канальцев, декомпозиция в клетках миокарда, образование амилоида в плазматических клетках (извращенный синтез).
При изучении дистрофии на разных уровнях — ультраструктурном, клеточном, тканевом, органном — морфологическая специфика проявлена неоднозначно. Ультраструктурная морфология дистрофий обычно не имеет какой-либо специфики. Она отражает не только повреждение органелл, но и их восстановление (внутриклеточную регенерацию). Вместе с тем возможность выявления в органеллах ряда продуктов обмена (липидов, гликогена, ферритина) позволяет говорить об ультраструктурных изменениях, характерных для того или иного вида дистрофий.
Однако наиболее ярко характерную морфологию дистрофий выявляют на клеточном и тканевом уровнях, причем для доказательства связи дистрофии с нарушениями того или иного вида обмена необходимо применение гистохимических методов. Без установления качества продукта нарушенного обмена веществ нельзя отнести патологический процесс к белковым, жировым, углеводным или другим дистрофиям. Изменения органа при дистрофии (размер, цвет, консистенция, структура на разрезе) в одних случаях представлены исключительно ярко, в других — отсутствуют, и лишь микроскопическое исследование позволяет выявить их специфичность.
74 |
Общая патологическая анатомия |
В ряде случаев можно говорить о системном характере изменений при дистрофии — системном гемосидерозе, системном мезенхимальном амилоидозе, системном липоидозе.
Классификация дистрофий основана на нескольких принципах:
–по преобладанию морфологических изменений в специализированных элементах паренхимы или строме и сосудах: паренхиматозные, стромально-сосудистые, смешанные;
–по преобладанию нарушений того или иного вида обмена: белковые, жировые, углеводные, минеральные, смешанные;
–в зависимости от влияния генетических факторов: приобретенные, наследственные;
–по распространенности процесса: общие, местные.
ПАРЕНХИМАТОЗНЫЕ ДИСТРОФИИ
Паренхиматозные дистрофии проявляются в нарушениях обмена веществ в функционально высокоспециализированных клетках. При паренхиматозных дистрофиях преобладают нарушения клеточных механизмов трофики. Различные виды паренхиматозных дистрофий отражают недостаточность определенного физиологического (ферментативного) механизма, служащего для выполнения клеткой специализированной функции (гепатоцит, нефроцит, кардиомиоцит). В связи с этим в разных органах (печени, почках, сердце) при развитии одного и того же вида дистрофии участвуют разные пато- и морфогенетические механизмы. Из этого следует, что переход одного вида паренхиматозной дистрофии в другой исключен и возможно лишь сочетание разных видов дистрофии.
Различают три разновидности внутриклеточных накоплений метаболитов:
–увеличение количества естественных эндогенных метаболитов, которые образуются в нормальном или ускоренном ритме, а скорость их распада и выведения недостаточна;
–накопление внутриклеточных метаболитов, которые не могут быть метаболизированы, например, из-за генетического дефекта какоголибо фермента, в результате чего продукты обмена накапливаются внутри клетки (болезни накопления или тезаурисмозы);
–скопление аномальных экзогенных веществ, которые не могут быть разрушены внутри клетки, например частиц угля.
Взависимости от преобладания нарушений того или иного вида обмена паренхиматозные дистрофии делят на белковые (диспротеинозы), жировые (липидозы) и углеводные.
Паренхиматозные белковые дистрофии (диспротеинозы)
Большая часть белков цитоплазмы находится в соединении с липидами, образуя липопротеидные комплексы, которые составляют основу мембран

Глава 2. Дистрофии |
75 |
|||
|
|
|
|
|
|
|
|
|
|
Рис. 2-2. Схема морфогенеза паренхиматозных диспротеинозов
митохондрий, эндоплазматической сети, пластинчатого комплекса и других структур, включая цитоплазматические мембраны. Помимо связанных белков, цитоплазма содержит и свободные, многие из которых обладают функцией ферментов.
Сущность паренхиматозных диспротеинозов состоит в изменении физи- ко-химических и морфологических свойств белков клетки. Они подвергаются денатурации и коагуляции или, наоборот, колликвации, что ведет к гидратации цитоплазмы. При нарушении связи белков с липидами возникает деструкция мембранных структур клетки. В исходе этих нарушений может развиться коагуляционный (сухой) или колликвационный (влажный) некроз (рис. 2-2).
К паренхиматозным диспротеинозам относят зернистую, гиалиновокапельную, гидропическую и роговую дистрофии.
Зернистая дистрофия
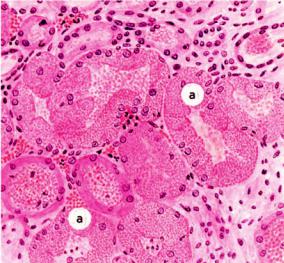
Со времен немецкого патологоанатома Р. Вирхова (1821–1902) многие патологи причисляли и продолжают причислять к паренхиматозным белковым дистрофиям зернистую дистрофию, при которой в клетках паренхиматозных органов при светооптическом исследовании выявляют белковые зерна (рис. 2-3). При этом сами органы увеличены, дряблые и тусклые на разрезе, что послужило причиной называть зернистую дистрофию тусклым (мутным) набуханием. Электронно-микроскопическое и гистоферментохимическое изучение зернистой дистрофии показало, что в ее основе часто лежит не накопление белка в цитоплазме, а увеличение объема ультраструктур за счет их отека и деструкции. Однако эти изменения обратимы и исчезают при прекращении действия причины, вызвавшей дистрофию. Вместе с тем морфологическая картина, подобная зернистой дистрофии, может возникать при гипертрофии и гиперплазии ультраструктур клеток паренхиматоз-
76 |
Общая патологическая анатомия |
Рис. 2-3. Зернистая дистрофия эпителия почечных канальцев
ных органов как выражение их функционального напряжения и адаптации к избыточной нагрузке в ответ на различные воздействия. Это позволило части исследователей отрицать зернистую дистрофию как патологический процесс. Однако при адаптации органы обычно увеличены, тонус их повышен, консистенция плотная, а на разрезе поверхность блестящая. При зернистой же дистрофии развивается картина мутного набухания органа, что исключает процессы адаптации. Зернистая дистрофия появляется в клетках в начале декомпенсации функции органа.
Исход зернистой дистрофии — ее ликвидация, эта дистрофия обратима. Если же причина, вызвавшая повреждение клеток, не устранена, то зернистая дистрофия трансформируется в гиалиново-капельную дистрофию.
Гиалиново-капельная дистрофия
При гиалиново-капельной дистрофии в клетке в результате коагуляции белка появляются крупные гиалиноподобные белковые капли, сливающиеся между собой и заполняющие цитоплазму, и происходит деструкция клеточных ультраструктурных элементов. Эта белковая дистрофия необратима и в ряде случаев завершается фокальным коагуляционным некрозом клетки. Этот диспротеиноз часто встречается в почках, реже — в печени
исовсем редко — в миокарде.
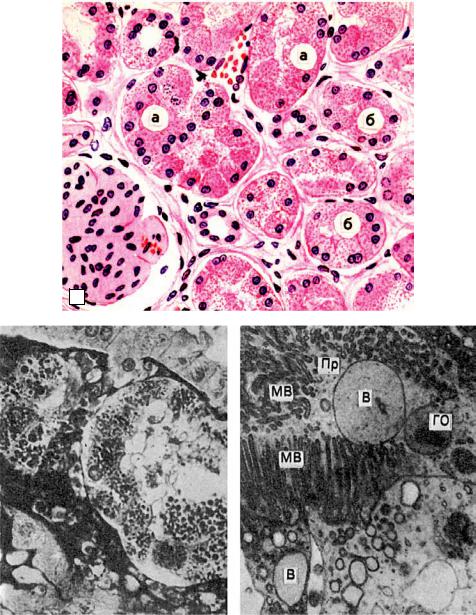
Впочках при микроскопическом исследовании накопление гиалиновых капель определяют в эпителии проксимальных канальцев. При этом наблюдают деструкцию митохондрий, эндоплазматической сети, щеточной каемки (рис. 2-4). В основе гиалиново-капельной дистрофии нефроцитов лежит недостаточность вакуолярно-лизосомального аппарата эпителия
Глава 2. Дистрофии |
77 |
а
б |
|
в |
Рис. 2.4. Гиалиново-капельная дистрофия эпителия почечных канальцев (а); в цитоплазме эпителия крупные белковые капли (микроскопическая картина) (б); в цитоплазме клетки много белковых (гиалиновых) образований (ГО) овальной формы и вакуолей (В); отмечаются десквамация микроворсинок (МБ) щеточной каемки и выход в просвет (Пр) канальца вакуолей и белковых образований (в). Электронограмма, ×18 000
78 |
Общая патологическая анатомия |
канальцев, в норме реабсорбирующего белки. Эта дистрофия нефроцитов очень часто встречается при нефротическом синдроме — одном из проявлений многих заболеваний почек, при которых первично поражен гломерулярный фильтр (гломерулонефрита, амилоидоза почек, парапротеинемической нефропатии).
Внешний вид почки при этой дистрофии не имеет характерных черт и обусловлен, прежде всего, особенностями основного заболевания (гломерулонефрита, амилоидоза).
В печени при микроскопическом исследовании в гепатоцитах находят гиалиноподобные тельца (тельца Мэллори), которые состоят из фибрилл особого белка, — алкогольный гиалин (см. рис. 1-22). Их образование — проявление извращенной белково-синтетической функции гепатоцита, что встречается постоянно при хроническом алкогольном гепатите и сравнительно редко при первичном билиарном циррозе, гепатоцеребральной дистрофии (болезни Вильсона–Коновалова). Внешний вид печени различен; изменения характерны для тех ее заболеваний, при которых развивается гиалиново-капельная дистрофия.
Функциональное значение гиалиново-капельной дистрофии велико. С нею связаны появление в моче белка (протеинурия) и цилиндров (цилиндрурия), потеря белков плазмы (гипопротеинемия), нарушение ее электролитного баланса. Гиалиново-капельная дистрофия гепатоцитов нередко является морфологической основой нарушений многих функций печени.
Исход гиалиново-капельной дистрофии неблагоприятен: она завершается гибелью клетки.
Гидропическая (водяночная) дистрофия
Гидропическая, или водяночная, дистрофия характеризуется появлением в клетке вакуолей, наполненных цитоплазматической жидкостью. Ее наблюдают чаще в эпителии кожи и почечных канальцев, в гепатоцитах, мышечных и нервных клетках и клетках коры надпочечников.
При микроскопическом исследовании наблюдают увеличенные в объеме паренхиматозные клетки. Цитоплазма их заполнена небольшими вакуолями, представляющими собой растянутые канальцы эндоплазматической сети, содержащие прозрачную жидкость. Ядро смещено на периферию клетки, обычно сморщено, иногда вакуолизировано. Прогрессирование этих изменений приводит к разрыву мембран эндоплазматической сети, образованию крупных вакуолей, распаду ультраструктур клетки и переполнению ее водой. Клетка содержит заполненные жидкостью баллоноподобные вакуоли и расположенное на периферии пузырьковидное ядро. Такие изменения клетки, которые, по существу, являются выражением фокального колликвационного некроза, называют баллонной дистрофией.
Внешний вид органов и тканей при гидропической дистрофии изменяется мало. Обычно ее обнаруживают под микроскопом.
Механизм развития гидропической дистрофии сложен и отражает нарушения водно-электролитного и белкового обмена, ведущие к изменению

Глава 2. Дистрофии |
79 |
коллоидно-осмотического давления в клетке. Большую роль играет нарушение проницаемости клеточных мембран, сопровождаемое их распадом. Это ведет к закислению цитоплазмы, активации гидролитических ферментов лизосом, которые разрывают внутримолекулярные связи с присоединением воды.
Причины развития гидропической дистрофии в разных органах неоднозначны. В почках — повреждение гломерулярного фильтра при гломерулонефрите, амилоидозе, сахарном диабете. Оно приводит к гиперфильтрации
инедостаточности ферментной системы базального лабиринта нефроцитов, в норме обеспечивающей реабсорбцию воды. Гидропическая дистрофия нефроцитов характерна для нефротического синдрома. В печени гидропическая дистрофия возникает при вирусном и токсическом гепатитах (рис. 2-5) и нередко является выражением печеночной недостаточности. Причина гидропической дистрофии эпидермиса — вирусная инфекция (оспа), отек кожи различного генеза. Вакуолизация цитоплазмы может быть проявлением физиологической деятельности клетки, что отмечено, например, в ганглиозных клетках центральной и периферической нервной системы.
Исход гидропической дистрофии, как правило, неблагоприятный: завершается фокальным или тотальным некрозом клетки. Функция органов
итканей при гидропической дистрофии страдает значительно.
Рис. 2-5. Гидропическая дистрофия печени (биопсия). Микроскопическая картина: вакуолизация гепатоцитов, ×18 000
80 |
Общая патологическая анатомия |
Роговая дистрофия
Роговая дистрофия, или патологическое ороговение, характеризуется избыточным образованием рогового вещества в ороговевающем эпителии (гиперкератоз, ихтиоз) или образованием рогового вещества там, где в норме его не бывает, — патологическое ороговение слизистых оболочек, или лейкоплакия; образование «раковых жемчужин» в плоскоклеточном раке. Процесс может быть местным или распространенным.
Причины роговой дистрофии: нарушение развития кожи, хроническое воспаление, вирусные инфекции, авитаминозы.
Исход двоякий: устранение вызывающей причины в начале процесса приводит к восстановлению ткани, однако в далеко зашедших случаях наступает гибель клеток. Иногда такие дистрофические изменения трансформируются в злокачественный опухолевый рост.
Значение роговой дистрофии определяется ее степенью, распространенностью и длительностью. Длительно существующее патологическое ороговение слизистой оболочки (лейкоплакия) — источник развития раковой опухоли. Врожденный ихтиоз резкой степени, как правило, несовместим
сжизнью.
Кгруппе паренхиматозных диспротеинозов примыкает ряд дистрофий, в основе которых лежат нарушения внутриклеточного метаболизма ряда аминокислот в результате наследственной недостаточности метаболизирующих их ферментов, т.е. в результате наследственной ферментопатии. Эти дистрофии относят к болезням накопления.
Наиболее яркие примеры наследственных дистрофий, связанных с нарушением внутриклеточного метаболизма аминокислот, — цистиноз, тирозиноз, фенилпировиноградная олигофрения (фенилкетонурия) (табл. 2-1).
Таблица 2-1. Наследственные дистрофии, связанные с нарушением обмена аминокислот
Название |
Дефицит фермента |
Локализация накоплений |
|
|
аминокислоты |
|
|
|
Цистиноз |
Неизвестен |
Печень, почки, селезенка, |
|
|
глаза, костный мозг, лим- |
|
|
фатические узлы, кожа |
|
|
|
Тирозиноз |
Тирозинаминот рансфе- |
Печень, почки, кости |
|
раза или оксидаза параок- |
|
|
сифенилпировиноградной |
|
|
кислоты |
|
|
|
|
Фенилпировиноградная |
Фенилаланин-4-гидро- |
Нервная система, мышцы, |
олигофрения |
ксилаза |
кожа, кровь, моча |
|
|
|
Паренхиматозные жировые дистрофии (липидозы)
Вцитоплазме клеток содержатся в основном липиды, которые образуют
сбелками сложные лабильные жиробелковые комплексы — липопротеи-

Глава 2. Дистрофии |
81 |
ды. Они составляют основу клеточных мембран и часть клеточных ультраструктур. Помимо липопротеидов, в цитоплазме встречаются и нейтральные жиры, которые представляют собой сложные эфиры глицерина и жирных кислот.
Для выявления жиров используют срезы нефиксированных замороженных или фиксированных в формалине тканей. Гистохимически жиры выявляют рядом методов: судан III и шарлах окрашивают их в красный цвет, судан IV и осмиевая кислота — в черный, сульфат нильского голубого окрашивает жирные кислоты в темно-синий цвет, а нейтральные жиры — в красный. С помощью поляризационного микроскопа дифференцируют изотропные и анизотропные липиды, которые дают характерное двойное лучепреломление.
Нарушения обмена цитоплазматических липидов проявляются увеличением их содержания в клетках, где их обнаруживают и в норме, появлением липидов там, где они обычно не встречаются, и образованием жиров необычного химического состава. Наиболее часто в клетках накапливаются нейтральные жиры и фосфолипиды.
Паренхиматозная жировая дистрофия наиболее часто встречается там же, где и белковую, — в миокарде, печени, почках.
В мышечных клетках миокарда появляются мельчайшие жировые капли — пылевидное ожирение. При нарастании изменений эти капли становятся крупнее (мелкокапельное ожирение) и почти полностью могут замещать цитоплазму (рис. 2-6). Большая часть митохондрий при этом распадается, поперечная исчерченность мышечных волокон исчезает. Процесс имеет очаговый характер. Ее наблюдают в первую очередь в группах мышеч-
а |
|
б |
|
|
|
Рис. 2-6. Жировая дистрофия миокарда: а — капли жира в цитоплазме мышечных волокон (микроскопическая картина); б — включения липидов (Л), имеющих характерную исчерченность; Мф — миофибриллы. Электронограмма, ×21 000
82 |
Общая патологическая анатомия |
ных клеток, расположенных по ходу венозного колена капилляров и мелких вен, где наиболее низко содержание кислорода в крови.
Внешний вид сердца зависит от степени жировой дистрофии. Если процесс выражен слабо, его можно распознать лишь под микроскопом, применяя специальные окраски на липиды; если он выражен сильно, сердце увеличено, камеры его растянуты, миокард дряблый, на разрезе тусклый, глинистожелтый. Со стороны эндокарда видна желто-серая исчерченность, особенно хорошо выраженная в сосочковых мышцах и трабекулах желудочков сердца, — «тигровое сердце». Эта исчерченность миокарда связана с преимущественным поражением мышечных клеток вокруг венул и вен. Жировая дистрофия миокарда — морфологический эквивалент его декомпенсации.
Развитие жировой дистрофии миокарда связывают с тремя механизмами: повышенным поступлением жирных кислот в кардиомиоциты, нарушением обмена жира в этих клетках и распадом липопротеидных комплексов внутриклеточных структур. Чаще всего эти механизмы реализуются путем инфильтрации и декомпозиции (фанероза) при энергетическом дефиците миокарда, связанном с гипоксией и интоксикацией (дифтерия). При этом основное значение декомпозиции не в высвобождении липидов из липопротеидных комплексов клеточных мембран, а в деструкции митохондрий, которая ведет к нарушению окисления жирных кислот в клетке.
В печени жировая дистрофия (ожирение) проявляется резким увеличением содержания жира в гепатоцитах и изменением его состава. В клетках печени вначале появляются гранулы липидов (пылевидное ожирение), затем их мелкие капли (мелкокапельное ожирение), которые в дальнейшем сливаются в крупные (крупнокапельное ожирение) или в одну жировую вакуоль, которая заполняет всю цитоплазму и отодвигает ядро на периферию клетки. Измененные таким образом гепатоциты напоминают жировые клетки. Чаще отложение жира в печени начинается на периферии долек, реже — в центре; при значительной дистрофии ожирение клеток печени имеет диффузный характер.
Внешний вид печени достаточно характерен: она увеличена, дряблая, охряно-желтого или желто-коричневого цвета. При разрезе на лезвии ножа и поверхности разреза виден налет жира.
Механизмы развития жировой дистрофии печени: чрезмерное поступление жирных кислот в гепатоциты или повышенный их синтез; действие токсических веществ, блокирующих окисление жирных кислот и синтез липопротеидов в гепатоцитах; недостаточное поступление в печеночные клетки аминокислот, необходимых для синтеза фосфолипидов и липопротеидов. Жировая дистрофия печени развивается при липопротеидемии (алкоголизме, сахарном диабете, общем ожирении, гормональных расстройствах), гепатотропных интоксикациях (этанолом, фосфором, хлороформом), нарушениях питания (недостатке белка в пище — алипотропной жировой дистрофии печени, авитаминозе, болезнях пищеварительной системы).
