
voprosi
.docx
(Е
– полная энергия частицы, U–
потенциальная энергия частицы в силовом
поле,
 - оператор Лапласа, m
– масса частицы,
- оператор Лапласа, m
– масса частицы,
 - постоянная Планка).
- постоянная Планка).
![]() это
зависит от времени
это
зависит от времени
-
Стационарным уравнением Шредингера для электрона в поле ядра водородоподобного атома является уравнение…
 или
или
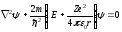
(m
– масса электрона, е
– заряд электрона, –
постоянная Планка,
z
– заряд ядра, Е
– полная энергия электрона, U
– потенциальная энергия электрона, ω0
- частота гармонического осциллятора,
ε0
- электрическая постоянная, Z – зарядовое
число)
–
постоянная Планка,
z
– заряд ядра, Е
– полная энергия электрона, U
– потенциальная энергия электрона, ω0
- частота гармонического осциллятора,
ε0
- электрическая постоянная, Z – зарядовое
число)
31. Квантование энергии ( 2вопр)
-
Энергия электрона Е в прямоугольном потенциальном «ящике» с бесконечно высокими стенами и плоским дном:
 (п
– главное
квантовое число)
(п
– главное
квантовое число) -
Самый низкий уровень энергии Е1, отвечающий минимально возможной энергии электрона в атоме называется основным, все остальные – возбужденными.
-
Особенностью поведения частицы в одномерной бесконечно глубокой потенциальной яме является….поведение микрочастицы в одномерной бесконечно глубокой потенциальной «яме» может быть различным в зависимости от значения числа n, его называют квантовым числом и рассматривают как номер возможного состояния микрочастицы
-
Туннельный эффект заключается:Туннельный эффект – допускаемый квантовой механикой процесс преодоления элементарной частицей потенциального барьера, при котором частица, не обладающая достаточной энергией всё-таки способна его преодолеть.
-
С увеличением высоты потенциального барьера вероятность туннелирования резко уменьшается при увеличении высоты и ширины потенциального барьера,
-
Коэффициент прозрачности потенциального барьера для электрона в туннельном эффекте не зависит от (зависит только от высоты и ширины барьера_)
32. Квантование момента импульса. Спин. Принцип Паули ( 5вопр)
-
Главное квантовое число
 и
орбитальное число
и
орбитальное число
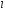 определяют в атоме, соответственно…
Главное
квантовое число n определяет
распределение квантовых состояний по
слоям в атоме и может принимать только
натуральные значения:n=1,
2, 3,… квантовое число l характеризует
различное энергетическое состояние
электронов на данном уровне, форму
орбитали, орбитальный момент импульса
электрона.
определяют в атоме, соответственно…
Главное
квантовое число n определяет
распределение квантовых состояний по
слоям в атоме и может принимать только
натуральные значения:n=1,
2, 3,… квантовое число l характеризует
различное энергетическое состояние
электронов на данном уровне, форму
орбитали, орбитальный момент импульса
электрона. -
Какие значения может принимать орбитальное квантовое число
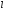 в состоянии с главным квантовым числом
n?
Это
квантовое число может принимать
целочисленные значения от 0 до n -
1 (l =
0,1, ..., n -
1)
в состоянии с главным квантовым числом
n?
Это
квантовое число может принимать
целочисленные значения от 0 до n -
1 (l =
0,1, ..., n -
1) -
Состояние электрона в атоме водорода, энергия которого больше энергии основного состояния называется…. возбужденным
-
Главное квантовое число характеризует энергию электронов, занимающих данный энергетический уровень
-
Магнитное квантовое число
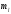 определяет ориентацию
в пространстве орбитального момента
количества движения электрона или
пространственное расположение атомной
орбитали
определяет ориентацию
в пространстве орбитального момента
количества движения электрона или
пространственное расположение атомной
орбитали -
Орбитальное квантовое число определяет определяющее форму распределения амплитуды волновой функции электрона в атоме, то есть форму электронного облака
-
Спиновое квантовое число для электрона может принимать значения: +1/2 и –1/2
-
Электрон – частица с отрицательным зарядом
-
Спин электрона характеризует момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого
-
Cпин, равный единице, имеет… бозон(фотон,глюон)
-
В соответствии с принципом исключения Паули в квантовом состоянии может находиться: только один фермион, состояние другого должно отличаться хотя бы одним квантовым числом.
-
Принцип Паули выполняется для: фермионов ( частиц с полуцелым спином( электрон, протон))
-
Какие значения может принимать магнитное спиновое квантовое число? Число s может принимать целые, нулевые или полуцелыезначения
-
Периодичность химических свойств элементов обусловлена повторяемостью электронных конфигураций во внешних электронных оболочках
-
В любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором четырёх квантовых чисел: главного n, орбитального , магнитного и спинового .
-
В электронной оболочке атома с главным квантовым числом 2 может находиться максимальное число электронов …8
-
В электронной оболочке атома с главным квантовым числом 1 может находиться максимальное число электронов 2
-
В электронной оболочке атома с главным квантовым числом 3 может находиться максимальное число электронов …18
33. Атом водорода ( 6вопр)
-
Первый постулат Бора:
В атоме существуют стационарные, не изменяющиеся во времени состояния, в которых атом не излучает и не поглощает энергии. Стационарным состояниям атома соответствуют стационарные электронные орбиты
где n и k – главные квантовые числа, соответствующие номерам энергетических уровней.
-
Правило квантования орбит Бора:
 (п
=
1, 2, 3...).
(п
=
1, 2, 3...).
(где
 - скорость электрона,
- скорость электрона,
 - постоянная Планка,
- постоянная Планка,
 - масса электрона,
- масса электрона,
 - радиус орбиты)
- радиус орбиты)
-
Боровский радиус – это радиус … первой (ближайшей к ядру) орбиты электрона в атоме водорода.
-
При переходе электрона в атоме с одной стационарной орбиты с энергией Е2 на другую с энергией Е1 излучается один фотон с частотой = (Е2 - Е1)/h
(h – постоянная Планка )
-
В видимой области спектра находятся спектральные линии атома водорода, соответствующие серии… Бальмера
-
В ультрафиолетовой области спектра находятся спектральные линии атома водорода, соответствующие серии… Лаймана.
-
!!!!!В ультрафиолетовой области спектра находятся спектральные линии атома водорода, соответствующие серии…
-
Атом водорода испускает серию линий в ультрафиолетовой области спектра… при переходе электронов с вышележащих уровней на первый
-
Атом водорода испускает серию линий в видимой области спектра… при переходе электронов с вышележащих уровней на второй.
-
На рисунке представлена энергетическая схема уровней атома. Между какими уровнями происходит переход атома с поглощением фотона с максимальной частотой волны. 13

111
-
Водородоподобной системой называется…. атом или ион, содержащий один электрон на внешней оболочке.
-
В спектре атома водорода могут наблюдаться только те линии, которые возникают при переходах с высших энергетических уровней на низшие при выполнении условия:
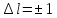 ;
;
 .
.
35. Элементы квантовой статистики, бозоны, фермионы( 2вопр)
-
Частицы подчиняются статистике: статистике Бозе - Эйнштейна
-
Бозонами являются частицы: частица с целым значением спина. Бозоны, в отличие от фермионов, подчиняются статистике Бозе — Эйнштейна, которая допускает, чтобы в одном квантовом состоянии могло находиться неограниченное количество одинаковых частиц.
-
Фермионами являются частицы: частица (или квазичастица) с полуцелым значением спина. Своё название получили в честь физика Энрико Ферми
-
Являются бозонами фотоны и фононы
-
Являются фермионами: электроны и протоны
36. Теплоёмкость ( 2вопр)
-
Закон Дюлонга-Пти выполняется для: твёрдых тел
-
По закону Дюлонга-Пти молярная теплоёмкость всех химически простых тел в кристаллическом состоянии: приблизительно равна 3R, где R – универсальная газ-я постоянная
-
Максимальная частота колебаний кристаллической решётки равна: температуру Дебая умножить на постоянную Больцмана и делить всё на постоянную Планка
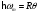 (где
(где
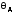 - температура Дебая.)
- температура Дебая.)
-
Температура Дебая указывает для каждого вещества область:
1) ниже которой начинают сказываться квантовые эффекты; 2) При температурах ниже температуры Дебая теплоёмкость кристаллической решётки определяется в основном акустическими колебаниями и, согласно закону Дебая, пропорциональна кубу температуры.
При
температурах намного выше температуры
Дебая справедлив закон
Дюлонга-Пти, согласно которому теплоёмкость
постоянна и равна ![]() ,
где
,
где ![]() количество
элементарных ячеек в теле,
количество
элементарных ячеек в теле, ![]() —
количество атомов в элементарной
ячейке,
—
количество атомов в элементарной
ячейке, ![]() — постоянная
Больцмана.
— постоянная
Больцмана.
-
Фонон является квазичастица, введённая советским учёным Игорем Таммом. Фонон представляет собой квант колебательного движения атомов кристалла.
-
Скорость фонона…
37. Физика твёрдого тела. Зонная теория ( 5вопр)
-
Зонная структура твердых тел обусловлена периодическим электрическим полем кристаллической решётки.
-
Носителями тока в полупроводниковых материалах являются дырки
-
Полупроводник – вещество, основным свойством которого является …. увеличение электрической проводимости с ростом температуры
-
Причинами рассеяния носителей заряда в полупроводнике являются дефекты, колебания узлов кристаллической решётки, дислокация
-
Удельное сопротивление собственных полупроводников
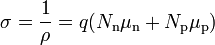
-
В полупроводнике с акцепторной примесью основным типом носителей электрического заряда являются … дырки
-
В полупроводнике с донорной примесью основным типом носителей электрического заряда являются … электроны
-
Ширина запрещенной зоны твердотельного материала характеризует… оптические и электрические свойства материала.
-
!!!!!!!В порядке убывания энергии активации, вещества располагаются:
-
Уровень Ферми это это некоторый условный уровень, соответствующий энергии Ферми системы фермионов
38. . p-n переход ( 2 вопр)
-
При прямом включении p-n–перехода к нему должна быть приложена следующая полярность: полярность внешнего напряжения
-
Прямое напряжение на p-n–переходе ток реального p-n-перехода будет меньше, чем идеального.
-
??Для выпрямительного диода в рабочем режиме между прямым током (
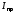 )
и обратным (
)
и обратным ( )
имеется соотношение:
)
имеется соотношение:
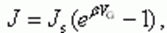
-
В электронно-дырочном переходе при совпадении направления внешнего электрического поля и диффузионного электрического поля контактная разность потенциалов противодействует диффузии свободных носителей тока
40. Протонно-нейтронная модель ядра атома ( 5вопр)
-
Атомное ядро состоит из… элементарных частиц(протонов и нейтронов)
-
Вещества, имеющие одинаковый атомный номер, но разные массовые числа, называются изотопами
-
Ядро атома имеет положительный заряд +Ze. Буквы Z и е обозначают число электронов в атоме
-
Зарядовое число атомного ядра – это число протонов в ядре, совпадает с порядковым номером элемента
-
Число нейтронов (N) в ядре можно выразить через зарядовое (Z) и массовое (A) число: N=A-Z
-
Массовое число атомного ядра – это… суммарное количество протонов и нейтронов (называемых общим термином «нуклоны») в ядре.
-
В центре атома находится положительно заряженное ядро, диаметр которого не превышает…2.5 ·10-15 м
-
К нуклонам относятся: протоны и нейтроны
-
Изотопы данного элемента отличаются друг от друга числом нейтронов.
-
Условное обозначение атомного ядра имеет вид:
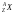 ,
здесь Х
– символ химического элемента; А
– массовое число; Z
– зарядовое число. Ядра с одинаковыми
Z,
но разными А
называются …изотопы
,
здесь Х
– символ химического элемента; А
– массовое число; Z
– зарядовое число. Ядра с одинаковыми
Z,
но разными А
называются …изотопы
41. Ядерные силы. Фундаментальные взаимодействия ( 5вопр)
-
Ядерные силы носят обменный характер. Нуклоны в ядре обмениваются π-мезонами.
-
Под энергией связи ядра понимают ту энергию, которая необходима для расщепления…. ядра на отдельные частицы.
-
Энергия связи нуклонов в ядре определяется:
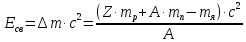
(где
А
– массовое число; Z – зарядовое число;
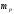 - масса протона,
- масса протона,
 - масса нейтрона;
- масса нейтрона;
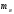 - масса ядра)
- масса ядра)
-
Энергия связи ядра прямо пропорциональна: дефекту массы (разности масс) и
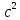 .
E = mc2
.
E = mc2 -
Под дефектом масс понимают разницу между … массой покоя атомного ядра данного изотопа, выраженной в атомных единицах массы, и массовым числом данного изотопа.
-
Сильное (ядерное) взаимодействие: одно из четырёх фундаментальных взаимодействий в физике. В сильном взаимодействии участвуют кварки и глюоны и составленные из них частицы, называемые адронами (барионы и мезоны). Оно действует в масштабах порядка размера атомного ядра и менее, отвечая за связь между кварками в адронах и за притяжение между нуклонами (разновидность барионов – протоны и нейтроны) в ядрах.
-
Ядерные силы взаимодействия между нуклонами зависят от взаимной ориентации спинов нуклонов.
-
Для характеристики ядерных сил неверным является утверждение: интенсивность ядерных сил зависит от заряда нуклонов.
-
К фундаментальным взаимодействиям относятся: гравитационное, электромагнитное, сильное, слабое.
42. Радиоактивность. Ядерные реакции ( 6вопр)
-
Альфа-излучение и бета-излучение под действием магнитного поля… отклоняются от прямолинейного направления.
-
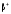 -
распад происходит по схеме:
-
распад происходит по схеме:

(где
 - элемент,
претерпевающий распад,
- элемент,
претерпевающий распад,
 - получающийся
элемент)
- получающийся
элемент)
-
Какой изотоп образуется в результате β+ -распада ядра радиоактивного изотопа аргона
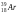 :
: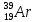
-
 -
распад происходит по схеме:
-
распад происходит по схеме:
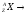

(где
 -
элемент,
претерпевающий распад,
-
элемент,
претерпевающий распад, - получающийся
элемент)
- получающийся
элемент)
-
В результате α – распада некоторого радиоактивного элемента образуется изотоп другого химического элемента, и исходное ядро покидает частица, которая является: ядром гелия( альфа частица)
-
Какой изотоп образуется в результате α-распада изотопа радия
 ?
?
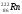
-
При +-распаде из ядра радиоактивного изотопа химического элемента выбрасывается позитрон (е+), протон в ядре превращается в нейтрон, позитрон и нейтрино
-
При --распаде из ядра радиоактивного изотопа химического элемента выбрасывается… электрон (е-), нейтрон превращается в протон, при этом испускаются электрон и электронное антинейтрино
-
При
 -
распаде ядро… самопроизвольно
испускает из основного состояния
α-частицы – ядра 4He.
При этом массовое число ядра A уменьшается
на четыре единицы, а заряд ядра Z −
на две единицы
-
распаде ядро… самопроизвольно
испускает из основного состояния
α-частицы – ядра 4He.
При этом массовое число ядра A уменьшается
на четыре единицы, а заряд ядра Z −
на две единицы -
Процесс термоядерной реакции заключается в: слиянии легких ядер в более тяжелые, за счет кинетической энергии их теплового движения (при температурах порядка сотен миллионов градусов.)
-
Критическая масса урана – это масса, при которой ядерная реакция: будет протекать
-
Минимальная энергия, необходимая для осуществления реакции деления ядра, называется энергией активации
-
В ядре изотопа углерода
 один
из нейтронов превратился в протон. В
результате образовалось ядро:
один
из нейтронов превратился в протон. В
результате образовалось ядро:
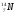
-
Превращение ядра урана в ядро плутония
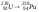 происходит в результате
двух
β--
распадов
происходит в результате
двух
β--
распадов
-
Какой изотоп образуется в результате β- распада рения
 :
:

-
В какой элемент превращается
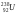 после трех α- распадов и двух β--
распадов? 88226Ra
после трех α- распадов и двух β--
распадов? 88226Ra
-
Нейтрон в свободном (изолированном) состоянии нестабильная частица. В результате распада нейтрона образуются: протон, электрон и нейтрино
-
Какой изотоп образуется в результате β- -распада изотопа бериллия
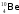 :
:
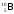
-
У некоторых легких ядер наблюдаются реакции захвата медленных нейтронов с испусканием заряженных частиц. Протон рождается в реакции …
Под действием тепловых нейтронов на легких ядрах наблюдаются реакции захвата нейтронов с испусканием протонов и а-частиц (реакции типа (n,р) и (n,а)
![]()
-
Сколько и -распадов должно произойти, чтобы актиний
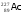 превратился в стабильный изотоп свинца
превратился в стабильный изотоп свинца
 .пять
и три--распадов
.пять
и три--распадов -
Ядерные реакции, протекающие с поглощением энергии, называются … Ядерная реакция синтеза
Если сумма масс ядер и частиц (m1), вступающих в ядерную реакцию, меньше суммы масс ядер и частиц (m2), возникающих в результате реакции, то наблюдается поглощение энергии.
-
Ядерные реакции, протекающие с выделением энергии, называются … Ядерная реакция деления, Термоядерная реакция
-
Реакция
 невозможна, так как нарушается закон
сохранения… зарядового
и массового чисел.
невозможна, так как нарушается закон
сохранения… зарядового
и массового чисел.
-
Деление урана 235 нейтронами может происходить различными путями. Определите число выделивших нейтронов, если реакция выглядит таким образом:
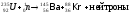 Ответ – два
нейтрона
Ответ – два
нейтрона
43. Закон радиоактивного распада(2вопр)
-
Сколько атомов распадется за временной интервал, равный двум периодам полураспада радиоактивного элемента? 75% первоначального количества
-
Активность радиоактивного вещества зависит от его массы… чем больше масса, тем сильнее активность
-
Активность радиоактивных ядер с течением времени … уменьшается
-
Число не распавшихся ядер в момент времени t равен … N(t) = N0e-λt
( где No – начальное число не распавшихся ядер в момент времени t = 0; - постоянная распада)
-
Среднее время жизни радиоактивного ядра t= 1/λ
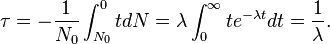
-
Препарат изотопа фосфора
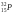 даёт 104распадов
в секунду. Период полураспада
даёт 104распадов
в секунду. Период полураспада
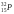 составляет 14,5 суток. Активность препарата
через 29 суток будет: 2330Бк
( офигеть задача для расчета)
составляет 14,5 суток. Активность препарата
через 29 суток будет: 2330Бк
( офигеть задача для расчета)
45. Элементы дозиметрии ( 2 вопр)
-
Экспозиционная доза радиации определяется: это отношение суммарного заряда всех ионов одного знака в элементарном объёме воздуха к массе воздуха в этом объёме. Измеряется в Кл/кг или Рентген
Экспозиционная доза определяет ионизирующую способность рентгеновских и гамма-лучей и выражает энергию излучения, преобразованную в кинетическую энергию заряженных частиц в единице массы атмосферного воздуха
-
Толщина слоя половинного ослабления: Толщина слоя заданного материала, уменьшающая уровень радиации в два раза
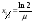
(где
 - линейный коэффициент ослабления)
- линейный коэффициент ослабления)
-
Поглощённая доза радиации определяется: - величина, равная отношению энергии ΔΕ, переданной элементу облучаемого вещества, к массе Δm этого элемента D = dE/dm
Единица поглощенной дозы - Грей (Гр). Внесистемная единица Рад определялась как поглощенная доза любого ионизирующего излучения, равная 100 эрг на 1 грамм облученного вещества.
-
Поглощённая доза излучения определяется:
называется поглощенная веществом энергия ионизирующего излучения, рассчитанная на единицу массы.
Поглощенная
доза излучения
D
определяется
по формуле:
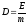
где Е — поглощенная веществом энергия, т — масса вещества. Единицей измерения поглощенной дозы излучения в системе СИ является 1 грей
-
Для узкого пучка гамма-лучей интенсивность I в веществе уменьшается по закону:
 (где
(где
![]() - линейный коэффициент ослабления, х
– толщина слоя)
- линейный коэффициент ослабления, х
– толщина слоя)
-
Эквивалентная доза (Н) равна поглощенной дозе, умноженной на коэффициент качества для данного вида излучения:

