
- •Техника безопасности в химической лаборатории
- •Общие правила поведения в лаборатории
- •Правила работы с химическими реактивами
- •Работа со стеклянной посудой и приборами
- •Работа с ртутными термометрами
- •Техника безопасности при работе с электроприборами
- •Основные правила противопожарной безопасности
- •Химическая посуда
- •1. Общие понятия
- •2. Способы выражения концентрации растворов
- •3. Титриметрический анализ
- •3.1. Сущность титриметрического метода анализа
- •3.2. Классификация титриметрических методов
- •3.3. Вычисления в титриметрии
- •3.4. Растворы, применяемые в титриметрии. Приготовление стандартных растворов
- •3.5. Аппаратура и техника выполнения титриметрического анализа
- •Выполнение работы. Опыт №1. Приготовление раствора заданной процентной концентрации.
- •Требуется приготовить 100 г раствора заданной процентной концентрации определенного вещества и воды (концентрацию и вещество указывает преподаватель).
Выполнение работы. Опыт №1. Приготовление раствора заданной процентной концентрации.
Приготовление раствора из твердого вещества и воды.
Требуется приготовить 100 г раствора заданной процентной концентрации определенного вещества и воды (концентрацию и вещество указывает преподаватель).
Рассчитывают массу соли и объем воды, необходимые для приготовления 100 г раствора. Если данное вещество кристаллогидрат, то вычисляют, какая масса кристаллогидрата требуется для приготовления 100 г необходимого раствора в расчете на безводную соль.
Отвешивают расчетное количество измельченной соли в предварительно взвешенном стаканчике на технохимических весах с точностью до 0,01 г.
Отмеривают мерным цилиндром необходимый объем воды.
Выливают воду в стакан и растворяют в ней отвешенную соль.
Измеряют температуру приготовленного раствора, и если она не равна температуре, указанной в таблице 1, то доводят ее до указанной величины, нагревая или охлаждая раствор.
Выливают раствор в сухой (или ополоснутый этим раствором) высокий узкий цилиндр и опускают в него ареометр так, чтобы он не касался стенок сосуда. Отмечают деление шкалы, которое совпадает с уровнем жидкости в цилиндре, произведя отсчет по шкале сверху вниз, и записывают результат. Ареометр промывают водой, осторожно вытирают досуха. Раствор выливают в приготовленную склянку.
По найденной плотности, пользуясь справочником, определяют процентное содержание вещества в растворе. Если в таблице нет этой величины плотности, а есть немного меньшая и большая, то можно вычислить процентное содержание, используя метод интерполяции. Вычисление проводят по формуле:

Сравнивают полученную величину с заданной концентрацией раствора.
Рассчитывают молярность и нормальность приготовленного раствора.
Таблица 1. Плотность растворов NaCl при 20С
|
% |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
|
, г/мл |
1,0053 |
1,0125 |
1,0268 |
1,0413 |
1,0559 |
1,0707 |
1,0857 |
1,1009 |
1,1162 |
1,1319 |
1.2. Приготовление из раствора большей концентрации и воды (разбавление).
Необходимо приготовить из имеющегося раствора (полученного в опыте 1.1) раствор с меньшей процентной концентрацией, которую указывает преподаватель.
С учетом плотности исходного раствора рассчитывают его необходимый объем и объем воды для разбавления. Отмеривают цилиндром исходный раствор, выливают в чистый сухой стакан. Тем же цилиндром отмеривают воду для разбавления. Измеряют плотность полученного раствора ареометром, как описано выше, и определяют концентрацию полученного раствора.
Опыт №2. Стандартизация раствора соляной кислоты по тетраборату натрия.
В данном опыте необходимо установить точную концентрацию соляной кислоты титрованием стандартного раствора тетрабората натрия.
Разбавленный раствор Na2B4O7 можно рассматривать как раствор борной кислоты (К=5,83∙10-10), наполовину оттитрованный сильным основанием. Получается буферный раствор, состоящий из кислоты и сопряженного с ней основания:
В4О72– + 5Н2О = 2Н2ВО3– + 2Н3ВО3
При добавлении соляной кислоты в раствор соли протекает протолитическая реакция, и равновесие смещается в сторону образования борной кислоты:
Н2ВО3– + Н+ = Н3ВО3.
Суммарное уравнение титрования тетрабората натрия имеет вид:
В4О72– + 2Н+ + 5Н2О = 4 Н3ВО3
Таким образом, до начала титрования раствор соли имеет щелочную реакцию среды, а в точке эквивалентности рН раствора определяется присутствием кислоты, реакция среды кислая.
Опыт выполняется следующим образом.
Бюретку споласкивают раствором соляной кислоты.
Заполняют бюретку до нулевой отметки данным раствором. При этом следят, чтобы перед началом титрования носик бюретки был заполнен.
Пипеткой отбирают 10 мл стандартного раствора тетрабората натрия и переносят в коническую колбу для титрования емкостью 100 мл, добавляют цилиндром 20 мл дистиллированной воды, две-три капли метилового оранжевого и титруют до перехода окраски индикатора от желтой в бледно-розовую.
Титрование повторяют 3-4 раза и для расчета берут средний результат по объему раствора кислоты. Расхождение между результатами титрования не должно быть более 0,1 мл.
Все результаты титрования записывают в журнале:
Затем рассчитывают молярную концентрацию эквивалента (нормальность) раствора кислоты

и титр ТHCl по формуле:
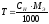 .
.
Найденную концентрацию стандартизованного раствора соляной кислоты используют при дальнейших расчетах.
ОБРАЗЕЦ ОФОРМЛЕНИЯ ПРОТОКОЛА ЗАНЯТИЯ
ДАТА________________
ТЕМА ЗАНЯТИЯ__________________________________________________
Цель работы______________________________________________________
Реактивы:________________________________________________________
Оборудование и посуда:_____________________________________________
Опыт №1. Приготовление ___%-ного раствора ____________
mнавески = _______
Vводы = _______
ρр-ра = ________
ωпракт. =
Опыт №1.2 Приготовление ___%-ного раствора ____________ путем разбавления
V1 р-ра= _______
Vводы = _______
ρр-ра = ________
ωпракт. = ______
Опыт №2. Стандартизация раствора соляной кислоты по тетраборату натрия.
СН (Na2B4O7) = _____
Vа (Na2B4O7) = _____
1-ое титрование V1 мл кислоты
2-ое титрование V2 мл кислоты
3-е титрование V3 мл кислоты.
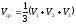 (мл).
(мл).

Контрольные вопросы и задачи.
Дайте определение следующих понятий: раствор, растворитель, насыщенный, ненасыщенный, пересыщенный раствор.
Как рассчитывается молярная масса эквивалента сложных веществ.
Способы выражения концентрации растворов. Формулы, единицы измерения.
Что такое титриметрический анализ? Назовите его достоинства.
Требования к реакциям в титриметрическом анализе.
Дайте классификацию титриметрических методов: по типу реакций, по приемам титрования.
Что такое стандартный раствор? Способы приготовления стандартных растворов. Требования, предъявляемые к веществам, используемым для приготовления стандартных растворов.
Что такое точка эквивалентности? Как она фиксируется?
В чем заключается сущность кислотно-основного титрования?
Как проводятся вычисления в титриметрическом анализе?
Определите молярную концентрацию эквивалента и титр раствора HCl, если на титрование 15 мл 0,5 н раствора NaOH было израсходовано 2 мл этого раствора кислоты.
Сколько соли и воды необходимо взять для приготовления 250 мл 15%-ного раствора хлорида натрия плотностью 1,12 г/мл?
Определите мольную долю растворенного вещества, а также молярность, нормальность, моляльность и титр следующих растворов: а) 20%-ной фосфорной кислоты (ρ=1,11 г/мл), б) 25%-ного гидроксида калия (ρ=1,24 г/мл).
