
- •Коррозия и методы защиты от нее
- •Классификация видов коррозии
- •Коррозия неметаллических материалов
- •Коррозия металлов
- •Типы коррозии
- •Электрохимическая коррозия
- •Коррозионный элемент
- •Деполяризация
- •Защита металлов от коррозии
- •Электрохимическая защита
- •Принцип действия электрохимической защиты
- •Катодная защита от коррозии
- •Анодная защита
Коррозия металлов
Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Типы коррозии
Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
1.

аааа++









 a)
a)
В некоторых металлах (Zn) катионы легко переходят в раствор; пластины заряжаются отрицательно, а раствор положительно.





 б)
б)


Катионы в растворе легко теряют гидратные оболочки и адсорбируются на поверхность металлов: металл +, раствор -.
Вывод: Металлы (рис. а) являются анодами по отношению к водородному электроду, а (рис. б) катодами.
Потенциалы газовых электродов Газовые электроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов. Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов.







Pt




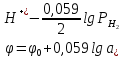
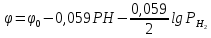
Потенциал водородного электрода зависит от РН.
Кислородный электрод:




Потенциал
кислородного электрода так же изменяется
при изменении

Электрохимическая коррозия
- наиболее распространенный вид коррозии металлов, это разрушение металла в среде электролита с возникновением внутри системы электрического тока. Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают по следующим причинам:
1. Наличие примесей металлов или других веществ, отличающихся по активности от основного металла.
2. Структурная неоднородность поверхности металла, что определяет наличие участков с разной активностью.
3. Неравномерность распределения деформаций в металле после термической и механической обработки и др.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный
- окисление металла:

и катодный - восстановление ионов водорода в кислой среде:
 или
или
молекул кислорода, растворенного в воде, в случае атмосферной коррозии:

Не следует путать электрохимическую коррозию с электрохимической коррозией однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
