
-
Метод валентных связей (вс);
-
Метод молекулярных орбиталей как линейной комбинации атомных орбиталей (мо лкао).
Теория валентных связей (ВС) исходит из представления: два центра – два электрона. Связи строго локализованы. Электроны распределяются по двуцентровым связывающим орбиталям или локализованы на отдельных атомах. В методе валентных связей образование связей является следствием взаимного проникновения (перекрывания) электронных атомных облаков.

Рис 7. Схема ковалентной связи
Метод молекулярных орбиталей как линейной комбинации атомных орбиталей (МО ЛКАО) вводит понятие молекулярной орбитали, когда электроны делокализованы по всей молекуле. МО – это область с высокой электронной плотностью. Образование молекулярной орбитали разрешено, если орбитали совместимы по симметрии, если перекрывание атомных орбиталей (АО) значительно (Если имеется синфазная комбинация колебаний электронов, то в результате интерференции будет наблюдаться усиление амплитуды, а если комбинация противофазных колебаний, то будет происходить взаимное гашение волн). и образование МО значительно, если две АО близки по энергиям. (Поэтому МО из атомных орбиталей 1s и 1s более вероятны и прочны, чем из 1s и 4s).
При образовании молекулярных орбиталей их число равно числу исходных атомных орбиталей. Для МО выполняется принцип Паули.
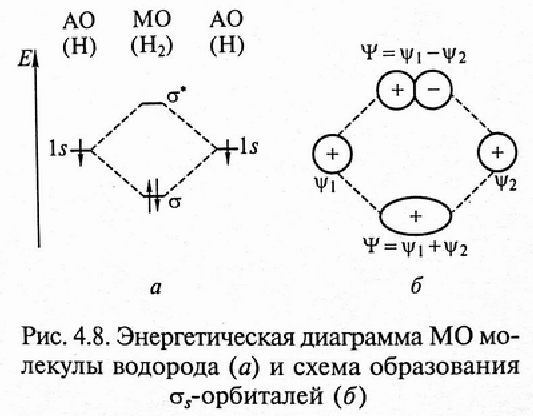
Исходя из уравнения
Шредингера, при образовании молекулы
водорода из двух атомов водорода с
1s-орбиталями образуется две МО Н2:
синфазная, или связывающая (с минимумом
энергии) и противофазная, или разрыхляющая
(похожа на гиперболу в первой четверти
декартовых координат). Синфазная
связывающая МО называется σ –связью,
которая симметрична относительно линии
связи (она заполнена двумя электронами).
Противофазная разрыхляющая σ*-связь
симметрична относительно линии связи
и имеет узловую плоскость между ядрами.
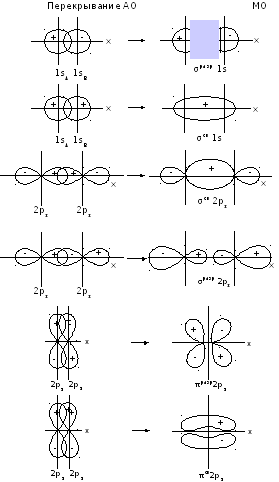
Рис. 5.3. Схемы образования некоторых МО
 σ-связи
в молекуле бензола
σ-связи
в молекуле бензола
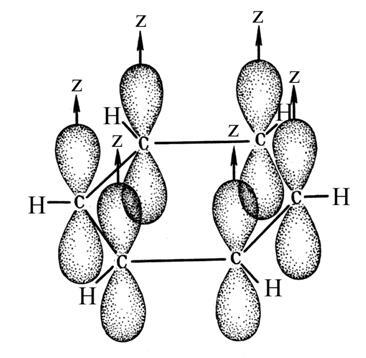 Расположение
р-электронных
облаков в молекуле бензола
Расположение
р-электронных
облаков в молекуле бензола
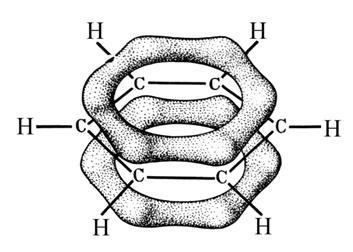 π-связи
в молекуле бензола
π-связи
в молекуле бензола
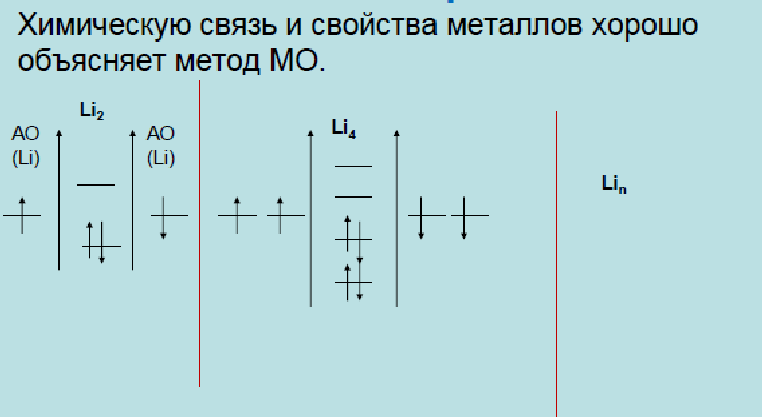
Метод МО ЛКАО легко объясняет существование молекулы Li2 в газовой фазе (МО связывающая занята двумя электронами, а МО разрыхляющая пустая). Для бериллия не существует молекулы Ве2 (в такой молекуле на связывающей МО два электрона и на разрыхляющей МО два электрона, что является причиной нестабильности молекулы).
Р-орбитали могут перекрываться с образованием следующих связей: σ, σ*, π, π*. Самая низкая энергия (самая прочная связь) у σ, немного выше у π, выше у π*, самая высокая у σ*. π и π*-связи являются ассиметричными, они меняют знак при повороте вокруг оси, соединяющей взаимодействующие ядра.


молекула азота

Молекулу фтора легко описать как моделью ВС Льюиса, так и с помощью МО. Электроны предвалентного уровня заполняют и связывающие, и разрыхляющие орбитали, поэтому связи не образуется. Только одна σ-связь валентного уровня не компенсируется σ*-связью, потому связь в молекуле фтора одинарная.(По ВС у каждого атома по одному неспаренному электрону).
С точки зрения структур Льюиса (ВС) легко объяснить двойную связь О2 спариванием двух пар электронов, но нельзя объяснить парамагнитные свойства О2, которые свидетельствуют о наличии неспаренных электронов. В молекуле кислорода из шести р-АО образуются шесть МО: полностью заполнены одна σ-связь и две π-связи. Поскольку две π*-связи являются вырожденными, то по правилу Хунда на каждой π* МО имеется по одному электрону. σ* МО полностью свободна.
Из-за близости энергий 2s- и 2р-орбиталей в атомах, возможно смешивание МО и σ-π-взаимодействие, приводящее к обращению последовательности орбиталей (σ-связь находится выше π-связи в молекуле азота).
При создании гетероядерных молекул, т.е. образующихся из атомов различных элементов, с точки зрения ВС Льюиса, полярная ковалентная или ионно-ковалентная связь образуется по правилу октета для приобретения атомом в молекуле конфигурации инертного газа.
С точки зрения МО ЛКАО, при образовании, например, гидрида лития LiН σ МО находится ближе по энергии к орбитали атома водорода, чем лития (электроны больше времени ассоциированы с ядром. водорода.
При образовании фторида водорода при взаимодействии 1s АО водорода и 2р АО фтора возникает не связывающая МО, которая по энергии равна 2р АО фтора. Не связывающая МО не влияет на порядок связи в молекуле.



Уровень Ферми (электрохим. потенциал, хим. потенциал) — некоторый условный уровень, соответствующий энергии Ферми системы фермионов; в частности электронов твердого тела, играет роль химического потенциала для незаряженных частиц. Статистический смысл уровня Ферми — при любой температуре его заселенность равна 1/2.
В металлах уровень Ферми – внутри области перекрывания валентной зоны и зоны проводимости.
В собственных полупроводниках ( и в примесных при Т=0 К) уровень Ферми – на середине запрещенной зоны. В электронных полупроводниках уровень Ферми – в запрещенной зоне вблизи дна зоны проводимости, в дырочных полупроводниках уровень Ферми – в запрещенной зоне вблизи потолка валентной зоны.
Структури металів. Металічний зв'язок. Електронний газ. Зонна теорія. Хімічний зв'язок в напівпровідниках.
Электроотрицательность по Полингу χп – способность атома в молекуле оттягивать электроны на себя. χп(Н)=2.2 ,χп(К)=0.8, χп(F)=4.0. Чем больше χп , тем выше способность атома перетягивать к себе электроны в молекуле. Фтор – самый электроотрицательный элемент. χп(О)=3.4. Величина электроотрицательности данного элемента возрастает с увеличением его положительной степени окисления (с увеличением его окисленности): Sn4+ более электроотрицателен, чем Sn2+ и еще более электроотрицателен, чем Sn. Порядок связи незначительно влияет на χп.
Связь ковалентная неполярная, если для двух атомов относительная электроотрицательность Δχп=0
связь ковалентная полярная (либо ионно-ковалентная или ковалентно-ионная), если для двух атомов 1.8 >Δχп>0
связь ионная, если для двух атомов Δχп >1.8
Двухатомные гетероядерные молекулы обладают дипольным моментом μ=nеV [Кл.м], где n – число электронов или частей электрона, которые один атом «отдал» другому по сравнению с гомоядерной связью; е – заряд электрона (у=1,602.10-19 Кл), V – расстояние между зарядами.
Геометрия (строение) многоатомных молекул. Молекулы могут быть линейными (СО2, НСN), но большинство многоатомных молекул нелинейно. Геометрия молекул: угловая (Н2Об SnCl2) плоскотреугольная (АlCl3), тетраэдрическая (SiCl4). Молекулы могут иметь более одного центра. Координационное число – число соседних атомов или групп атомов. Метод предсказания и объяснения строения молекул и ионов дает теория Гиллеспи: геометрию молекулы или иона определяют только валентные электроны: для достижения стабильности пары валентных электронов должны находиться на максимальном расстоянии друг от друга, что соответствует минимуму межэлектронного отталкивания. Каждая пара электронов представляется в виде отрицательного точечного заряда, который помещается на поверхности некоей сферы.
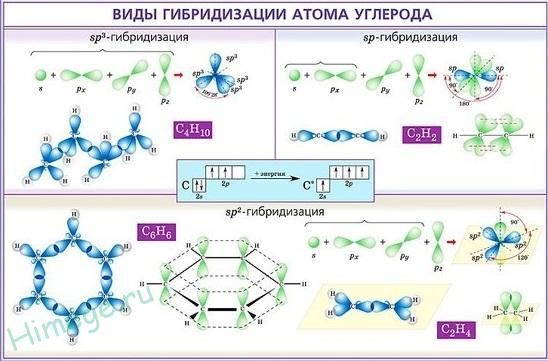
В рамках теории ВС предложен метод, который позволяет моделировать пространственное направление орбиталей, необходимое для образования локализованных связей – гибридизация. sp-гибридизация (линейная структура)- из одной s и одной р- орбитали образуются две гибридные орбитали, sp2-гибридизация (плоскотреугольная структура), sp3-гибридизация (тетраэдрическая структура).
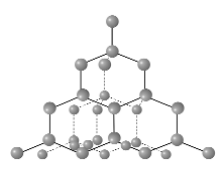
Рис 8. Структура алмаза (sp3 - гибридизация)
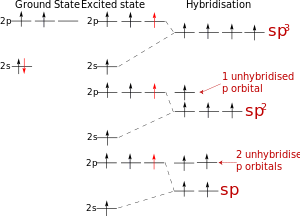
Схема гибридизации атомных орбиталей атома углерода
 При
определении геометрической формы
химической частицы следует учитывать,
что пары внешних электронов центрального
атома, в том числе и не образующие
химическую связь, располагаются в
пространстве как можно дальше друг от
друга.
При
определении геометрической формы
химической частицы следует учитывать,
что пары внешних электронов центрального
атома, в том числе и не образующие
химическую связь, располагаются в
пространстве как можно дальше друг от
друга.
При рассмотрении ковалентных химических связей нередко используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация является формальным приемом, применяемым для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
В результате гибридизации появляются новые гибридные орбитали (рис.24), которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
ТИПЫ ГИБРИДИЗАЦИИ
|
Тип гибридизации |
Геометрическая форма |
Угол между связями |
Примеры |
|
sp |
линейная |
180o |
BeCl2 |
|
sp2 |
треугольная |
120o |
BCl3 |
|
sp3 |
тетраэдрическая |
109,5o |
CH4 |
|
sp3d |
тригонально-бипирамидальная |
90o; 120o |
PCl5 |
|
sp3d2 |
октаэдрическая |
90o |
SF6 |

В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары. Например, молекула воды содержит две ковалентные химические связи между атомом кислорода и двумя атомами водорода.
П омимо
двух пар электронов, общих с атомами
водорода, у атома кислорода имеются две
пары внешних электронов, не участвующих
в образовании связи (неподеленные
электронные пары). Все четыре пары
электронов занимают определенные
области в пространстве вокруг атома
кислорода.
Поскольку электроны
отталкиваются друг от друга, электронные
облака располагаются на возможно большем
расстоянии друг от друга. При этом в
результате гибридизации меняется форма
атомных орбиталей, они вытянуты и
направлены к вершинам тетраэдра. Поэтому
молекула воды имеет угловую форму, а
угол между связями кислород-водород
равен 104,5o.
омимо
двух пар электронов, общих с атомами
водорода, у атома кислорода имеются две
пары внешних электронов, не участвующих
в образовании связи (неподеленные
электронные пары). Все четыре пары
электронов занимают определенные
области в пространстве вокруг атома
кислорода.
Поскольку электроны
отталкиваются друг от друга, электронные
облака располагаются на возможно большем
расстоянии друг от друга. При этом в
результате гибридизации меняется форма
атомных орбиталей, они вытянуты и
направлены к вершинам тетраэдра. Поэтому
молекула воды имеет угловую форму, а
угол между связями кислород-водород
равен 104,5o.
Для предсказания типа гибридизации удобно использовать донорно-акцепторный механизм образования связи: происходит перекрывание пустых орбиталей менее электроотрицательного элемента и орбиталей более электроотрицательного элемента с находящимися на них парами электронов. При составлении электронных конфигураций атомов учитывают их степени окисления − условное число, характеризующее заряд атома в соединении, рассчитанный исходя из предположения ионного строения вещества.
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
находят центральный атом и определяют число σ-связей (по числу концевых атомов);
определяют степени окисления атомов в частице;
составляют электронную конфигурацию центрального атома в нужной степени окисления;
если это необходимо, проделывают то же самое для концевых атомов;
изображают схему распределения валентных электронов центрального атома по орбиталям, при этом, вопреки правилу Хунда, максимально спаривают электроны;
отмечают орбитали, участвующие в образовании связей с концевыми атомами;
определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней;
по типу гибридизации определяют геометрию химической частицы.
Наличие π-связей не влияет на тип гибридизации. Однако наличие дополнительного связывания может привести к изменению валентных углов, поскольку электроны кратных связей сильнее отталкиваются друг от друга. По этой причине, например, валентный угол в молекуле NO2 (sp2-гибридизация) увеличивается от 120o до 134o.
К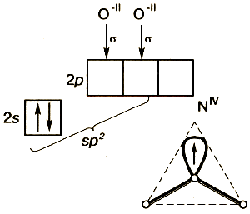 ратность
связи азот−кислород в этой молекуле
равна 1,5, где единица отвечает одной
σ-связи, а 0,5 равно отношению числа
орбиталей атома азота, не участвующих
в гибридизации (1) к числу оставшихся
активных электронных пар у атома
кислорода, образующих π-связи (2). Таким
образом, наблюдается делокализация
π-связей (делокализованные связи −
ковалентные связи, кратность которых
не может быть выражена целым числом).
ратность
связи азот−кислород в этой молекуле
равна 1,5, где единица отвечает одной
σ-связи, а 0,5 равно отношению числа
орбиталей атома азота, не участвующих
в гибридизации (1) к числу оставшихся
активных электронных пар у атома
кислорода, образующих π-связи (2). Таким
образом, наблюдается делокализация
π-связей (делокализованные связи −
ковалентные связи, кратность которых
не может быть выражена целым числом).
В случае sp, sp2, sp3, sp3d2 гибридизации вершины в многограннике, описывающем геометрию химической частицы, равноценны, и поэтому кратные связи и неподеленные пары электронов могут занимать любые из них. Однако sp3d-гибридизации отвечает тригональная бипирамида, в которой валентные углы для атомов, расположенных в основании пирамиды (экваториальной плоскости), равны 120o, а валентные углы с участием атомов, расположенных в вершинах бипирамиды, равны 90o. Эксперимент показывает, что неподеленные электронные пары всегда располагаются в экваториальной плоскости тригональной бипирамиды. На этом основании делается вывод, что они требуют больше свободного пространства, чем пары электронов, участвующие в образовании связи. Примером частицы с таким расположением неподеленной электронной пары является тетрафторид серы (рис. 27). Если центральный атом одновременно имеет неподеленные пары электронов и образует кратные связи (например, в молекуле XeOF2), то в случае sp3d-гибридизации именно они располагаются в экваториальной плоскости тригональной бипирамиды (рис. 28).
Дипольные моменты молекул
Идеальная ковалентная связь существует лишь в частицах, состоящих из одинаковых атомов (Н2, N2 и т.д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, то есть происходит поляризация связи. Характеристикой полярности связи служит ее дипольный момент.
Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических связей (с учетом наличия неподеленных пар электронов). Если полярные связи расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой диоксида углерода. Многоатомные молекулы с несимметричным расположением полярных связей (и, следовательно, электронной плотности) являются в целом полярными. Это относится, в частности, к молекуле воды.
Н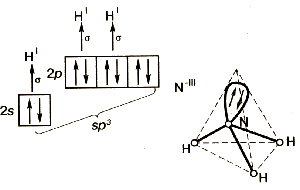 а
результирующее значение дипольного
момента молекулы может повлиять
неподеленная пара электронов. Так,
молекулы NH3
и NF3
имеют тетраэдрическую геометрию (с
учетом неподеленной пары электронов).
Степени ионности связей азот−водород
и азот−фтор составляют 15 и 19%,
соответственно, а их длины - 101 и 137 пм,
соответственно. Исходя из этого, можно
было бы сделать вывод о большем дипольном
моменте NF3.
Однако эксперимент показывает обратное.
При более точном предсказании дипольного
момента следует учитывать направление
дипольного момента неподеленной пары
(рис. 29).
а
результирующее значение дипольного
момента молекулы может повлиять
неподеленная пара электронов. Так,
молекулы NH3
и NF3
имеют тетраэдрическую геометрию (с
учетом неподеленной пары электронов).
Степени ионности связей азот−водород
и азот−фтор составляют 15 и 19%,
соответственно, а их длины - 101 и 137 пм,
соответственно. Исходя из этого, можно
было бы сделать вывод о большем дипольном
моменте NF3.
Однако эксперимент показывает обратное.
При более точном предсказании дипольного
момента следует учитывать направление
дипольного момента неподеленной пары
(рис. 29).
Ван-дер-Ваальсовы силы. Кроме рассмотренных типов химической связи говорят
также о сравнительно слабых силах Ван_дер_Ваальса. В 1873 г. было выдвинуто предположение о существовании сил межмолекулярного притяжения, подобных тем, что существуют в связях между атомами. В дальнейшем гипотеза подтвердилась – были открыты различные типы межмолекулярного взаимодействия, где наиболее распространено так называемое диполь- дипольное притяжение. Некоторые молекулы (преимущественно с ковалентными связями) обладают дипольным моментом, поскольку в одной части молекулы “скапливается” больше электронов, чем в другой. Это приводит к возникновению разности потенциалов на ее концах. Сила притяжения между различными зарядами связывает молекулы между собой, как показано на рисунке 9. В настоящий момент термин “Ван-дер-Ваальсовы силы” распространяется на все слабые межмолекулярные силы, кроме водородной связи.
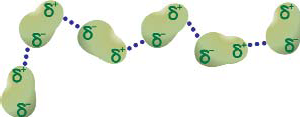
Рис 9. Схема диполь-дипольного притяжения
Водородная связь. Несмотря на то, что водородная связь, возникающая вследствие силы притяжения между атомом водорода и электроотрицательным атомом, представляет собой предельный случай диполь-дипольного притяжения, ее, как правило, не относят к силам Ван-дер-Ваальса. Во-первых, потому что она гораздо сильнее обычных межмолекулярных связей, а во-вторых, потому что она может возникать и в
виде внутримолекулярных связей (рис 10). Именно водородные связи объясняют многие уникальные свойства воды и льда (рис 11).
 .
.
Рис 10. Схема водородной связи в молекуле ДНК
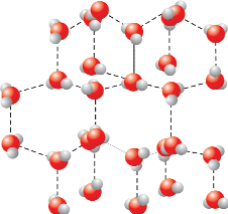
Рис 11. Схема водородной связи в кристалле льда
Тема 1.3. Іони. Карти електронної густини. Енергія іонізації та тенденції її зміни в межах періоду та групи. Послідовні енергії іонізації атомів. Спорідненість до електрона. Електростатична взаємодія між іонами. Іонні кристалічні решітки. Координаційне число. Іонний радіус. Тенденції зміни іонних радіусів в межах груп і періодів. Енергія іонної решітки. Поляризація іонів. Структури металів. Металічний радіус. Металічний зв'язок. Електронний газ. Зонна теорія. Хімічний зв'язок в напівпровідниках.
Ионы – результат полного перетягивания электронов от одного атома к другому. Электроотрицательные атомы склонны перетягивать на себя электрон полностью, становясь анионами. Атомы, обладающие малой электроотрицательностью, склонны полностью отдавать электроны, становясь катионами. Связь ионная, если для двух атомов относительная электроотрицательность Δχп >1.8. Между ионами наблюдается сильное электростатическое взаимодействие, которое зависит только от расстояния, но не от направления в пространстве. Большинство химических связей в природе ионно-ковалентные или ковалентно-ионные. Карты электронной плотности состоят из изолиний, которые соединяют точки с одинаковой электронной плотностью. Идеализированная карта электронной плотности - смежные системы концентрических окружностей.
Энергия (потенциал) ионизации. Первая энергия ионизации атома, находящегося в газовой фазе, - это изменение его внутренней энергии при 0 К (ΔU(0 К)), происходящее при удалении первого валентного электрона. Вторая и третья энергии ионизации – для второго и третьего электронов, соответственно. Энергия ионизации примерно равна энтальпии ионизации при стандартных условиях (ΔU(0 К) ≈ ΔН(298 К). В рамках малого периода энергия ионизации растет с увеличением порядкового номера элемента, поскольку уменьшается эффективный заряд ядра с увеличением числа электронов в оболочке. В пределах группы, энергия ионизации уменьшается с ростом порядкового номера элемента, поскольку усиливается экранирование ядра электронами.
Сродство к электрону (ЕА). Первая энергия сродства к электрону (ЕА) равна уменьшению внутренней энергии (ΔU(0 К)) при присоединении одного электрона газообразным атомом (ΔU(0 К) ≈ ΔН(298 К) = - ЕА). Вторая и третья и т. д. энергии сродства к электрону связаны с уменьшением внутренней энергии при присоединении второго, третьего и т. д. ионов, соответственно.
Электростатическое взаимодействие между ионами - это кулоновское взаимодействие между точечными зарядами, какими удобно представлять сферически-симметричные ионы. Следовательно, катионы взаимно отталкиваются и анионы взаимно отталкиваются, но катионы и анионы взаимно притягиваются. Отсюда следует хрупкость кристаллической ионной решетки (при сдвиге одной кристаллической плоскости относительно другой катион приближается к катиону, а анион – к аниону)(Рис. 13).

Рис 12. Модель кристаллической решетки хлорида натрия
Ионный радиус. В рамках электростатической теории ионы рассматриваются как сферы конечных размеров. Величины ионных радиусов получают из данных рентгеновской дифракции. Ионные радиусы меняются при изменении координационных чисел ионов. Радиус иона железа три плюс Fe3+ меньше радиуса железа два плюс Fe2+, так как у первого больше эффективный положительный заряд ядра, действующий на каждый электрон. В пределах группы с увеличением заряда ядра ионные радиусы увеличиваются
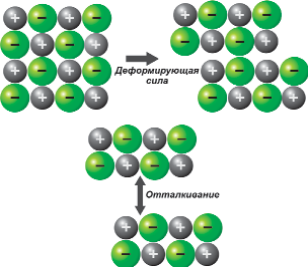
Рис 13. Схема поведения кристаллической решетки NaCl под действием деформирующей силы
Металлическая связь. Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью. Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.

Рис 14. Кристаллическая решетка металла. Показана траектория одного из свободно движущихся электронов
Электроны в металлах делокализованы, то есть не принадлежат какому-либо конкретному атому. Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов. Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов (рис. 15).
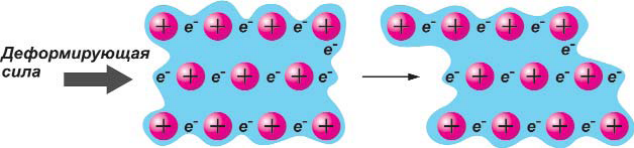
Рис 15. Действие деформирующей силы на кристаллическую решетку металла
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью. Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой электрический ток.
