- •13.Использование мутационных дефектов регуляции микробного метаболизма с целю получения сверхпродуцентов бав.
- •14. Способы выделения мутантных штаммов с дефектами метаболитической регуляции.
- •15. Влияние проницаемости клеточных мембран на контроль микробного метаболизма.
- •18. Биохимические механизмы потребления углеводов. Их регуляция.
- •19. Ассимиляция н-алканов микроорганизмами.
- •20. Биохимические механизмы утилизации ароматических углеводородов.
- •25. Биохимические механизмы потребления метана,метанолы,формальдегида:ростовая модель.
20. Биохимические механизмы утилизации ароматических углеводородов.
Ароматические углеводороды содержат в молекуле
бензольное
ароматическое кольцо С6. Примером
простейшего ароматического углеводорода
является бензол:
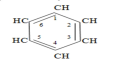 При
замене атомов водорода в молекуле
бензола получаютсяего производные с
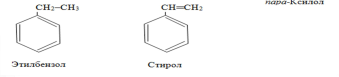
одним заместителем, например:
При
замене атомов водорода в молекуле
бензола получаютсяего производные с
одним заместителем, например: с
двумя и более заместителями, например:
с
двумя и более заместителями, например: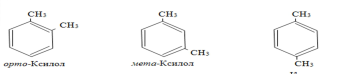
 Большинство
ароматических углеводородов расщепляется
бактериями сначала докатехола
или
прокатеховой
кислоты.Как
правило, ароматические углеводороды,
имеющие заместители по первому и второму
С-атомам (например,салициловая кислота)
превращаются в катехол:
Большинство
ароматических углеводородов расщепляется
бактериями сначала докатехола
или
прокатеховой
кислоты.Как
правило, ароматические углеводороды,
имеющие заместители по первому и второму
С-атомам (например,салициловая кислота)
превращаются в катехол:
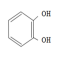 Многие
незамещенные ароматические углеводороды
(такие как бензол и нафталин) разлагаются
через образование 1,2-дифенольных
соединений также до катехола.
Ароматические
углеводороды, несущие заместители в
Многие
незамещенные ароматические углеводороды
(такие как бензол и нафталин) разлагаются
через образование 1,2-дифенольных
соединений также до катехола.
Ароматические
углеводороды, несущие заместители в
положении
1,3 или 1,4 (например, 3-гидроксибензоат и
4-гидроксибензоат), а также полузамещенные
ароматические соединения метаболизируются
через образование прокатеховой кислоты:
 Следующим
этапом расщепления ароматических
углеводородов является расщепление
образованных молекул катехола и
прокатеховой кислоты под действием
диоксигеназ двух типов.
Одни
диоксигеназы разрывают ароматическое
кольцо между двумя гидроксилированными
атомами углерода (орто-расщепление):
Следующим
этапом расщепления ароматических
углеводородов является расщепление
образованных молекул катехола и
прокатеховой кислоты под действием
диоксигеназ двух типов.
Одни
диоксигеназы разрывают ароматическое
кольцо между двумя гидроксилированными
атомами углерода (орто-расщепление):
 Далее
образовавшиеся приорто-расщеплении
катехола и прокатеховой кислоты
промежуточные продукты – цис,
цис-муконовая
кислота и 3-карбокси-цис,
цис-муконовая
кислота – входе дальнейшего катаболизма
проходят через этап общего для них обоих
продукта – 3-оксоадипиновой кислоты.
Последняя активируется КоА-трансферазой
и расщепляется с образованием сукцинил-КоА
и ацетил-КоА, которые подвергаются
дальнейшим превращениям в ходе
промежуточного метаболизма. В более
редких случаях диоксигеназы (второго
типа) расщепляют ароматическое кольцо
не между гидроксилированными атомами
углерода (как при орто-расщеплении),
а между гидроксилированным и
негидроксилированным атомами углерода
Далее
образовавшиеся приорто-расщеплении
катехола и прокатеховой кислоты
промежуточные продукты – цис,
цис-муконовая
кислота и 3-карбокси-цис,
цис-муконовая
кислота – входе дальнейшего катаболизма
проходят через этап общего для них обоих
продукта – 3-оксоадипиновой кислоты.
Последняя активируется КоА-трансферазой
и расщепляется с образованием сукцинил-КоА
и ацетил-КоА, которые подвергаются
дальнейшим превращениям в ходе
промежуточного метаболизма. В более
редких случаях диоксигеназы (второго
типа) расщепляют ароматическое кольцо
не между гидроксилированными атомами
углерода (как при орто-расщеплении),
а между гидроксилированным и
негидроксилированным атомами углерода
(мета-расщепление):
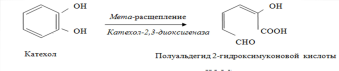
 Образованные
полуальдегиды затем превращаются в
пируват,ацетальдегид, оксалоацетат,
фумарат, ацетоацетат, сукцинат или иные
вещества, вовлекаемые в промежуточный
метаболизм.Микроорганизмы, способные
окислять углеводороды, широко
распространены в почвах и водах.Они
приобрели большое практическое значение,
в первую очередь, для биологической
очистки почв и водоемов от загрязнений
нефтью и продуктами ее пeреработки.
Утилизировать нефть и продукты ее
переработки в качестве источников
углерода и энергии способны представители
родов Pseudomonas,
Mycobacterium,
Alcaligenes,
Bacillus,Acinetobacter,
Arthrobacter,
Rhodococcus,
Flavobacterium,Caulobacter
и
др.С участием микроорганизмов
осуществляется восстановление исходного
статуса (биоремедиация) загрязненных
территорий.Выращивая на нефтяных отходах
дрожжи рода Candida,получают
из непищевого сырья дешевый
белково-витаминный концентрат для
подкормки сельскохозяйственных животных.
Образованные
полуальдегиды затем превращаются в
пируват,ацетальдегид, оксалоацетат,
фумарат, ацетоацетат, сукцинат или иные
вещества, вовлекаемые в промежуточный
метаболизм.Микроорганизмы, способные
окислять углеводороды, широко
распространены в почвах и водах.Они
приобрели большое практическое значение,
в первую очередь, для биологической
очистки почв и водоемов от загрязнений
нефтью и продуктами ее пeреработки.
Утилизировать нефть и продукты ее
переработки в качестве источников
углерода и энергии способны представители
родов Pseudomonas,
Mycobacterium,
Alcaligenes,
Bacillus,Acinetobacter,
Arthrobacter,
Rhodococcus,
Flavobacterium,Caulobacter
и
др.С участием микроорганизмов
осуществляется восстановление исходного
статуса (биоремедиация) загрязненных
территорий.Выращивая на нефтяных отходах
дрожжи рода Candida,получают
из непищевого сырья дешевый
белково-витаминный концентрат для
подкормки сельскохозяйственных животных.
21. Биохимические механизмы потребления этанола, их регуляция. МЕТАБОЛИЗМ ЭТАНОЛА В ПЕЧЕНИКатаболизм этилового спирта осуществляется главным образом в печени. Здесь окисляется от 75% до 98% введённого в организм этанола.Окисление алкоголя - сложный биохимический процесс, в который вовлекаются основные метаболические процессы клетки. Превращение этанола в печени осуществляется тремя путями с образованием токсического метаболита - ацетальдегида (рис. 12-22).А. Окисление этанола NAD-зависимой алкогольдегидрогеназойОсновную роль в метаболизме этанола играет цинксодержащий NAD+- зависимый фермент - алкогольдегидрогеназа, локализующаяся в основном в цитозоле и митохондриях печени (95%). В ходе реакции происходит дегидрирование этанола, образуются ацетальдегид и восстановленный кофермент NADH.
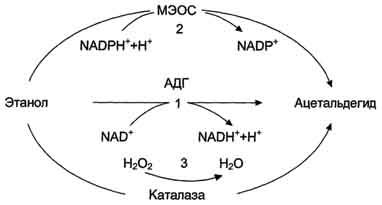
Рис. 12-22. Метаболизм этанола. 1 - окисление этанола NAD+ - зависимой алкогольдегидрогеназой (АДГ); 2 - МЭОС - микросомальная этанолокисляющая сисгема; 3 - окисление этанола каталазой.Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD+ в клетке.С2Н5ОН + HAD+ ↔ СН3СНО + NADH + H+.Фермент алкогольдегидрогеназа - димер, состоящий из идентичных или близких по первичной структуре полипептидных цепей, кодируемых аллелями одного гена. Существуют 3 изоформы алкогольдегидрогеназы (АДГ): АДГ1, АДГ2, АДГ3, различающиеся по строению протомеров, локализации и активности. Для европейцев характерно присутствие изоформ АДГ1 и АДГ3. У некоторых восточных народов преобладает изоформа АДГ2, характеризующаяся высокой активностью, это может быть причиной их повышенной чувствительности к алкоголю. При хроническом алкоголизме количество фермента в печени не увеличивается, т.е. он не является индуцируемым ферментом.Б. Окисление этанола при участии цитохром Р450 - зависимой микросомальной этанолокисляющей системы системыЦитохром Р450-зависимая микросомальная этанолокисляющая сисгема (МЭОС) локализована в мембране гладкого ЭР гепатоцитов. МЭОС играет незначительную роль в метаболизме небольших количеств алкоголя, но индуцируется этанолом, другими спиртами, лекарствами типа барбитуратов и приобретает существенное значение при злоупотреблении этими веществами. Этот путь окисления этанола происходит при участии одной из изоформ Р450 - изофермента Р450 II E1. При хроническом алкоголизме окисление этанола ускоряется на 50 - 70% за счёт гипертрофии ЭР и индукции цитохрома Р450 II E1.С2Н5ОН + NADPH + Н+ + О2 → СН3СНО + NADP+ + 2Н2О.Кроме основной реакции, цитохром Р450 катализирует образование активных форм кислорода (О2-, Н2О2), которые стимулируют ПОЛ в печени и других органах (см. раздел 8).В. Окисление этанола каталазойВторостепенную роль в окислении этанола играет каталаза, находящаяся в пероксисомах цитоплазмы и митохондрий клеток печени. Этот фермент расщепляет примерно 2% этанола, но при этом утилизирует пероксид водорода.СН3СН2ОН + Н2О2 → СН3СНО + 2Н2О.Г. Метаболизм и токсичность ацетальдегидаАцетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты двумя ферментами: FAD -зависимой альдегидоксидазой и NAD+ -зависимой ацетальдегиддегидрогеназой (АлДГ).СН3СНО + О2 + H2O → СН3СООН + Н2О2 .Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента алъдегидоксидазы. В ходе реакции образуются уксусная кислота, пероксид водорода и другие активные формы кислорода, что приводит к активации ПОЛ.Другой фермент ацетальдегиддегидрогеназа (АлДГ) окисляет субстрат при участии кофермента NAD+.СН3СНО + Н2О + NAD+ → СН3СООН + NADH + H+.Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации окса-лоацетата в митохондриях гепатоцитов, может "сгорать" в ЦТК, идти на синтез жирных кислот или кетоновых тел.В разных тканях организма человека встречаются полиморфные варианты АлДГ. Они характеризуются широкой субстратной специфичностью, разным распределением по клеткам тканей (почки, эпителий, слизистая оболочка желудка и кишечника) и в компартментах клетки. Например, изоформа АлДГ, локализованная в митохондриях гепатоцитов, обладает более высоким сродством к ацетальдегиду, чем цитозольная форма фермента.Ферменты, участвующие в окислении этанола, - алкогольдегидрогеназа и АлДГ по разному распределены: в цитозоле - 80%/20% и митохондриях - 20%/80%. При поступлении больших доз алкоголя (более 2 г/кг) из-за разных скоростей окисления этанола и ацетальдегида в цитозоле резко повышается концентрация последнего. Ацетальдегид - очень реакционно-способное соединение; он неферментативно может ацетилировать SH-, NH2- группа белков и других соединений в клетке и нарушать их функции. В модифицированных (ацетилированных) белках могут возникать "сшивки", нехарактерные для нативной структуры (например, в белках межклеточного матрикса - эластине и коллагене, некоторых белках хроматина и липопротеинов, формирующихся в печени). Ацетилирование ядерных, цитоплазматических ферментов и структурных елков приводит к снижению синтеза экспортируемых печенью в кровь белков, например альбумина, который, удерживая Na+, поддерживает коллоидно-осмотическое давление, а также участвует в транспорте многих гидрофобных веществ в крови (см. раздел 14). Нарушение функций альбумина в сочетании с повреждающим действием ацетальдегида на мембраны сопровождается поступлением в клетки по градиенту концентрации ионов натрия и воды, происходит осмотическое набухание этих клеток и нарушение их функций.Активное окисление этанола и ацетальдегида приводит к увеличению отношения NADH/NAD+, что снижает активность NAD+-зависимых ферментов в цитозоле и менее значительно в митохондриях.Равновесие следующей реакции смещается вправо:Дигидроксиацетонфосфат + NADH + Н+ ↔ Глицерол-3-фосфат + NAD+,Пируват + NADH + Н+ ↔ Лактат + NAD+.Восстановление дигидроксиацетонфосфата, промежуточного метаболита гликолиза и глюконеогенеза, приводит к снижению скорости глюконеогенеза. Образование глицерол-3-фосфата повышает вероятность синтеза жира в печени. Увеличение концентрации NADH по сравнению с NAD+ (NADH>NAD+) замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват и ещё больше снижается скорость глюконеогенеза (см. раздел 7). В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу (рис. 12-23).NADH окисляется ферментом дыхательной цепи NADH-дегидрогеназой. Возникновение трансмембранного электрического потенциала на внутренней митохондриальной мембране не приводит к синтезу АТФ в полном объёме. Этому препятствует нарушение структуры внутренней мембраны митохондрий, вызванное мемб-ранотропным действием этилового спирта и повреждающим действием ацетальдегида на мембраны.Можно сказать, что ацетальдегид опосредованно активирует ПОЛ, так как связывая SH-группы глутатиона, он снижает количество активного (восстановленного) глутатиона в клетке,
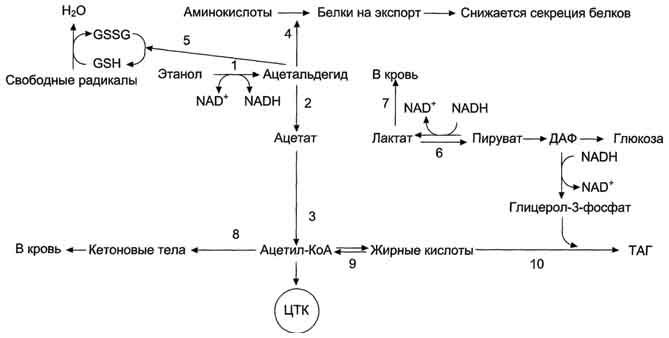
Рисунок 12-23. Эффекты этанола в печени. 1 → 2 → 3 - окисление этанола до ацетата и превращение его в ацетил-КоА (1 - реакция катализируется алкогольдегидрогеназой, 2 - реакция катализируется АлДГ). Скорость образования ацетальдегида (1)часто при приёме большого количества алкоголя выше, чем скорость его окисления (2), поэтому ацетальальдегид накапливается и оказывает влияние на синтез белков (4), ингибируя его, а также понижает концентрацию восстановленного глутатиона (5), в результате чего активируется ПОЛ. Скорость глюконеогенеза (6) снижается, так как высокая концентрация NADH, образованного в реакциях окисления этанола (1, 2), ингибирует глюконеогенез (6). Лактат выделяется в кровь (7), и развивается лактоацидоз. Увеличение концентрации NADH замедляет скорость ЦТК; ацетил-КоА накапливается, активируется синтез кетоновых тел (кетоз) (8). Окисление жирных кислот также замедляется (9), увеличивается синтез жира (10), что приводит к ожирению печени и гипертриацилглицеролемии.который необходим для функционирования фермента глутатионпероксидазы (см. раздел 8), участвующего в катаболизме Н2О2. Накопление свободных радикалов приводит к активации ПОЛ мембран и нарушению структуры липидного бислоя.На начальных стадиях алкоголизма окисление ацетил-КоА в ЦТК - основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот. Этот процесс, помимо АТФ, требует участия NADPH, который образуется при окислении глюкозы в пентозофосфатном цикле. Из жирных кислот и глицерол-3-фосфата образуются ТАГ, которые в составе ЛПОНП секретируются в кровь. Повышенная продукция ЛПОНП печенью приводит к гипертриацилглицеролемии. При хроническом алкоголизме снижение синтеза фосфолипидов и белков в печени, в том числе и апобелков, участвующих в формировании ПОНП, вызывает внутриклеточное накопление ТАГ и ожирение печени.Однако в период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идёт на синтез кетоновых тел, которые выходят в кровь. Повышение в крови концентрации лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации.Как уже было сказано ранее, реакция образования ацетальдегида из этанола протекает под действием алкогольдегидрогеназы. Поэтому при повышении концентрации ацетальдегида и NADH в клетках печени направление реакции меняется - образуется этанол. Этанол - мембранотропное соединение, он растворяется в липидном бислое мембран и нарушает их функции. Это негативно отражается на трансмембранномпереносе веществ, межклеточных контактах, взаимодействиях рецепторов клетки с сигнальными молекулами. Этанол может проходить через мембраны в межклеточное пространство и кровь и далее в любую клетку организма.Д. Влияние этанола и ацетальдегида на метаболизм ксенобиотиков и лекарств в печениХарактер влияния этанола на метаболизм ксенобиотиков и лекарств зависит от стадии алкогольной болезни: начальная стадия алкоголизма, хронический алкоголизм или острая форма алкогольной интоксикации.Микросомальная этанолокисляющая сисгема (МЭОС) наряду с метаболизмом этанола участвует в детоксикации ксенобиотиков и лекарств. На начальной стадии алкогольной болезни биотрансформация лекарственных веществ протекает более активно вследствие индукции ферментов системы. Этим объясняют феномен лекарственной "устойчивости". Однако при острой интоксикации этиловым спиртом тормозится био-трансформация лекарственных веществ. Этанол конкурирует с ксенобиотиками за связывание с цитохромом Р450П E1, вызывая гиперчувствительность (лекарственную "неустойчивость") к некоторым принятым одновременно с ним лекарственным препаратам.Кроме того, у людей, страдающих хроническим алкоголизмом, наблюдают избирательную индукцию изоформы Р450II E1 и конкурентное ингибирование синтеза других изоформ, принимающих участие в метаболизме ксенобиотиков и лекарств. При злоупотреблении алкоголем индуцируется также синтез глюкуронилтрансфераз, но снижается образование УДФ-глюкуроната.Алкогольдегидрогеназа обладает широкой субстратной специфичностью и может окислять разные спирты, в том числе и метаболиты сердечных гликозидов - дигитоксина, дигоксина и гитоксина. Конкуренция этанола с сердечными гликозидами за активный центр алкогольдегидрогеназы приводит к снижению скорости биотрансформации этой группы лекарств и повышает опасность их побочного эффекта у лиц, принимающих большие дозы алкоголя.Повышение концентрации ацетальдегида вызывает целый ряд нарушений в структуре белков (ацетилирование), мембран (ПОЛ), модификацию глутатиона, необходимого для одного из самых важных ферментов обезвреживания ксенобиотиков - глутатионтрансферазы и фермента антиоксидазной защиты глутатионпероксидазы. Таким образом, представленные данные свидетельствуют, что алкогольное поражение печени сопровождается нарушением важнейшей функции этого органа - детоксикационной.
22. Биохимические механизмы потребления метана, метанола и формальдегида.Среди прокариотных и эукариотных микроорганизмов довольно широко распространена способность использовать для роста многие соединения, содержащие один атом углерода, более восстановленные, чем CO2, а также соединения, содержащие больше одного углеродного атома, но не имеющие С-С-связей. К веществам первого типа относятся окись углерода (CO), метан (CH4), метанол (CH3OH), формальдегид (HCOH), муравьиная кислота (HCOOH), метиламин (CH3NH2), хлорметан (CH3Cl), цианистый калий (KCN) и др. Примером соединений второго типа служат ди- и триметиламины [(CH3)2NH, (CH3)2N], диметилсульфид [(CH3)2S], метилформиат (CH3COOH)68 и др. Обычно такие соединения называются одноуглеродными, или C1-соединениями. В большинстве из них углерод представлен в виде метильной группы, поэтому микроорганизмы, использующие эти соединения, получили название метилотрофов.Использовать C1-соединения могут многие аэробные и анаэробные прокариоты. Среди анаэробов такой способностью обладают, например, сульфатвосстанавливающие эубактерий, метанобразующие архебактерии, многие типичные хемо- и фототрофные эубактерии. К метилотрофам относят облигатно аэробные эубактерии, обладающие способностью использовать в качестве единственного источника углерода и энергии одноуглеродные соединения. Круг таких организмов широк. Это различные грамположительные и грамотрицательные формы — представители Pseudomonas, Bacillus, Hyphomicrobium, Protaminobacter, Arthrobacter, Nocardia и др.В отношении способа питания различают две основные группы метилотрофов: факультативные и облигатные. Факультативные метилотрофы наряду с одноуглеродными могут использовать и некоторые полиуглеродные соединения. Группа облигатных метилотрофов включает эубактерии, использующие только одноуглеродные соединения.В IX издании Определителя бактерий Берги облигатные и факультативные метилотрофы выделены в семейство Methylococcaceae, включающее роды Methylococcus и Methylomonas. Основной признак, принятый во внимание при выделении в это семейство, — способность использовать метан в качестве единственного источника углерода и энергии в аэробных или микроаэробных условиях.Метилотрофы, отнесенные к семейству Methylococcaceae, грамотрицательные эубактерии с разной морфологией и размерами клеток, подвижные или неподвижные. Некоторые штаммы образуют цисты. Характерной особенностью при росте на метане является наличие в клетке развитой системы внутрицитоплазматических мембран, которые могут быть разделены на два типа: внутрицитоплазматические мембраны I типа представлены стопками плотно упакованных везикулярных дисков, распределенных по всей цитоплазме; внутрицитоплазматические мембраны II типа имеют вид ламелл, расположенных по периферии клетки.Помимо метана в качестве единственного источника углерода и энергии облигатные метилотрофы могут использовать метанол, формальдегид и другие C1-соединения, а факультативные — также C2-, C4-кислоты, этанол, глюкозу. Использование метилотрофами C1-соединений в конструктивном и энергетическом метаболизме привело к формированию у них специфических путей ассимиляции и диссимиляции этих соединений.Процесс полного окисления метана может быть представлен в виде схемы. Первый этап — окисление метана до метанола катализируется метанмонооксигеназой в реакции:CH4 + O2 + H2A ® CH3OH + A + H2O.где O2 — молекулярный кислород, а H2A — восстановитель. Из приведенной реакции становится понятной облигатная зависимость окисления метана от молекулярного кислорода.Описаны две формы метанмонооксигеназы: связанная с внутрицитоплазматическими мембранами и растворимая. Донором электронов для первой предположительно может быть восстановленный цитохром с или НАД-H2, образующийся в результате обратного электронного транспорта, для второй — только НАД(Ф)-H2 или соединения, которые окисляются с его образованием. Остальные этапы окисления катализируются соответствующими дегидрогеназами, различающимися строением, природой акцепторов электронов и другими параметрами.Формальдегид у метилотрофов является ключевым метаболитом, на уровне которого расходятся конструктивные и энергетические пути. Часть формальдегида превращается в вещества клетки по специфическим для этих эубактерий ассимиляционным циклическим путям, большая часть окисляется до CO2 в линейной последовательности реакций через формиат.Дыхательные цепи метилотрофов по составу переносчиков и их локализации на мембране похожи на таковые большинства аэробных эубактерий, что предполагает возможность функционирования у них трех пунктов сопряжения. В окислитель-ком метаболизме C1-соединений участвуют НАД, флавины, хиноны, цитохромы типа b, c, a, o.Этап окисления метана до метанола, катализируемый оксигеназным ферментом, не связан с получением клеткой энергии. Энергетическая эффективность окисления C1-соединений соответствующими дегидрогеназами определяется местом поступления электронов в дыхательную цепь. Окисление метанола до формальдегида, катализируемое ферментом, содержащим в качестве простетической группы особый хинон, сопровождается передачей электронов в дыхательную цепь на уровне цитохрома c. Это приводит к синтезу одной молекулы АТФ, т. е. указывает на функционирование только третьего пункта сопряжения.Окисление формальдегида и формиата, зависимое от НАД, позволяет предполагать, что перенос пары электронов может быть связан с тремя трансмембранными перемещениями протонов. Полученные экспериментальные данные указывают, однако, на меньшие выходы АТФ. Вопрос о том, на каком уровне передаются электроны от формальдегида и формиата в дыхательную цепь, не вполне ясен.У метилотрофов функционируют циклические пути ассимиляции C1-соединений, ответственные за превращения их в вещества клетки: восстановительный пентозофосфатный, рибулозомонофосфатный и сериновый. В восстановительном пентозофосфатном цикле происходит ассимиляция CO2, образующейся при окислении C1-соединений. У метилотрофов этот путь не имеет широкого распространения и обнаружен только у представителей, способных расти автотрофно, а также у тех, кто может использовать формиат.В рибулозомонофосфатном и сериновом циклах обеспечивается использование в биосинтетических процессах формальдегида, образуемого при окислении разных C1-соединений. Первая реакция рибулозомонофосфатного пути — акцептирование формальдегида молекулой рибулозо-5-фосфата, приводящее к образованию гексулозо-6-фосфата, который изомеризуется затем во фруктозо-6-фосфат. Ферменты, катализирующие обе реакции, специфичны для данного цикла. Далее возможны разные варианты. По одному из них фруктозо-6-фосфат подвергается фосфорилированию. Образовавшийся фруктозо-1,6-дифосфат расщепляется на две триозы: 3-фосфоглицериновый альдегид и фосфодиоксиацетон. 3-ФГА и фруктозо-6-фосфат участвуют в серии реакций, приводящих к регенерации акцептора формальдегида — рибулозо-5-фосфата. Эти реакции аналогичны таковым восстановительного пентозофосфатного цикла. Три оборота рибулозомонофосфатного цикла приводят к синтезу молекулы фосфодиоксиацетона, используемого в биосинтетических процессах.Сериновый цикл существенно отличается от предыдущего пути ассимиляции формальдегида природой интермедиатов и ферментами (рис. 100, Б). Ключевая реакция этого пути — конденсация формальдегида и глицина в присутствии тетрагидрофолиевой кислоты, приводящая к образованию серина. Последний в реакции трансаминирования превращается в оксипировиноградную кислоту, последовательное восстановление и фосфорилирование которой приводит к образованию 3-ФГК. Одна часть 3-ФГК используется для синтеза вещества клетки, другая превращается в фосфоенолпировиноградную кислоту. Последующее карбоксилирование ФЕП приводит к синтезу молекулы щавелевоуксусной кислоты. Эта реакция примечательна тем, что в сериновый цикл вовлекается CO2. Последующая серия реакций приводит к регенерированию глицина, и цикл замыкается.Ассимиляция формальдегида через рибулозомонофосфатный цикл характерна для метилотрофов, имеющих мембранную организацию I типа, а через сериновый — для метилотрофов с системой внутрицитоплазматических мембран II типа.ЦТК в системе катаболических путей не занимает ведущего места. У ряда облигатных метилотрофов он не "замкнут". Если даже содержит все ферменты, активность некоторых из них невысока.Изучение этой специфической группы эубактерий привело к заключению о ее близости к автотрофам. Это проявляется как в способности метилотрофов синтезировать все вещества клетки из С1-соединений, так и функционированию развитого у них механизма ассимиляции CO2 в восстановительном пентозофосфатном цикле.Одноуглеродные соединения, в первую очередь метан, широко распространены в природе. Метан — конечный продукт жизнедеятельности одной из групп архебактерий, отход ряда промышленных процессов, основной компонент газов геохимического происхождения. Метанол — один из продуктов разложения пектинов, осуществляемого в природе с участием разнообразных микроорганизмов. Формиат — довольно распространенный продукт сбраживания углеводов и других углеродных субстратов. Метанол, формальдегид, формиат — отходы разнообразных химических процессов, осуществляемых в крупных масштабах. Однако в биосфере метан и другие С1-соединения поддерживаются на постоянном уровне главным образом за счет деятельности метилотрофов.Метилотрофы — обитатели водоемов и почв различного типа, где идут процессы с образованием одноуглеродных соединений. Их выделяют из сточных вод, с гниющих растительных остатков, из рубца жвачных животных. Интерес к изучению метилотрофов связан не только с особенностями их метаболизма, но и с перспективами их практического использования: метилотрофы характеризуются активным ростом, высокими выходами биомассы, большим содержанием полноценного белка в клетке; являются эффективными продуцентами различных веществ.
Процесс
полного окисления метана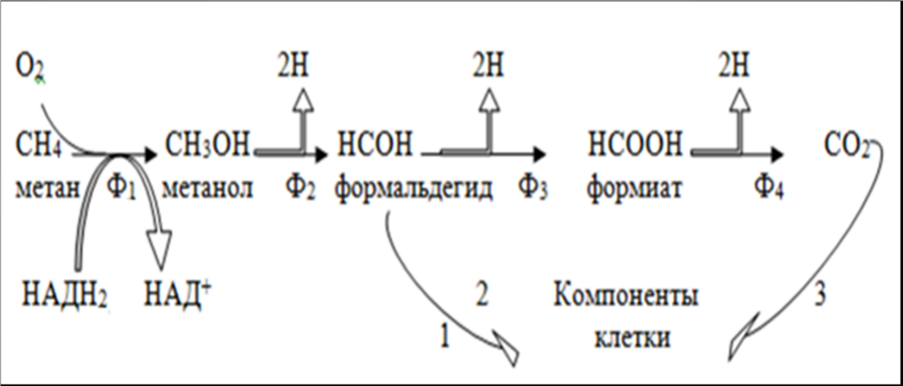 -5-фосфата Ф1 – метанмонооксигеназа;Ф2
– метанолдегидрогеназа;Ф3 –
формальдегиддегидрогеназа;Ф4 –
формиатдегидрогеназа.
-5-фосфата Ф1 – метанмонооксигеназа;Ф2
– метанолдегидрогеназа;Ф3 –
формальдегиддегидрогеназа;Ф4 –
формиатдегидрогеназа.
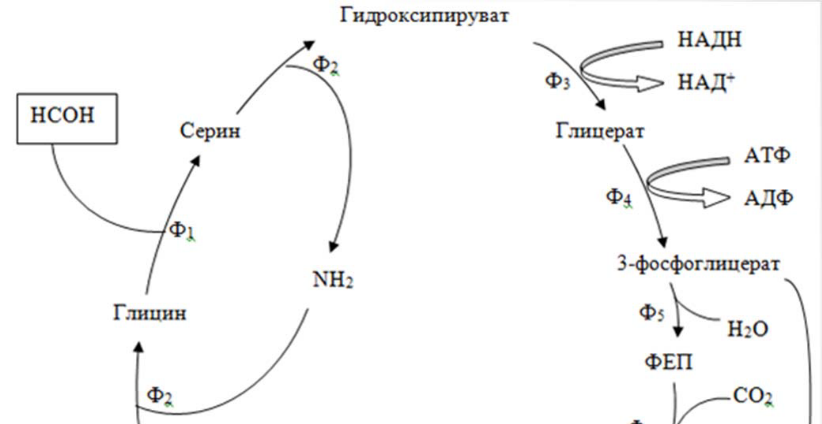
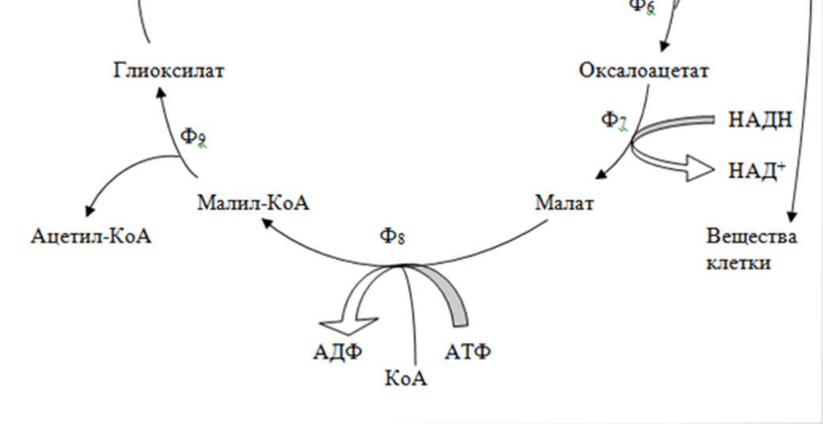
23.Биохимические механизмы потребления метана,метанолы,формальдегида: Сериновый путь. Предусматривает последовательность реакций конденсации формальдегида, глицина и СО2 в яблочную кислоту. У метило-трофных микроорганизмов выявлены два варианта данного метаболического пути: с участием изоцитратлиазы («+» - вариант) и без участия данного фермента («-» - вариант). В первом случае цепь превращений катализируется цитратсинтетазой, аконитатгидратазой и изоцитратлиазой; «-» - вариант предусматривает аналогичную последовательность реакций, но без вовлечения ферментов изоцитратлиазы.

 Общая
схема процесса:
Общая
схема процесса:



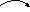 НСНО
НСООН
СО2
НСНО
НСООН
СО2

 ТГФК
ТГФК
 С1
– ТГФК ТГФК
С1
– ТГФК ТГФК
1
 Глицин
Серин
Глицин
Серин

 окси-ПВК
окси-ПВК
2 АТФ
АТФ
НАДН
НАД
 АДФ
АДФ
2-ФГК 3-фосфоглицерат

3

 ФЕП
ФЕП
СО2
ЩУК

 Глиоксиловая
кислота НАДН
Глиоксиловая
кислота НАДН
5 НАД
НАД
 Яблочная
кислота
Яблочная
кислота
 изолимонная
кислота НS-КоА
АТФ
изолимонная
кислота НS-КоА
АТФ
янтарная кислота АДФ
4
Лимонная кислота ЩУК
1
2
3
4 5
- малил-КоА-лиаза; - изоцитратлиаза.
Энергентическая эффективность серинового пути равна 12,5 АСБ/моль АТФ.
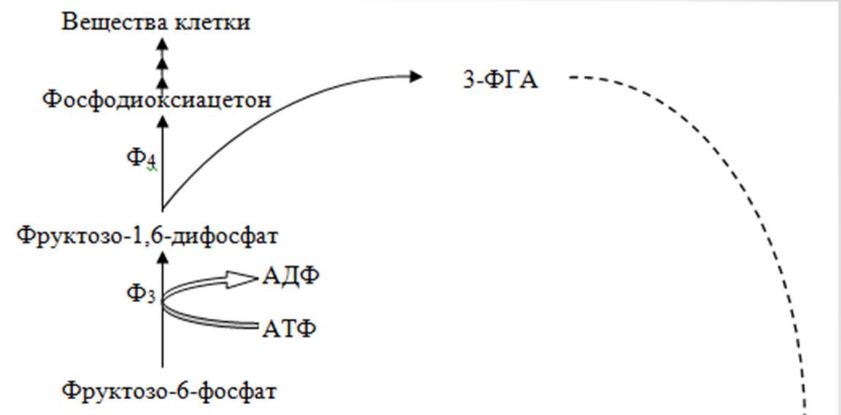
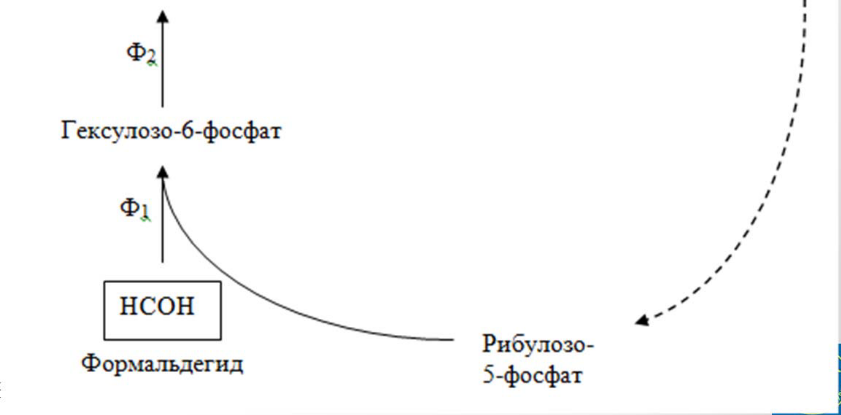
24. Биохимические механизмы потребления метана,метанолы,формальдегида Рибулозомонофосфатный путь. Он представляет собой модифицированный вариант пентозофосфатного цикла. Ключевой реакцией является конденсация формальдегида с молекулой рибулозо-5-фосфата.

 НСОН
НСОН
1 2


 Рибулозо-5-
Ф гексулозо
– 6 – Ф
Рибулозо-5-
Ф гексулозо
– 6 – Ф
СО2
5
 НАДФН
фруктозо-6- Ф
НАДФН
фруктозо-6- Ф
4 3
НАДФ

 G-фосфоглюконовая
к-та глюкозо
–6- Ф
G-фосфоглюконовая
к-та глюкозо
–6- Ф
НАДФН НАДФ
1 2
3 4
5 1
Ключевой фермент специфичен к формальдегиду и D-риболозо-5-фосфату; активируется ионами Mg2+ и Mn2+, ингибируется ионами Ni2+, Ca2+, Cu2+.
В целом энергетическая эффективность процесса составляет 27,3 г АСБ/моль АТФ.