
- •Общие методы анализа органических лекаствнных средств. Функциональный анализ.
- •3. Прочие
- •Лекарственные вещества, содержащие спиртовой гидроксил.
- •Лекарственные вещества, содержащие карбонильную (альдегидную и кетонную) группу
- •2.1 Конденсации
- •2.2 Замещения
- •2.3 Присоединения
- •2.1 Реакции конденсации с фенолами
- •2.3 Реакции присоединения.
- •3.Реакции полимеризации.
- •3.4 Реакции конденсации с альдегидами или ангидридами кислот
- •Лекарственные вещества, содержащие сложно – эфирную группу
- •Лекарственные вещества, содержащие первичную ароматическую аминогруппу
- •2 Стадия
- •Лекарственные вещества, содержащие ароматическую нитро-группу
- •Лекарственные вещества, содержащие непредельную связь
- •Лекарственные вещества, содержащие амидную группу
- •Лекарственные вещества, содержащие вторичную и третичную аминогруппы
- •Лекарственные вещества, содержащие имидную и сульфамидную группы
- •2. Реакция вытеснения кислотной формы
- •Лекарственные вещества, в структуре которых присутствуют ковалентно связанные галогены
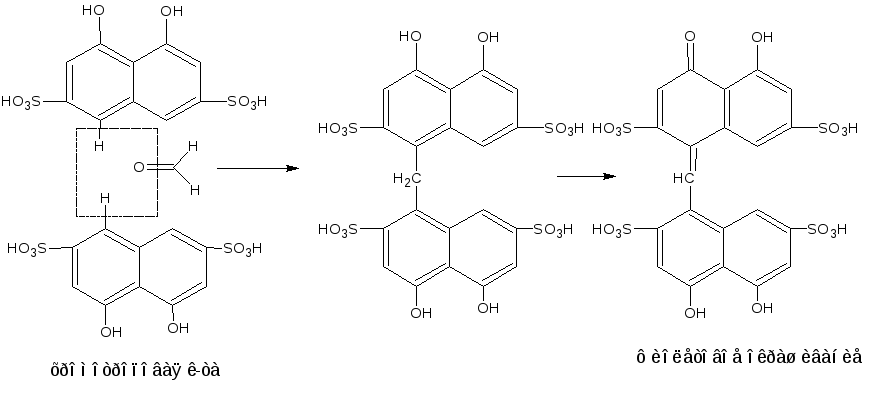
2.1 Реакции конденсации с фенолами
(характерна
для альдегидов).
В присутствии концентрированной серной
кислоты образуется бесцветный продукт
конденсации,
при последующем окислении
которого
получаются
интенсивно окрашенные соединения
хиноидной структуры. В
качестве реактивов используется
салициловая
или
хромотроповая кислоты.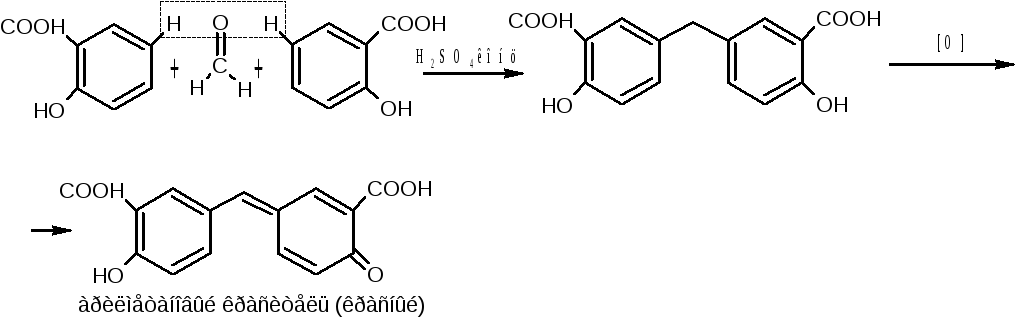
2.2 Реакции замещения (конденсации) с аминами или их производными (характерны для ЛВ, содержащих как альдегидную, так и кетонную группы).
Для кетонов это единственный вид фармакопейных реакций!!!
В качестве реактивов используются соединения с аминогруппой:
с первичной ароматической – п-аминобензолсульфамид (стрептоцид) или алифатической – гидроксиламин аминогруппой;
производные гидразина – 2,4 – динитрофенилгидразин, фенилгидразин, семикарбазид.
При этом образуются осадки (реже растворимые соединения – основания Шиффа) соединения с азометиновой связью – основания Шиффа, оксимы, гидразоны, семикарбазоны, которые характеризуются определенной температурой плавления, разложения и (или) окраской.
Примеры
2.1.1. с п-аминобензолсульфамидом (стрептоцид) ванилин (альдегидная группа) → желтое окрашивание основания Шиффа. Чаще эта реакция используется для идентификации ароматических аминов, когда реактив – альдегид.

2.1.2. Камфора (кетонная группа) с гидроксиламином в нейтральной среде → белый осадок оксима (Т°пл)
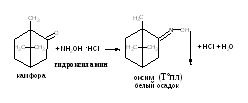
Сульфокамфорная кислота (кетонная группа)
с 2,4 – динитрофенилгидразином образуется желто-оранжевый или желтый осадок гидразона (Т°пл)


 O
O
 R-C+H2N–N–C–NH2→R– C = N
– N–C–NH2+H2O
R-C+H2N–N–C–NH2→R– C = N
– N–C–NH2+H2O
H│ ║ │ │ ║
HOHHO
семикарбазид семикарбазон
2.3 Реакции присоединения.
2.3.1. Реакция с фуксинсернистой кислотой. Эта кислота бесцветна, но при добавлении вещества с альдегидной группой образуется хиноидная структура красно-фиолетового цвета.
При добавлении минеральных кислот окрашивание исчезает, за исключением формальдегида, в присутствии которого окраска сохраняется. Кетоны этой реакции не дают.
2.3.2.с натрия гидросульфитом реакция образования бисульфитных производных. Продукт присоединения – кристаллическое вещество с определенной Т°пл.
OH

 O
│
O
│
 R -
C + NaHSO3
→ R –
C
–
SO3Na
R -
C + NaHSO3
→ R –
C
–
SO3Na
H │
H
3.Реакции полимеризации.
Эти реакции характерны для альдегидов, но в фарманализе не используют, могут легко протекать в водном растворе формальдегида (при температуре ниже 9оС) через гидратную форму образуются цепи различной длины:

ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ КАРБОКСИЛЬНУЮ ГРУППУ
![]()
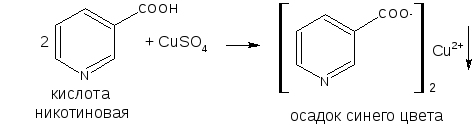
Эту группу содержат вещества из группы карбоновых кислот и их солей (калия ацетат, кальция лактат, натрия цитрат и тд), аминокислоты (к-та глютаминовая, аминалон, метионин), ароматические кислоты (к-та бензойная, салициловая, ацетилсалициловая) и многие другие ЛВ – к-та мефенамовая, ПАСК-натрий, фталазол, никотиновая к-та и тд.
ЛВ, содержащие карбокси-группу, проявляют кислотные свойства за счет подвижного атома водорода:
R-COOH → R-COO- + H+
Благодаря чему они способны вступать в реакции соле- и комплексообразования.
Кроме того гидроксильная группа карбоновых кислот может замещаться на остаток спирта с образованием сложных эфиров.
Реакции соле- и комплексообразования.
Реакции с солями тяжелых металлов Взаимодействие с ионами железа (III) или меди (II) с образованием окрашенных простых или комплексных солей

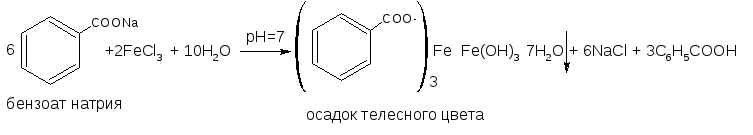
или →(С6Н5СОО-)3 Fе3+ · Fе(ОН) 3 · 7Н2О↓
осадок основной соли розовато-желтого цвета
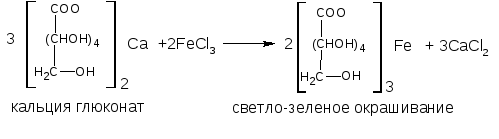
Реакция этерификации
Карбоновые и ароматические кислоты (или их соли) взаимодействуют со спиртами, образуя сложные эфиры. Эфиры доказывают по специфическому запаху или осадку с характерной температурой плавления (Т°пл).
 (Т°пл)
(Т°пл)
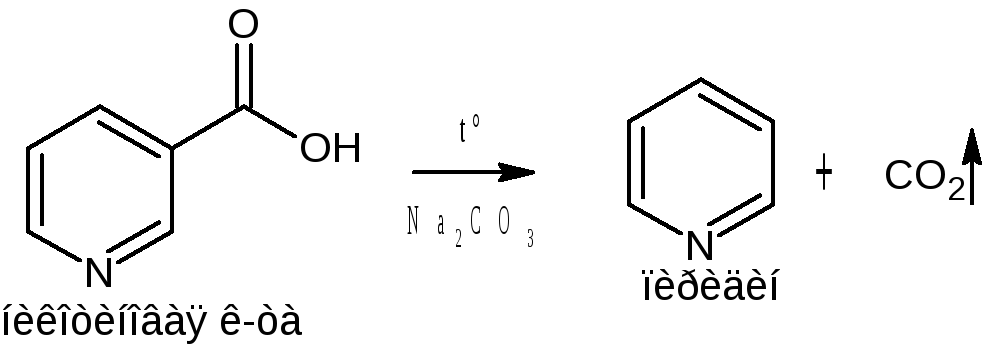
Реакции декарбоксилирования. При нагревании салициловой или никотиновой кислот в присутствии карбоната натрия и натрия цитрата выделяется углекислый газ:

салициловая кислота фенол
Реакции выделения кислот.
Рекомендуется ГФ для идентификации солей, образованных ароматическими кислотами. Сильные минеральные кислоты (серная, хлористоводородная, азотная) вытесняют более слабые из их солей. Образующиеся осадки кислот отделяют и идентифицируют по температуре плавления (натрия бензоат, салицилат).
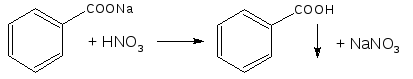
Бензойная кислота Т°пл
ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ ФЕНОЛЬНЫЙ ГИДРОКСИЛ
Фенольный гидроксил – это гидроксил, связанный с ароматическим радикалом.
Его содержат такие ЛВ, как фенол, резорцин, тимол, к-та салициловая, морфина г/хл, адреналин и др. Кроме того, ряд веществ образуют фенольный гидроксил при гидролитическом разложении – это парацетамол, ацетилсалициловая кислота и др.
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары кислорода с π-электронами ароматического ядра. Это взаимодействие приводит к смещению электронной плотности с ОН-группы на кольцо, нарушению в нем равномерности распределения электронов, созданию избыточного отрицательного заряда заряда в орто (о)- и пара (п)-положениях.
Атом водорода ОН-группы ионизирует и придает фенолам 1. слабые кислотные свойства. Но в отличие от спиртов, они образуют соли со щелочами (при рН 12-13) и растворимые комплексные соединения с хлоридом железа (III) (в нейтральных, слабощелочных и кислых растворах).
Фенолы проявляют 2. сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями. Образуют окрашенные соединения хиноидной структуры.
Наибольшее значение для анализа имеют 3. реакции электрофильного замещения в о- и п-положениях ароматического кольца.
Основываясь на свойствах фенольного гидроксила и активированного им ароматического кольца, в анализе ЛВ, содержащих эту группу, используют следующие реакции:
комплексообразование
окисление
электрофильного замещения
галогенирование (бромирование)
нитрование
азосочетание с солями диазония
конденсация (с альдегидами)
Реакция комплексообразования с ионами железа (III)
Основана на свойствах фенольного гидроксила образовывать с ионами железа 3+ растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая) реже в красный (ПАСК – натрия) и зелёный (хинозол, адреналин – пирокатехиновый фрагмент).
Состав комплексов обусловлен количеством фенольных –ОН, влиянием других функциональных групп, реакцией среды: с избытком Br2
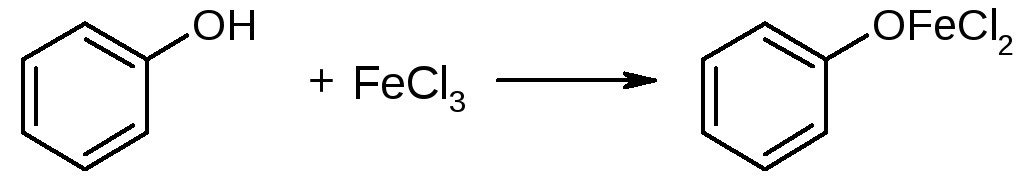
Синее окрашивание
При избытке фенола:
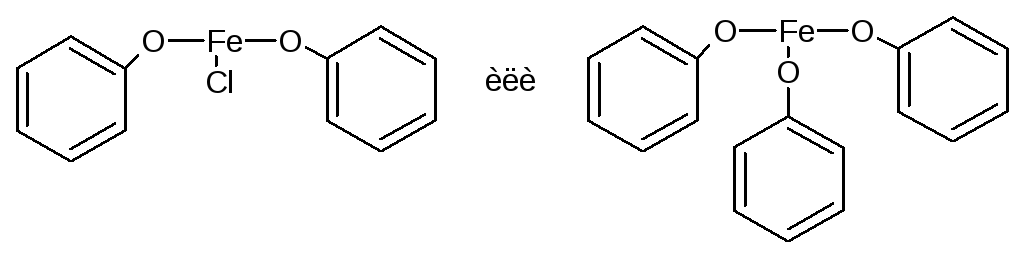
салициловая
кислота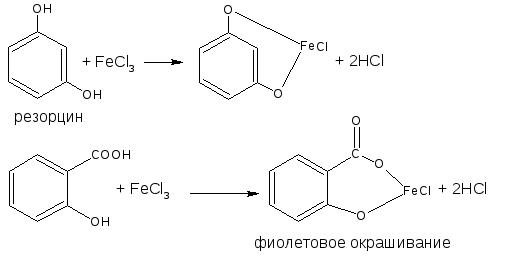
Реакции окисления. Фенолы легко окисляются, образуя о- или п-хиноны (циклические дикетоны), окрашенные в розовый, реже жёлтый цвет:
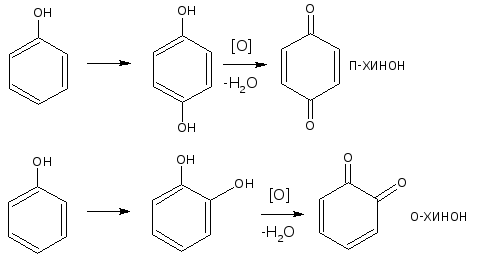 или
или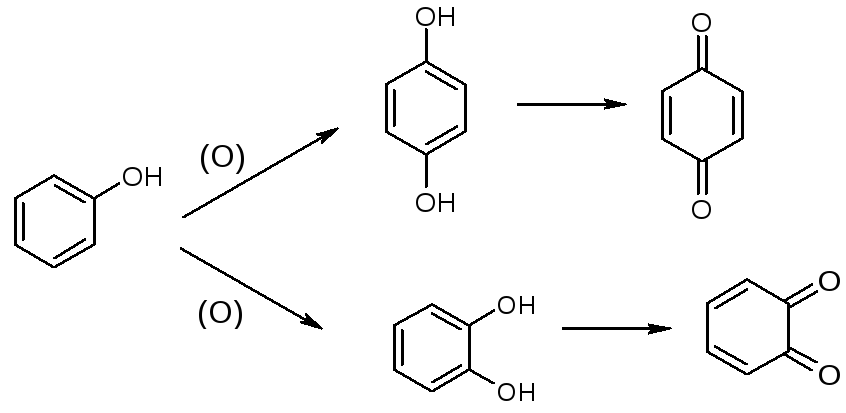
Реакции образования индофенолового или индоаминового красителя:
а) Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют индофеноловый краситель, окрашенный в сине-фиолетовый цвет.
Окислитель – хлорная известь
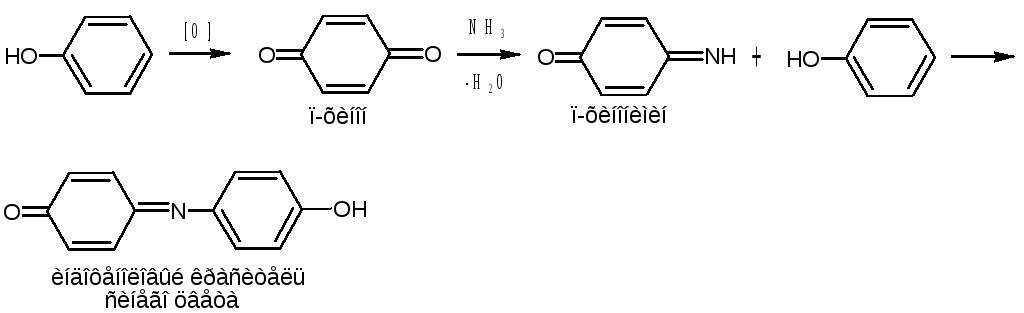
или

б) Реакция рекомендована для веществ, образующих в результате гидролиза
п-аминофенол (парацетамол), который обнаруживают образованием индоамина (по свойствам родственный индофенолу). Окислитель – дихромат калия в кислой среде.

в) Разновидностью данной реакции является нитрозореакция Либермана, она характерна для фенолов, не имеющих заместителей в о- и п-положениях.
При действии окислителя – нитрита натрия в кислой среде образуется
п-нитрозофенол, изомеризующийся в п-хиноидоксим, который, реагируя с избытком фенола в кислой среде, образует индофенол:
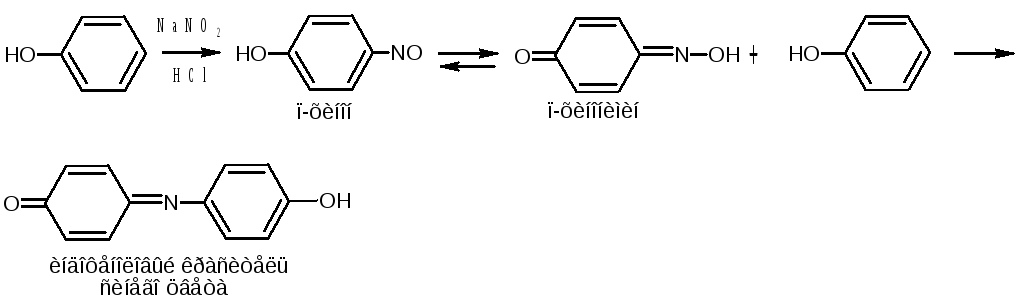
Реакции электрофильного замещения Sе .
3.1 Реакции галогенирования. Реакция галогенирования ароматического ядра основана на электрофильном замещении водорода на галоген.
Основные правила бромирования:
водород замещается в о- и п-положениях по отношению к фенольному ОН (наиболее реакционноспособно п-положение):

при наличии в о- или п-положениях заместителей, в реакцию вступает меньше атомов брома (тимол - дипроизводное):
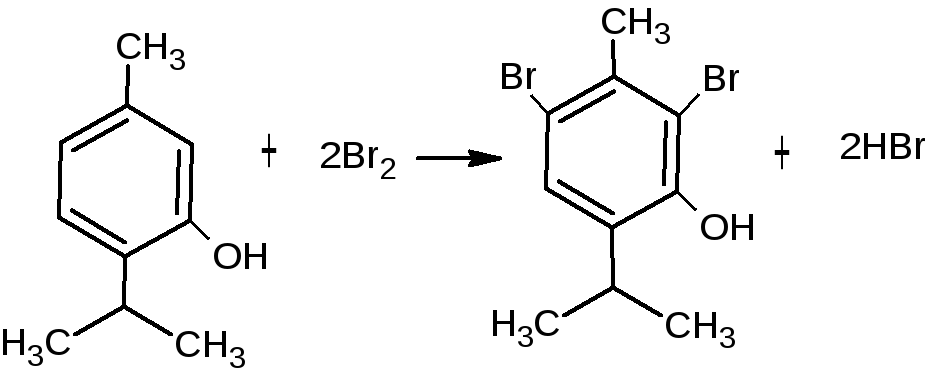
если в о- или п-положениях находится карбоксильная группа (салициловая кислота), то происходит с избытком брома декарбоксилирование и образование трибромпроизводного:

наличие заместителей в м-положениях не препятствует образованию трибромпроизводного (мезатон):

если в соединении два фенольных гидроксила в м-положении, то в результате их согласованной ориентации образуется трибромпроизводное
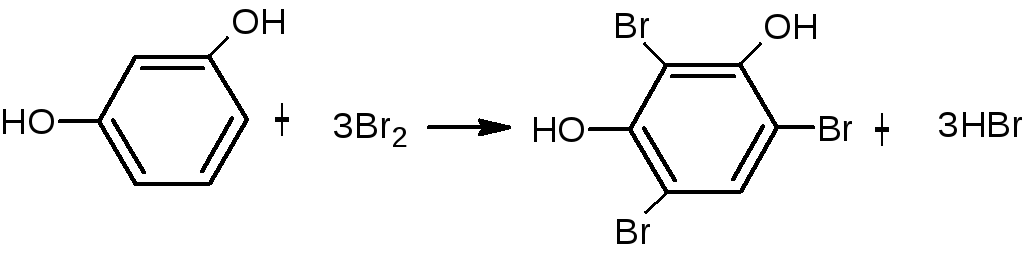
6) если же две гидроксильные группы в о- или п-положениях, то они действуют несогласованно, бромирования не происходит (адреналин, норадреналин)
3.2 Реакции азосочетания с диазореактивом в щелочной среде. Продукт реакции – азокраситель. Сочетание идет также в о- и п-положениях, в этом случае также, как и при бромировании, предпочтительным является п-положение.
Диазореактив – соль диазония (диазотированная нитритом натрия с среде разв.хлороводородной кислоты сульфаниловая кислота):резорцин

3.3 Реакции образования нитросоединений (аци-солей). При взаимодействии с разведенной азотной кислотой фенолы могут нитроваться при комнатной температуре, образуя о- и п-нитропроизводные, которые могут существовать в двух таутомерных формах:

Нитропроизводное содержит в п-положении подвижный атом водорода гидроксильной группы, образуется таутомерная аци-форма с хиноидной структурой, она обычно окрашена в желтый цвет. Добавление щелочи усиливает окраску, вследствие образования хорошо диссоциируемой аци-соли:

