- •Химические методы анализа Общие реакции на подлинность
- •Анализ лекарственных средств неогранического происхождения.
- •I. Реакции на катионы
- •Реакции на анионы
- •2. Сульфат-ион (so42-)
- •3. Карбонат (гидрокарбонат) – ионы (со32-, hco3-)
- •4. Нитраты и нитриты (no3-, no2-)
- •5. Фосфат-ион (ро43-)
- •6.Сульфит-ион (so32-)
- •7. Борат-ион (bo33-)
Реакции на анионы
1. Галогенид – ионы (Cl-, Br-, I-)
1.1. Хлорид – ион
ГФ Растворы хлоридов с серебра нитратом образуют белый творожистый осадок хлорида серебра:

Осадок растворяется в аммиаке и не растворяется в азотной кислоте:
![]()
1.2. Бромид – ион
ГФ Растворы бромидов с серебра нитратом образуют желтоватый творожистый осадок серебра бромида:
HNO3
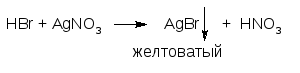
Осадок трудно растворим в растворе аммиака и нерастворим в азотной кислоте разведенной.
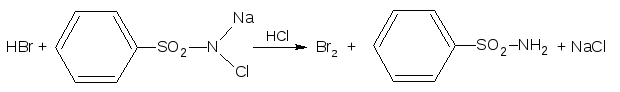
2. ГФ Бромиды идентифицируют по реакции выделения брома в окислительно-восстановительной реакции между бромид-ионом и хлорамином в кислой среде. Выделяющийся бром извлекают хлороформом, слой хлороформа окрашивается в желто-бурый цвет:
1.3. Йодид-ион
1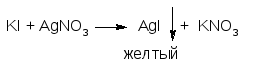 .ГФ
Растворы йодидов образуют с серебра
нитратом желтый творожистый осадок:
.ГФ
Растворы йодидов образуют с серебра
нитратом желтый творожистый осадок:
Осадок нерастворим в растворах азотной кислоты и аммиака, растворим в растворе тиосультфата натрия.
2. ГФ Йодиды легко окисляются, являясь восстановителями. Под действием слабых окислителей выделяется йод, сильные окислители могут окислить выделившийся йод далее до бесцветных гипойодидов или йодатов (IO-, IO3-).
Поэтому в реакции окисления йодидов до йода очень важен выбор окислителя и его концентрация. ГФ рекомендует для этой цели два реактива – раствор хлорида железа (III) или раствор натрия нитрита:
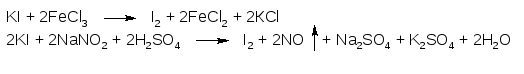
Выделяющийся йод извлекают хлороформом, слой хлороформа окрашивается в фиолетовый цвет.
3. ГФ При нагревании 0,1 г лекарственного средства с 1 мл серной кисло-
ты концентрированной выделяются пары фиолетового цвета.
2 I- + H2SO4 → SO32- + I2↑ + H2O
2. Сульфат-ион (so42-)
ГФ Сульфаты с раствором бария хлорида образуют белый осадок бария сульфата:

Осадок нерастворим в растворах минеральных кислот и щелочей.
3. Карбонат (гидрокарбонат) – ионы (со32-, hco3-)
1. ГФ При действии на карбонат-ион или гидрокарбонат-ион разведенных минеральных кислот появляются пузырьки диоксида углерода вследствие разложения выделяющейся нестойкой угольной кислоты (реакция вытеснения слабой угольной кислоты из соли сильной минеральной кислотой):
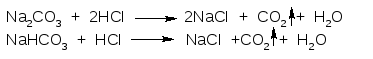
ГФ Реакция среды. Растворы карбонатов окрашивают фенолфталеин в ярко розовый цвет, гидрокарбонатов – остаются бесцветными.
ГФ Растворы карбонатов с насыщенным раствором магния сульфата образуют белый осадок в виде комплексной соли.; гидрокарбонаты образуют белый осадок только при нагревании, т. к. при этом они переходят в карбонаты.
4Na2СO3 + 4MgSO4 + 4 H2О → 3Mg СO3 · Mg (OН) 2 ·3H2О↓ + 2Na2 SO4 +
2Na2 HСO3 to → Na2СO3 + СO2↑ + H2О
4. Нитраты и нитриты (no3-, no2-)
1. ГФ (общая) Нитраты и нитриты образуют синее окрашивание с раствором дифениламина в концентрированной серной кислоте (pеакция окислительния дифениламина до дифенилбензидинвиолета):

Нитраты.
2. К лекарственному средству (2–5 мг нитрат-иона) прибавляют по 2–3
капли воды и серной кислоты концентрированной, кусочек металлической
меди и нагревают; выделяются пары бурого цвета.
Нитриты.
2. К лекарственному средству (около 30 мг нитрит-иона) прибавляют 1
мл серной кислоты разведенной 16 %; выделяются желто-бурые пары (отли-
чие от нитратов). Реакция разложения
2NaN02
+ H2SO4
→ NO↑+ N02
↑+ Na2SO4
+ H2O
Желто-коричневые пары
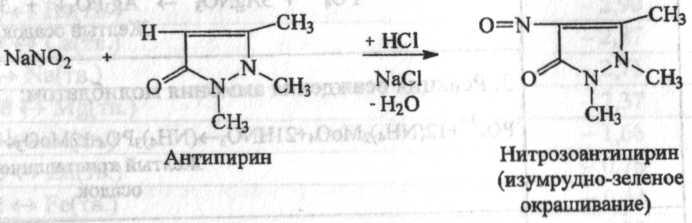
3. Несколько кристаллов антипирина растворяют в фарфоровой чашке
в 2 каплях хлористоводородной кислоты разведенной 8,3 %, прибавляют 2
капли раствора нитрита (около 1 мг нитрит-иона); появляется зеленое окрашивание (отличие от нитратов). Реакция электрофильного замещения