
Токсичность биогенных элементов.
В организме элементы могут претерпевать химические изменения и превращаться в вещества, оказывающие токсическое действие на организм. Существует понятие критической концентрации элемента в клетке, при достижении которой функции клетки нарушаются, а превышение критической концентрации приводит к гибели клетки.
Примеры: токсичное действие нитратов и кислорода.
Это особенно значительно проявляется при развитии некоторых профессиональных заболеваний:
алюминоз – добыча и переработка алюминия
силикоз – керамическая промышленность
антракоз – угледобывающая отрасль
и т.д.
Действие нитратов и нитритов на организм.
Нитраты, соли азотной кислоты, NO3– не отличаются высокой токсичностью.
При поступлении в организм под действием микрофлоры кишечника они восстанавливаются в нитриты:
NO3– + 2ē NO2–
Нитриты очень токсичны:
во первых, они вызывают тканевую гипоксию, т.к. окисляют Fe2+ в гемоглобине. В результате образуется метгемоглобин, который не способен транспортировать кислород (О2)
Hb + NO3– + 2Н+ метHb + NO + Н2О

во-вторых, они образуют канцерогенные вещества – нитрозосоединения.
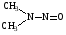
Например, диметилнитрозамин
Способен вызвать рак практически всех внутренних органов. Международные нормы: ПДК = 40 мг/кг или л
Токсичность кислорода (О2).
Превращение кислорода в организме можно представить следующей схемой:
O2 + 4Н+ + 4ē 2Н2О
Однако, данное превращение включает 4 стадии:
O2 + 1ē О2. – (супероксид-анион-радикал)
О2. – + 1ē + 2Н+ Н2О2 (пероксид водорода)
Н2О2 + 1ē + Н+ Н2О + ОН . (гидроксид-радикал)
ОН . + 1ē + Н+ Н2О
Таким образом, при полном восстановлении молекула кислорода, принимая четыре электрона и четыре иона водорода, образует две молекулы воды.
При неполном восстановлении кислорода образуются различные кислородсодержащие токсичные радикалы и молекулы: О2. –, Н2О2, ОН .. Токсичные активные формы кислорода могут образовываться и при взаимодействии его с металлопротеинами (гемоглобин, цитохромы), содержащими катионы металла в низших степенях окисления: Fe2+, Mn2+, Cu+.
Например: [Prot·Fe2+] + O2 [Prot·Fe3+] + O2.
2[Prot·Fe2+] + O2 + 2H+ 2[Prot·Fe3+] + H2O2
Образовавшиеся частицы активно атакуют биосубстрат вплоть до разрыва связей С-С и С-Н, т.е. происходит глубокая деструкция молекул биосубстрата. Например: пероксидное окисление липидов (разрушение липидного слоя мембран), приводит к гибели клеток, а следовательно, и тканей, органов.
При экстремальных и патогенных воздействиях на организм образование кислородных радикалов в клетках и тканях усиливается. Факторами, усиливающими свободно-радикальное окисление, являются: радиоактивное, ультразвуковое и лазерное излучение; шум, вибрация; простудные и легочные заболевания; атеросклероз, инфаркт миокарда, остеохондроз, диабет, язва желудка, туберкулез и онкологические заболевания.
Возможно, свободно-радикальное окисление является не только следствием этих болезней, но и одной из причин их возникновения.
К счастью, существуют механизмы самозащиты клеток. В организме свободно-радикальное окисление сдерживается многокомпонентной антиоксидантной системой, которая превращает радикалы в малоактивные соединения.
Эти функции осуществляют:
антиоксидантные ферменты: супероксиддисмутаза, каталаза, глутатионпероксидаза.
антиоксиданты (органические соединения с выраженными восстановительными свойствами)
Частичная детоксикация этих окислителей происходит при участии природных антиоксидантов, например, аскорбиновой кислоты, витамина Е и глутатиона. Кроме того, пероксид водорода обезвреживается под действием ферментов каталаз и пероксидаз:
2Н2О2
 О2
+ 2Н2О
О2
+ 2Н2О
Н2О2
+ ДН2
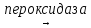 Д + 2Н2О
Д + 2Н2О
где ДН2 – восстановленные органические соединения, выступающие в роли донора водорода.
