
Энтропия при изохорном процессе
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:
![]()
Выше была выведена формула для определения количества теплоты. Перепишем ее в дифференциальном виде:
![]() ,
,
где ν — количество
вещества,
![]() —молярная
теплоемкость
при постоянном объеме. Итак, микроскопическое
изменение энтропии при изохорном
процессе можно определить по формуле:
—молярная
теплоемкость
при постоянном объеме. Итак, микроскопическое
изменение энтропии при изохорном
процессе можно определить по формуле:
![]()
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе:
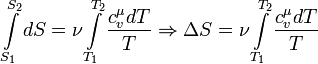
В данном случае выносить выражение молярной теплоемкости при постоянном объеме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
На графиках изображается линиями, которые называются изохоры. Для идеального газа они являются прямыми во всех диаграммах, которые связывают параметры: T (температура), V (объем) и P (давление).
Процессы в идеальном газе. Изобарический процесс.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе
![]() .
.
Работа, совершаемая
газом при расширении или сжатии газа,
равна
![]() .
.
Количество теплоты,
получаемое или отдаваемое газом,
характеризуется изменением энтальпии:
![]() .
.
Теплоёмкость
Молярная теплоёмкость при постоянном
давлении обозначается как
![]() .
В идеальном газе она связана с теплоёмкостью
при постоянном объёмесоотношением
Майера
.
В идеальном газе она связана с теплоёмкостью
при постоянном объёмесоотношением
Майера![]() .
.
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной:
для одноатомных газов
 ,
то есть около 20.8 Дж/(моль·К);
,
то есть около 20.8 Дж/(моль·К);для двухатомных газов
 ,
то есть около 29.1 Дж/(моль·К);
,
то есть около 29.1 Дж/(моль·К);для многоатомных газов
 ,
то есть около 33.3 Дж/(моль·К).
,
то есть около 33.3 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Изменение энтропии
Изменение энтропииприквазистатическомизобарном процессе равно .
В случае, если изобарный процесс
происходит в идеальном газе, то
.
В случае, если изобарный процесс
происходит в идеальном газе, то![]() ,
следовательно, изменение энтропии можно
выразить как
,
следовательно, изменение энтропии можно
выразить как .
Если пренебречь зависимостью
.
Если пренебречь зависимостью![]() от
температуры, то
от
температуры, то![]()
Процессы в идеальном газе. Изотермический процесс.
Изотермический процесс—термодинамический процесс, происходящий в физической системе при постоянной температуре.
Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Можно осуществить изотермический процесс иначе — с применением источников или стоков тепла, контролируя постоянство температуры с помощью термометров. К изотермическим процессам относятся, например, кипение жидкости или плавление твёрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
В идеальном
газе
при изотермическом процессе произведение
давления
на объём постоянно (закон
Бойля-Мариотта).
Изотермы идеального газа в координатах
![]() —гиперболы,
расположенные на графике тем выше, чем
выше температура, при которой происходит
процесс (см. рисунок).
—гиперболы,
расположенные на графике тем выше, чем
выше температура, при которой происходит
процесс (см. рисунок).
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна
![]() ,
где
,
где![]() —
число частиц газа,
—
число частиц газа,![]() —
температура,
—
температура,![]() и
и![]() —
объём газа в начале и конце процесса,
—
объём газа в начале и конце процесса,![]() —постоянная
Больцмана
.
—постоянная
Больцмана
.
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса записывается в виде:
![]()
где учитывается, что внутренняя энергиясистемы в изотермическом процессе не изменяетс
Процессы в идеальном газе. Адиабатический процесс.
Адиабати́ческий,
или адиаба́тный
проце́сс—термодинамический
процесс
в макроскопической системе, при котором
система не обменивается теплотой
с окружающим пространством.![]() Серьёзное исследование адиабатических
процессов началось в XVIII веке[1].
Серьёзное исследование адиабатических
процессов началось в XVIII веке[1].![]()
Адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна[2]. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы[3].
Обратимый
адиабатический процесс для идеального
газа
описывается уравнением Пуассона.![]() Линия, изображающая адиабатный процесс
на термодинамической диаграмме,
называется адиабатой
Пуассона.
Примером необратимого адиабатического
процесса может быть распространение
ударной
волны
в газе. Такой процесс описывается ударной
адиабатой.
Адиабатическими можно считать процессы
в целом ряде явлений природы. Так же
такие процессы получили ряд применений
в технике.
Линия, изображающая адиабатный процесс
на термодинамической диаграмме,
называется адиабатой
Пуассона.
Примером необратимого адиабатического
процесса может быть распространение
ударной
волны
в газе. Такой процесс описывается ударной
адиабатой.
Адиабатическими можно считать процессы
в целом ряде явлений природы. Так же
такие процессы получили ряд применений
в технике.![]()
Круговой процесс. Цикл Карно
Круговой процесс—процесс, при котором газ, пройдя через ряд состояний, возвращается в исходное. Если круговой процесс на диаграмме P-V протекает по часовой стрелке, то часть тепловой энергии, полученной от нагревателя, превращается в работу. Так работает тепловая машина.
Цикл Карно́ — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником[2].
Основное уравнение молекулярно-кинетической теории газа.
Содержание
Величина
Наименование
-
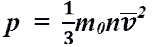 основное уравнение МКТ идеального
газа. Выведено в предположении, что
давление газа есть результат ударов
его молекул о стенки сосуда.
Это
же уравнение в другой записи:
основное уравнение МКТ идеального
газа. Выведено в предположении, что
давление газа есть результат ударов
его молекул о стенки сосуда.
Это
же уравнение в другой записи:
p - давление
Па = Н/м2
n - концентрация газа
1/м3
k = 1,38 .10-23
Дж/К
m0- масса молукулы
кг
v - средняя скорость молекул
м/с
T - абсолютная температура газа (to+ 273)
К
Eк- средняя кинетическая энергия молекул газа
Дж
Средняя кинетическая энергия молекул газа
|
Содержание |
Величина |
Наименование |
|
С |
Eк - средняя кинетическая энергия молекул газа |
Дж |
|
v - средняя скорость движения молекул |
м/с | |
|
n - концентрация молекул |
1/м3 | |
|
m0- масса молекулы |
кг | |
|
p - давление |
Па = Н/м2 | |
|
i - число степеней свободы, для одноатомного газа i = 3 |
- | |
|
T - абсолютная температура газа (to+ 273) |
К | |
|
k = 1,38 .10-23 |
Дж/К |

 редняя
кинетическая энергия молекул идеального
газа.
Другие формулы, где
встречается средняя энергия молекул
идеального газа:
С
редняя
кинетическая энергия молекул идеального
газа.
Другие формулы, где
встречается средняя энергия молекул
идеального газа:
С редняя
энергия движения молекул и
температура.
О
редняя
энергия движения молекул и
температура.
О сновное
уравнение МКТ идеального газа
сновное
уравнение МКТ идеального газа