
fx_zaochniki
.pdf
|
|
21 |
|
87. |
0.02 |
моляльный раствор Al2(SO4)3 |
ион SO42– |
88. |
0.002 |
моляльный раствор FeCl3 |
ион Fe3+ |
89. |
0.005 |
моляльный раствор K3PO4 |
ион K+ |
90. |
0.002 |
моляльный раствор ZnSO4 |
ион Zn2+ |
91. |
0.001 |
моляльный раствор FeCl2 |
ион Fe2+ |
92. |
0.002 |
моляльиый раствор CoCl2 |
ион Co2+ |
93. |
0.01 |
моляльный раствор NiSO4 |
ион Ni2+ |
94. |
0.02 |
моляльный раствор СrCl3 |
ион Сr3+ |
95. |
0.01 |
моляльный раствор Co(NO3)2 |
ион Co2+ |
96-115. Используя метод ионно-электронного баланса, найдите коэффициенты в уравнениях окислительно-восстановительных реакций:
96.K2Cr2O7 + SnCl2 + HCl KCl + SnCl4 + CrCl3 + H2O
97.Zn + PbO2 + HCl PbCl2 + ZnCl2 + H2O
98.K2Cr2O7 + PbCl2 + HCl KCl + PbO2 + CrCl3 + H2O
99.CrCl3 + FeCl2 FeCl3 + CrCl2
100.KNO2 + KMnO4 + HNO3 Mn(NO3)2 + KNO3 + H2O
101.K2SO3 + KMnO4 + H2SO4 MnSO4 + K2SO4 + H2O
102.K2Cr2O7 + K2S + H2SO4 S + K2SO4 + Cr2(SO4)3 + H2O
103.KI + KIO3 + H2SO4 I2° + K2SO4 + H2O
104.KMnO4 + KBr + H2SO4 MnSO4 + Br2 + K2SO4 + H2O
105.KI + Cl2° +H2O KIO3 +HCl
106.KMnO4 + FeCl2 + HCl MnCl2 + FeCl3 + KCl + H2O
107.Na3AsO3 + K2Cr2O7 + H2SO4 Na3AsO4 + Cr2(SO4)3 + K2SO4 + H2O
108.Na3AsO3 + K2MnO4 + H2SO4 Na3AsO4 + MnSO4 +K2SO4 + H2O
109.Bi2S3 + HNO3 Bi(NO3)3 + NOгаз + S + H2O
110.As2S3 + HNO3 H3AsO4 + H2SO4 + NO2, газ + H2O
111.Mg + HNO3 NH4NO3 + Mg(NO3)2 + H2O
112.Zn + H2SO4 ZnSO4 + H2S + H2O
113.H2SO4 + H2S° S + H2O
114.KMnO4 + KI + H2SO4 K2SO4 + I2° + MnSO4 + H2O
115.K2Cr2O7 + FeCl2 + HCl KCl + FeCl3 + CrCl3 + H2O
116 – 135. Рассчитайте поля устойчивости следующих соединений в координатах Eh – pH при стандартных условиях. При расчете концентрации всех ионов, кроме Н+, примите равными 10–6 моль/кг. Раствор считайте предельно разбавленным.
116.As4S4 Asкр. , H2S°
117.As2S3 As4S4 , H2S°
118.Bi2S3 Bi кр. , H2S°
119.CuO Cu2O
120.Cu2O Cu кр.
121.CuS Cu2S , H2S°
22
122.Cu2S Cu кр. , H2S°
123.FeOOH Fe3O4
124.Fe3O4 Fe2+
125.FeS2 Fe2+ , H2S°
126.FeS Fe кр. , H2S°
127.MnO2 Mn2O3
128.Mn2O3 Mn3O4
129.Mn3O4 Mn2+
130.Mn3O4, H2S° MnS
131.PbO2 Pb3O4
132.Pb3O4 Pb2+
133.PbSO4 Pb кр. , SO42–
134.U3O8 UO2(OH)2 2H2O
135.U3O8 UO22+

23
Методы решения задач к контрольной работе № 2.
ЗАДАЧИ № 27 – 35.
% концентрация= масса растворённого вещества в г 100 % общая масса раствора в г
Моляльная концентрация m [моль/кг]:
m = количестворастворённоговеществавмоль масса растворителя(H2O) вкг
ЗАДАЧИ № 36 – 50.
Какие ионы и молекулы образуются при растворении в воде следующей соли? Запищите все возможные реакции диссоциации, гидролиза и комплексообразования. Вычислите константу гидролиза по первой ступени и рН при гидролизе:
FeCl3, концентрация соли
•FeCl3 – сильный электролит, при растворении соль диссоциирует практически полностью
FeCl3 Fe3+ + 3Cl–
•Гидролизу будет подвержен многозарядный ион Fe3+ . Процесс гидролиза протекает ступенчато
Fe3+ + H2O FeOH2+ + H+ |
(I стадия) |
|||
FeOH2+ + H2O Fe(OH)2+ + H+ |
(II стадия) |
|||
Fe(OH)2+ + H2O Fe(OH)3° + H+ |
(III стадия) |
|||
• Выражение для константы гидролиза по первой ступени имеет вид: |
||||
K a = |
[FeOH 2+ ] [H+ ] |
(*) |
||
[Fe3+ ] |
|
|||
|
|
|||
•Значение константы гидролиза иона Fe3+ по первой ступени рассчитаем, используя уравнение изотермы-изобары (уравнение 11 Приложения 3) и значения стандартных химических потенциалов компонентов реакции
(Приложение 1)
∆rG°298 = µ°298(FeOH2+) + µ°298(H+) – µ°298(Fe3+) – µ°298(H2O) = = –240420 + 0 – (–17238) – (–237190) = +14008 Дж
|
∆ |
Go |
|
14008 |
|
|
|
lg K a = − |
r |
298 |
= |
|
= –2.454 |
(**) |
|
2.303 8.31441 298.15 |
|||||||
2.303RT |
|||||||
|
|
|
|
||||

24
•Из уравнения реакции гидролиза видно, что в результате гидролиза среда становится кислой (продуцируется ион оксония H+ ). Считая, что гидролиз ограничен первой стадией, имеем
Концентрация в моль/кг |
Fe3+ + H2O FeOH2+ + H+ |
||
|
|
10–7 |
|
до реакции |
0.01 |
0 |
|
после |
0.01 – x |
x |
10–7 + x |
• Полагая, что x >> 10–7 и комбинируя уравнения (*) и (**), получим
|
x 2 |
lg |
0.01−x = −2.454 |
Откуда
x= [FeOH2+] = [H+] ≈ 4.43 10–3 моль/кг2
•pH ≡ –lg[H+] = –lg(4.43 10–3) = 2.35 – среда действительно кислая.
ЗАДАЧИ № 51 – 66.
Вычислите растворимость газа в воде при заданном парциальном давлениях газа p и pH раствора при стандартной температуре:
NH3 p = 2 10–5 бар pН = 9.5
•Растворение газообразного аммиака NH3, газ протекает с образованием гидратированной молекулы NH3°:
|
NH3, газ NH3° |
(*) |
• |
Затем часть молекул NH3° подвергается гидролизу: |
|
|
NH3° + H2O NH4+ + OH– |
(**) |
• |
Растворимость газа S равна сумме концентраций NH3° и NH4+ : |
|
S= [NH3°] + [NH4+]
•Концентрацию NH3° найдем из константы равновесия реакции (*)
∆rG°298(*) = µ°298(NH3°) – µ°298(NH3, газ) = –26706 – (–16452) = –10255 Дж
|
[NH o |
] |
|
∆ Go |
|
−10255 |
|
|
lgK a = lg |
3 |
|
|
= − |
r 298 |
= − |
|
=1.797 |
pNH 3 |
|
|
2.303RT |
2.303 8.31441 298.15 |
||||
|
|
|
|
|
|
|||
Подставляя известное значение pNH3 , получим
[NH3°] = 2 10–5 101.797 = 1.252 10–3 моль/кг
• Аналогично для реакции (**) имеем
∆rG°298(**) = µ°298(NH4+) + µ°298(OH–) – µ°298(NH3°) – µ°298(H2O) = = –79454 – 157297 – (–26706) – (–237190) =27145 Дж
lg K a = lg |
[NH 4+ ] [OH − ] |
= − |
27145 |
= – 4.76 |
(***) |
||
[NH 3o ] |
|
2.303 8.31441 298.15 |
|||||
|
|
|
|
||||
2 Обратите внимание, действительно x >> 10–7 моль/кг

25
• |
При pH = 9.5 концентрация OH– равна |
|
||||||
|
|
− |
|
K |
|
10−14 |
|
|
|
[OH |
|
] = |
w |
= |
|
= 3.162 10–5 моль/кг |
|
|
|
[H + ] |
10−9.5 |
|||||
• |
Подставляя в (***) известные концентрации, находим |
|||||||
|
[NH + ] =10−4.76 1.252 10−3 |
= 6.881 10–4 моль/кг |
||||||
43.162 10−5
•Таким образом, общая растворимость аммиака при заданных условиях
S = [NH3°] + [NH4+] = 1.252 10–3 + 6.881 10–4 = 1.94 10–3 моль/кг
ЗАДАЧИ № 67 – 82.
Вычислите растворимость соли а) в чистой воде и б) при заданной моляльной концентрации иона. Раствор считайте предельно разбавленным, тем-
пература T = 298.15 K.
CaMoO4 |
[MoO42–] = 10–4 |
|
• Запишем реакцию растворения соли |
|
|
CaMoO4 Ca2+ + MoO42– |
(*) |
|
•Рассчитаем константу равновесия этой реакции, взяв данные из Прило-
жения 1
∆rG°298(*) = µ°298(Ca2+) + µ°298(MoO42–) – µ°298(CaMoO4) = = –552790 – 836382 – (–1439296) = 50124 Дж
lg K a = lg([Ca 2+ ] [MoO 24− ])= − |
|
50124 |
= –8.781 |
|
2.303 |
8.31441 298.15 |
|||
|
|
• При растворении в чистой воде из стехиометрии реакции (*) следует,
что [Ca2+] = [MoO42–]. Отсюда
[Ca2+] = [MoO42–] = (10−8.781 )0.5 = 4.07 10–5 моль/кг
• При заданной моляльной концентрации MoO42– имеем
[Ca |
2+ |
] = |
K a |
|
|
= |
10−8.781 |
= 1.66 10 |
–5 |
моль/кг |
||
|
|
|
|
|
|
|
|
|||||
|
[MoO |
24− ] |
10 |
−4 |
|
|||||||
|
|
|
|
|
|
|
||||||
ЗАДАЧИ № 83 – 95.
Вычислите ионную силу раствора ( I ) и активность заданного иона a . Расчет коэффициента активности иона γ с зарядом Q проведите по уравнению Дэвиса
0.01 моляльный растворAl2(SO4)3 ион Al3+
• Запишем реакцию электролитической диссоциации соли
Al2(SO4)3 2 Al3+ + 3 SO42–
концентрация, в моль/кг

|
|
26 |
|
до реакции |
0.01 |
0 |
0 |
после |
0 |
0.02 |
0.03 |
Записанные концентрации ионов соответствуют стехиометрии реакции.
• Вычислим ионную силу раствора
I = 21 ∑mi Qi2 = 0.5{0.02 (3)2 + 0.03 (–2)2} = 0.15 моль/кг
•Подставляя полученное значение I в уравнение Дэвиса, получим для трёхзарядного иона Al3+
|
2 |
|
|
|
0.150.5 |
|
|
|
|
lgγ3+ = −0.51 3 |
|
|
|
|
|
|
−0.2 0.15 |
|
= –1.143, |
|
|
|
|
0.5 |
|||||
|
|
1 |
+0.15 |
|
|||||
|
|
|
|
|
|
|
|||
откуда |
|
γ3+ = 0.072 |
|
|
|
||||
• Активность иона Al3+
aAl3+ = m Al3+γ3+ = 0.02 0.072 = 1.44 10–3 моль/кг
ЗАДАЧИ № 96 – 115.
Для подбора стехиометрических коэффициентов в ОВ реакциях пользуются методом ионно-электронного баланса. Его использование рассмотрим на примере ОВ реакции бихромат-иона Cr2O72– с сероводородом H2S в кислой среде с образованием ионов Cr3+ и аморфной серы S
K2Cr2O7 + H2S(газ) + H2SO4 Cr2(SO4)3 + S + K2SO4 + H2O
1.Oпределяют ионную форму CrVI2O72–, H2S–II, Cr+3, So элементов, изменяющих степени окисления в результате реакции.
2.Записывают две полуреакции, в
виде восстановления. |
Cr2O72– Cr3+ |
3.Сначала ставят коэффициенты So H2S
так, чтобы выровнять баланс Cr2O72– 2Cr3+ массы по элементу, изменяю- So H2S щему степень окисления.
4.Затем добавляют необходимое
количество моль H2O, чтобы Cr2O72– 2Cr3+ +7H2O выполнить баланс по кислороду So H2S
O.
5.Добавляют необходимое коли-
чество ионов водорода H+, что- Cr2O72– + 14H+ 2Cr3+ +7H2O бы выполнить баланс по водо- So +2H+ H S
роду. 2
6.Слева добавляют необходимое
количество электронов e, так Cr2O72– + 14H+ + 6e 2Cr3+ +7H2O
|
|
27 |
чтобы удовлетворить условию |
So +2H+ +2e H2S |
|
электронейтральности. |
|
|
7. Полученные уравнения полуре- |
|
|
акций домножают так, чтобы |
×1| Cr2O72– + 14H+ + 6e 2Cr3+ +7H2O |
|
обе содержали одинаковое ко- |
×3| So +2H+ +2e H2S |
|
личество электронов. |
3So +6H+ +6e 3H2S |
|
8. Вычитая вторую полуреакцию |
|
|
из первой (и сокращая электро- |
Cr2O72– + 14H+ + 6e + 3H2S 2Cr3+ |
|
ны) |
получают окончательный |
+7H2O + 3So +6H+ +6e |
ионный вид уравнения ОВ реак- |
|
|
ции. |
Cr2O72– + 8H+ + 3H2S 2Cr3+ + 7H2O + 3So |
|
|
||
9. Чтобы получить молекулярный |
2K+ + 4SO42– = 2K+ + 4SO42– |
|
вид уравнения реакции, справа и |
|
|
слева |
добавляют необходимые |
|
одинаковые количества ионов |
|
|
K2Cr2O7 + 4H2SO4 + 3H2S Cr2(SO4)3 + K2SO4 + 7H2O + 3So
ЗАДАЧИ № 116 – 135.
Рассчитайте поля устойчивости следующих соединений в координатах Eh – pH при стандартных условиях. При расчете концентрации всех ионов, кроме Н+, примите равными 10–6 моль/кг. Раствор считайте предельно разбавленным.
PbSO4 Pb2+. , H2S°
• Отметим элемент, изменяющий степень окисления
S+VI S–II
• Запишем уравнение полуреакции в виде восстановления
PbSO4 + 10H+ + 8e Pb2+ + H2S° + 4H2O
• Запишем уравнение Нернста этой полуреакции (уравнение 14 Прило-
жения 3)
|
o |
|
0.05916 |
|
[Pb 2+ ] [H2So ] |
|
|
|
|
||
Eh = E h |
− |
|
lg |
|
|
= |
|
||||
8 |
[H + ]10 |
(*) |
|||||||||
|
|
|
|
|
|
|
|||||
= Eho − |
0.05916 |
lg([Pb 2+ ] |
[H2So ])−0.05916 |
|
10 |
||||||
|
pH |
||||||||||
8 |
|
8 |
|||||||||
|
|
|
|
|
|
|
|
||||
Видно, что окислительно-восстановительный потенциал Eh зависит как от концентраций ионов в растворе, так и от величины кислотности раство-
ра (pH).
•Вычислим стандартный окислительно-восстановительный потенциал полуреакции Eh°, воспользовавшись данными Приложения 1:
28
∆rG°298 = µ°298(Pb2+) + µ°298(H2S°) + 4µ°298(H2O) – µ°298(PbSO4) – 10µ°298(H+) = –23890.6 – 27920 + 4 (–237190) – (–813010) – 10 (0) = –187560.6 Дж
E ho = − 8−187560.696484.56 = 0.243 В
•Подставляя в уравнение Нернста (*) известные значения Eh° и концентраций [Pb2+] = [H2S°] = 10–6, получим зависимость Eh(pH):
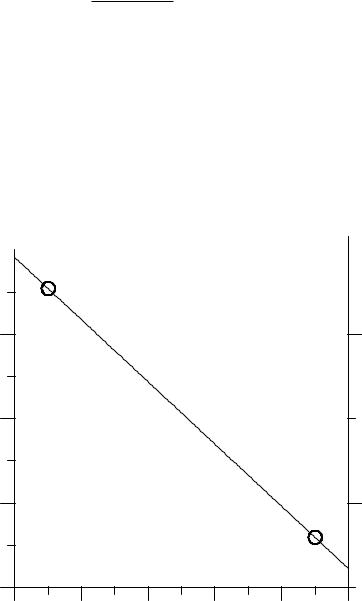
Eh = 0.243 + 0.0887 – 0.07395 pH = 0.3317 – 0.07395 pH
•Эта зависимость представляет собой уравнение прямой линии в коор-
динатах Eh – pH. Задавая любые два значения pH в диапазоне 2 – 12, находим соответствующие им значения Eh . Результаты наносим на диаграмму.
•Выше линии находится поле устойчивости окисленной формы серы (PbSO4), а ниже – восстановленной (H2S°). Положение линии отвечает
0.2










0.0
, [B] |
|
PbSO4 |
|
-0.2 |
10-6 |
||
h |
|||
E |
|
|
|
|
Pb2+ |
, H So |
|
|
-0.4 |
2 |
-0.6
2 |
4 |
6 |
8 |
10 |
12 |
pH
концентрациям ионов в растворе, равным 10–6 моль/кг.
|
|
|
|
29 |
|
|
|
|
|
|
Приложение 1. Термодинамические свойства |
|
компонентов при стандартных условиях |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
Минерал |
∆fH298o |
µ298o |
S298o |
|
Vm |
Cp |
[Дж/моль/К] = a + b T - c/T2 |
|||
|
Дж/моль |
Дж/моль |
Дж/моль/К |
|
см3/моль |
a |
|
b 103 |
c 10–5 |
|
Ak |
-3876520 |
-3679070 |
209.33 |
|
92.810 |
177.19 |
|
23.16 |
|
40.50 |
Alm |
-5287700 |
-4953960 |
307.10 |
|
115.270 |
467.52 |
|
50.88 |
|
143.76 |
An |
-4227830 |
-4002070 |
199.29 |
|
100.790 |
264.89 |
|
61.90 |
|
64.60 |
And |
-2590270 |
-2442800 |
93.77 |
|
51.560 |
172.47 |
|
26.12 |
|
50.99 |
Ann |
-5208050 |
-4849640 |
389.18 |
|
154.300 |
162.42 |
|
464.08 |
|
0.00 |
As |
0 |
0 |
35.65 |
|
12.963 |
23.57 |
|
2.98 |
|
-1.67 |
As2S3 |
-88517 |
-91487 |
163.40 |
|
70.520 |
40.71 |
|
-140.75 |
|
69.52 |
As4S4 |
-140302 |
-132721 |
245.52 |
|
119.200 |
216.61 |
|
38.91 |
|
19.62 |
Atg |
-8732950 |
-8078880 |
445.18 |
|
209.120 |
634.46 |
|
264.42 |
|
147.10 |
Ath |
-12083920 |
-11356170 |
530.82 |
|
264.460 |
755.97 |
|
253.44 |
|
160.92 |
Azr |
-1632178 |
-1399201 |
280.20 |
|
91.01 |
154.31 |
|
324.01 |
|
3.85 |
Bi |
0 |
0 |
56.90 |
|
21.309 |
18.79 |
|
22.59 |
|
0.00 |
Bi2O3 |
-573880 |
-493450 |
151.46 |
|
49.730 |
103.41 |
|
33.44 |
|
0.00 |
Bi2S3 |
-155500 |
-152900 |
200.22 |
|
75.529 |
90.43 |
|
54.76 |
|
0.00 |
Brc |
-925307 |
-834270 |
63.18 |
|
24.630 |
100.60 |
|
18.31 |
|
25.26 |
Brd |
-2135720 |
-2199100 |
120.38 |
|
58.630 |
133.17 |
|
51.50 |
|
19.39 |
Cal |
-1207370 |
-1128850 |
91.71 |
|
36.930 |
99.55 |
|
27.14 |
|
21.48 |
Cd |
0 |
0 |
51.76 |
|
13.000 |
22.22 |
|
12.30 |
|
0.00 |
CdO |
-258200 |
-228510 |
54.81 |
|
15.585 |
40.88 |
|
8.44 |
|
0.00 |
CdO |
-258200 |
-228510 |
54.81 |
|
15.585 |
40.88 |
|
8.44 |
|
0.00 |
CdS |
-149600 |
-145630 |
70.29 |
|
29.934 |
53.92 |
|
3.76 |
|
0.00 |
Cnc |
-8879720 |
-8231560 |
471.62 |
|
211.540 |
670.36 |
|
189.07 |
|
166.02 |
Cr2O3 |
-1134700 |
-1053060 |
81.17 |
|
29.090 |
119.25 |
|
9.20 |
|
15.62 |
Crd |
-9161520 |
-8651100 |
407.20 |
|
233.220 |
601.78 |
|
107.95 |
|
161.50 |
Crn |
-1675700 |
-1582200 |
50.92 |
|
25.570 |
97.06 |
|
39.02 |
|
26.36 |
Ctl |
-4363220 |
-4035600 |
221.33 |
|
107.150 |
317.23 |
|
132.21 |
|
73.55 |
Cu |
0 |
0 |
33.15 |
|
7.113 |
22.63 |
|
6.28 |
|
0.00 |
Cu2O |
-168610 |
-146030 |
93.14 |
|
23.437 |
59.12 |
|
24.22 |
|
3.34 |
Cu2S |
-80115 |
-85430 |
116.15 |
|
27.475 |
21.92 |
|
148.28 |
|
-9.58 |
|
|
|
|
|
|
|
|
|
|
|
30
Минерал |
∆fH298o |
µ298o |
S298o |
Vm |
Cp [Дж/моль/К] = a + b T - c/T2 |
|||
|
Дж/моль |
Дж/моль |
Дж/моль/К |
см3/моль |
|
|
|
|
|
a |
b 103 |
c 10-5 |
|||||
CuO |
-157320 |
-129560 |
42.63 |
12.220 |
48.05 |
8.09 |
7.26 |
|
CuS |
-48575 |
-49160 |
67.15 |
20.420 |
43.05 |
20.17 |
1.38 |
|
Di |
-3203260 |
-3029060 |
143.09 |
66.090 |
221.21 |
32.80 |
65.86 |
|
Dol |
-2329860 |
-2167070 |
155.18 |
64.340 |
187.07 |
74.39 |
45.81 |
|
Dsp |
-999800 |
-921300 |
35.34 |
17.760 |
46.94 |
64.18 |
11.30 |
|
Dsp |
-999800 |
-921300 |
35.34 |
17.760 |
46.97 |
64.18 |
11.30 |
|
En |
-1544840 |
-1457940 |
67.77 |
31.270 |
102.72 |
19.83 |
26.27 |
|
Fa |
-1479360 |
-1379260 |
148.32 |
46.390 |
152.76 |
39.16 |
28.03 |
|
Fe |
0 |
0 |
27.48 |
7.092 |
-0.92 |
50.80 |
-9.56 |
|
Fe2O3 |
-823000 |
-740930 |
87.40 |
30.274 |
98.20 |
80.62 |
16.43 |
|
Fe3O4 |
-1113000 |
-1009680 |
146.20 |
44.524 |
79.76 |
225.40 |
-3.40 |
|
Fe-Crd |
-8460200 |
-7971490 |
469.60 |
232.080 |
618.02 |
111.00 |
156.52 |
|
FeO |
-264000 |
-243350 |
60.80 |
12.000 |
49.22 |
10.17 |
2.07 |
|
FeOOH |
-558980 |
-490230 |
67.36 |
20.820 |
80.19 |
28.51 |
12.63 |
|
FeS |
-101300 |
-101530 |
60.31 |
18.200 |
-33.77 |
246.87 |
-9.52 |
|
FeS2 |
-171000 |
-159480 |
52.93 |
23.940 |
72.39 |
8.85 |
11.43 |
|
Fo |
-2174690 |
-2055650 |
95.19 |
43.790 |
149.83 |
27.36 |
35.65 |
|
Fs |
-2390386 |
-2239176 |
181.00 |
65.900 |
221.66 |
42.42 |
46.44 |
|
Gbs |
-1293130 |
-1154890 |
68.44 |
31.956 |
56.02 |
168.87 |
12.80 |
|
Grs |
-6636340 |
-6274580 |
255.50 |
125.300 |
435.21 |
71.18 |
114.30 |
|
Hd |
-2837907 |
-2673568 |
170.29 |
68.270 |
229.32 |
34.18 |
62.80 |
|
Hel |
-3981990 |
-3783000 |
209.95 |
90.240 |
266.69 |
33.70 |
63.26 |
|
Hrz |
-1966480 |
-1850740 |
106.27 |
40.750 |
90.25 |
111.67 |
0.00 |
|
Jd |
-3029400 |
-2850730 |
133.47 |
60.400 |
201.50 |
47.78 |
49.66 |
|
Kfs |
3975010 |
3749650 |
214.20 |
108.720 |
320.57 |
18.04 |
125.29 |
|
Kln |
-4119780 |
-3799600 |
204.97 |
99.520 |
304.47 |
122.17 |
90.04 |
|
Lc |
-3038650 |
-2875890 |
200.20 |
88.39 |
478.42 |
134.25 |
21.64 |
|
Lmt |
-7252160 |
-6698200 |
478.11 |
203.800 |
487.23 |
263.01 |
88.16 |
|
Lrn |
-2306700 |
-2191740 |
126.72 |
51.600 |
145.90 |
40.75 |
26.19 |
|
Lvs |
-4864030 |
-4508730 |
231.33 |
101.320 |
283.71 |
219.99 |
63.94 |
|
Mal |
-1053950 |
-8962230 |
186.19 |
54.86 |
116.15 |
183.18 |
5.61 |
|
Mc |
-3975010 |
-3749650 |
214.2 |
108.72 |
320.57 |
18.04 |
125.29 |
|
|
||||||||
Mer |
-4563180 |
-4336080 |
252.89 |
48.850 |
305.01 |
49.99 |
60.36 |
|
Mg-Crd |
-9161520 |
-8651100 |
407.20 |
233.220 |
601.78 |
107.95 |
161.50 |
|
|
|
|
|
|
|
|
|
|
