- •1.1. Основы геометрической кристаллографии
- •1.1.1. Элементы симметрии кристаллов
- •1.1.2. Простые формы кристаллов низшей и средней категорий
- •1.1.3. Простые формы кристаллов кубической сингонии
- •1.2. Основы кристаллохимии
- •1.2.1. Типы химической связи в кристаллах
- •1.2.2 Структуры кристаллов. Структурные мотивы.
- •Часть I. Глава 2 общие сведения о минералах
- •2. Общие сведения о минералах
- •2.1. Химический состав и кристаллическая структура минералов
- •2.2. Физические свойства минералов
- •Что такое минерал, минералогия и чем занимаются минералоги?
- •Основные элементы кристаллографии и кристаллохимии
- •Физические свойства минералов
- •Процессы минералообразования в природе
1.1.3. Простые формы кристаллов кубической сингонии
|
|
|
Рис. 9. Простые формы кубической сингонии. |
Кубический тетраэдр - простая форма, образованная четырьмя равными равносторонними треугольными гранями, перпендикулярными осям 3-го порядка (рис.9).
Куб - простая форма, образованная шестью равными попарно параллельными квадратными гранями (рис. 9), образующими друг с другом углы 90о. Грани куба перпендикулярны осям четвертого порядка (L4).
Октаэдр ( от греч."окта"- восемь,"эдр"- грань) - простая форма, образованная восемью равными равносторонними треугольными попарно параллельными гранями (рис. 9), перпендикулярными осям третьего порядка (L3).
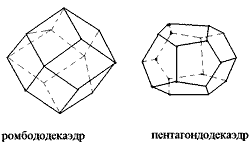
Ромбододекаэдр (от греч."додека" - двенадцать) - простая форма, образованная 12 равными гранями, имеющими форму ромба (рис. 11).
Пентагондодекаэдр (от греч."пента"- пять) - закрытая простая форма, которая состоит из 12 равных граней, имеющих форму неправильных пятиугольников (рис. 11).
|
|
|
Рис. 10. Простые формы высшей категории. |
|
|
|
Рис. 11. Кристаллы, образо- ванные комбинацией двух простых форм: 1 - призмы и бипирамиды, 2 - куба и октаэдра. |
Сочетание нескольких простых форм в одном кристалле часто совершенно искажает форму граней, характерную при ее полном развитии, поэтому при определении простых форм в комбинациях нельзя основываться только на форме граней. Главными критериями следует считать число равных граней и их расположение относительно элементов симметрии.
1.2. Основы кристаллохимии
Внешний облик ограненных кристаллов во многом определяется особенностями их кристаллической структуры. С развитием рентгено-структурного анализа стала очевидной связь между закономерным атомным строением кристаллов и их физическими и химическими свойствами. Изучением этих связей занимается наука кристаллохимия, законы которой являются необходимой базой, объясняющей особенности физических и химических свойств кристаллов минералов. Рассмотрим эти основные законы и понятия.
1.2.1. Типы химической связи в кристаллах
Силы, которые связывают вместе атомы (ионы) в кристаллах - это электрические силы. Их тип и величина во многом определяют физические и химические свойства минералов. Используя представления о валентных электронах, принято выделять четыре основных типа химической связи в минералах.
Металлическая связь характерна для элементов первых групп Периодической системы и интерметаллидов. Их атомы, как известно, имеют крупные размеры, а внешние электроны слабо связаны с ядром. В кристаллической решетке металлов внешние электроны свободно перемещаются в пространстве между атомами. Они образуют своеобразный "электронный газ" и обусловливают основные свойства металлов: высокую пластичность, ковкость, высокую теплопроводимость, высокую электропроводность, малую твердость, невысокие точки плавления и кипения. Связь не направленная. Энергия металлической связи составляет десятки килокалорий на моль.
Ковалентная (гомеополярная) связь осуществляется за счет обобществления электронов на внешних валентных орбиталях двух соседних атомов, таким образом, что оба они приобретают стабильную конфигурацию благородного газа. Ковалентная связь строго направленная, насыщаемая и очень прочная. Энергия связи составляет до 170 ккал/моль. Минералы с таким типом связи характеризуются нерастворимостью, большой устойчивостью, высокой твердостью, высокими точками плавления и кипения, полупроводниковыми свойствами.
Ионная (гетерополярная) связь реализуется между атомами различного сорта за счет электростатического взаимодействия положительно заряженных катионов и отрицательно заряженных анионов, при этом валентные электроны переходят от металла к аниону. Связь ненаправленная и ненасыщенная. Энергия ионной связи тем больше, чем больше разница электроотрицательности между элементами (для NaCl - 180 ккал/моль). Кристаллы с ионным типом связи растворяются в полярных растворах (вода), для них характерны диэлектрические свойства, хрупкость, низкая тепло- и электропроводность, средние плотность и твердость, весьма высокие точки плавления и кипения.
Ван-дер-ваальсова (остаточная) связь соединяет нейтральные молекулы или структурные единицы с помощью малых остаточных зарядов на их поверхности, образующихся за счет мгновенных дипольных моментов "ядро-электрон", между которыми начинают действовать силы притяжения. Это явление носит название дисперсионного эффекта и служит главной причиной возникновения ван-дер-ваальсовой связи. Кроме того могут возникать и другие эффекты (ориентационный, индукционный). В разных соединениях сила каждого эффекта различна. Ван-дер-ваальсова связь одна из самых слабых химических связей и, присутствуя в минералах в качестве добавочной, определяет зоны хорошей спайности и низкой твердости (графит).
Среди ван-дер-ваальсовых связей особое место занимает так называемая водородная связь, рассматриваемая часто как самостоятельный тип связи. Она возникает за счет коллективного использования протона двумя атомами, например, кислорода, входящего в состав воды, и кислорода стенок каркаса, в котором эта молекула воды находится. Водородная связь слабее ионной или ковалентной, но сильнее обычной ван-дер-ваальсовой. Энергия водородной связи колеблется от 5 до 10 ккал/моль.
Гомодесмическими называются структуры кристаллов, в которых связь между всеми атомами одинакова.
Гетеродесмическими называются структуры кристаллов, в которых сосуществуют несколько типов химической связи.