
Физиология возбудимых тканей II
.pdf
6)синапсы легко восприимчивы к фармакологическим препаратам
сразличными механизмами действия, следовательно изменением работы синапса можно корректировать патологические процессы в организме;
7)низкая скорость проведения возбуждения в синапсе, получившая название синаптической задержки;
8)медленные протекания ионных токов в синаптических мембранах, неспособность синапсов пропускать ПД, следующие с большой частотой без трансформации ритма – без его понижения;
9)быстрая утомляемость синапсов, т.е. потеря способности выпо л- нять свои функции, чаще из-за истощения запасов медиатора;
10)большая чувствительность синапсов к ядам и к недостатку кислоро-
да.
ФИЗИОЛОГИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ
РАБОТА СКЕЛЕТНЫХ МЫШЦ
Общие принципы мышечного сокращения. Основная функция ске-
летных мышц – сокращение, в результате которого опорно-двигательный аппарат в целом совершает изменение позы и передвижение. Строение мышцы представлено на рисунке 7. Иннервированы мышцы только аксонами мотонейронов (см. рис.3). Каждый аксон ветвится и образует синапсы с множеством мышечных волокон, формируя нейро -моторную единицу. Основными свойствами скелетной мышцы являются возбудимость (способность к генерации ПД), проводимость (способность проводить ПД вдоль мембраны) и сократимость – способность к напряжению и изменению длины.
Сокращение скелетного мышечного волокна осуществляется следующими последовательными шагами.
1.Потенциал действия распространяется вдоль мотонейрона до нерв- но-мышечного синапса.
2.Нервно-мышечный синапс возбуждает мембрану мышечного во-
локна.
3.ПД распространяется вдоль всей мембраны мышечного волокна таким же образом, как и по нервному волокну.
4.Деполяризация мембраны мышечного волокна вызывает выход большого количества ионов Са++ из гладкой эндоплазматической сети мышечного волокна.
-21 -
Рис.7. М акро- и микроскопическое строение скелетной мышцы (Vander et al.,
1985).
- 22 -

5.Ионы Са++ запускают взаимодействие актиновых и миозиновых филаментов – взаимное скольжение вдоль друг друга – и уменьшение длины мышечного волокна (сокращение).
6.Са++ активно возвращается в гладкую ЭПС и хранится там до следующего ПД, или частично активно выводится наружу. Сокращение прекращается и мышца возвращается к исходной длине (расслабление).
Электро-механическое сопряжение. Процесс, в котором ПД поверхно-
стной мембраны приводит к взаимодействию актина и миозина и сокра-
щению мышцы, называется электромеханическим сопряжением..
ПД, распространяющийся вдоль мембраны, не может вызвать электрические токи или другие эффекты глубоко в толще мышечного волокна, потому что, во-первых, между мембраной мышечного волокна и миофибриллами находится сложный субмембранный комплекс, во-вторых, мышечное волокно очень большое. Но в мышечных волокнах развиваются глубокие
впячивания мембраны – Т-трубочки (transverse tubulеs). С обеих сторон к Т-трубочкам подходят цистерны гладкой ЭПС, содержащие Са++. Вместе с Т-трубочкой 2 цистерны образуют триаду (рис.8). Если одновременно регистрировать развитие ПД и сокращение мышцы, то между окончанием ПД
иначалом сокращения, длительность которого не менее 100 мс, проходит от
10 до 300 мс, т.е. ПД запускает не непосредственно сокращение мышцы, а выход Са++ из гладкой ЭПС, для развития которого нужно минимум 10 мс и который активизирует длительный процесс сокращения. Следовательно, процессы возбуждения и сокращения мышцы в норме являются сопряжен-
ными: возбуждение инициирует процесс выхода Са++ и дальнейшее сокращение протекает уже независимым от возбуждения путем. Увеличение количества Са++ в цитозоле во время сокращения доказывается прямыми измерениями внутриклеточного содержания Са++ селективным микроэлектродом или Са++-зависимыми флуоресцентыми красителями. Искусственное введение Са++ в мышцу через микропипетку приводит к мышечному сокращению в отсутствие возбуждения. Разрушение гладкой ЭПС или блокирование выхода Са++ сохраняет ПД мембраны мышечного волокна, но сокращение мышцы прекращается.
Механизм выхода ионов Са++ из гладкой ЭПС под действием ПД окончательно не выяснен. Существуют две гипотезы (первая практически не упоминается в современной учебной литературе).
1. Каждая цистерна образует выпячивания в сторону Т-трубочки и входящий трансмембранный электрический ток, возникающий при раз-
- 23 -
витии ПД, открывает Са++-каналы на мембране гладкой ЭПС и обеспечивает выход Са++ (рис.9).
Рис.8. Общая схема электро-механического сопряжения в скелетной мышце
(Vander et al., 1985).
- 24 -

Рис.9. Выход Са++ из гладкой ЭПС при деполяризации саркоплазматической мембраны распространяющимися потенциалами действия и обратный захват Са++ в
ЭПС Са++-АТФазой (Guyton, Hall, 1996).
2. Деполяризация мембраны Т-трубочки изменяет конформацию белка DHP (дигидропиридин) и его положение в мембране. В результате открывается Са++-высвобождающий-RyR-канал (рианодин) на мембране гладкой ЭПС и Са++ выходит в цитоплазму (рис.10).
Са++-канал в гладкой ЭПС остается открытым несколько миллисекунд и Са++, необходимый для сокращения мышц, высвобождается в пространство между миофиламентами. В покое концентрация Са++ в ЭПС составляет примерно 10-4 Моль/л, а в цитоплазме только 10-8-10-7 Моль/л. Через открытые каналы Са++ свободно перемещается в цитоплазму и его концентрация там быстро возрастает до пороговой для мышечного сокращения величины
– 10-6 Моль/л и может увеличиться до 10-5-10-4 Моль/л.
Молекулярный механизм процесса мышечного сокращения. Уве-
личение концентрации Са++ в цитоплазме обеспечивает процесс мышечного сокращения, запуская контакт актиновых и миозиновых филаментов и уменьшение длины саркомера (рис.11).
- 25 -
Рис.10. Высвобождение Са++ из гладкой ЭПС изменением конформации белка DHP при деполяризации мембраны (Bullock et al., 1995).
Рис.11. Актин-миозиновое взаимодействие в процессе мышечного сокращения
(объяснения см. в тексте) (Bullock et al., 1995).
- 26 -
1. Перед сокращением головка миозина, обладающая АТФ-азной активностью, в присутствии ионов Mg++ связывает и немедленно расщепляет АТФ, но продукты распада – АДФ и Ф – не отщепляются от миозина. В таком состоянии головка миозина перпендикулярна актиновой нити и имеет запас энергии. Но эта энергия не может высвободиться до момента связывания миозина с актином.
2.Когда тропонин-тропомиозиновый комплекс объединяется с Са++, на белке актине освобождается участок связывания с миозином и образуется поперечный мостик между головкой миозина и актином.
3.Образование комплекса миозин-актин высвобождает энергию, аккумулированную в головке миозина. Головка меняет свою конформацию, изгибаясь и перемещая актин и миозин вдоль друг друга.
4.Когда головка миозина сгибается, прикрепленные к ней АДФ и Ф отщепляются. На то же место прикрепляется следующая АТФ. Только после связывания очередной молекулы АТФ поперечный мостик распадается. Если АТФ нет, то распада молекул не происходит, например, при ко н- трактуре или трупном окоченении.
5.После распада связи миозин-актин, молекула АТФ вновь расщепляется до АДФ и Ф и начинается новый цикл перемещения. Энергия распада АТФ перемещает головку в энергетически активное положение – перпендикулярно молекуле актина, которое будет использовано в новом "греб - ковом" цикле.
6.Головка миозина с запасом энергии от распада АТФ связывается с новым участком на молекуле актина, вновь использует эту энергию для нового "гребка" и дополнительно перемещает молекулы актина и миозина
вдоль друг друга. И т.д.
Пока Са++ в высокой концентрации остается в цитоплазме, м ышечное
волокно находится в сокращенном состоянии. Но постоянно работающая Са++-АТФаза на мембране гладкой ЭПС активно возвращает Са++ в ЭПС. Этот насос способен переместить в цистерну примерно 10000 ионов. Вну т-
ри ЭПС находится белок calsequestrin, который связывает в 40 раз больше Са++, чем его находится внутри цистерны ЭПС в ионизированном виде. Такой массивный транспорт Са++ внутрь гладкой ЭПС приводит к практически полному изъятию Са++ из цитоплазмы и до следующего ПД он будет поддерживаться в цитоплазме на крайне низком уровне. Возвращение Са++ в
ЭПС сопровождается расслаблением мышцы.
При некоторых патологических состояниях возвращение Са++ в гладкую ЭПС не происходит (например, при гиперкалиемии до 8-12 мМ/л и бо-
-27 -
лее, вызывающей стойкую деполяризацию мембраны) и возникает длительное сокращение мышцы в отсутствие ПД мембраны – контрактура. Тонические волокна находятся в состоянии контрактуры столько же времени, сколько длится деполяризация. В фазных волокнах контрактура сменяется адаптационным расслаблением и сократительной рефрактерностью: волокно полностью расслабляется и теряет способность отвечать сокращением на дополнительную деполяризацию. Способность актина и миозина к взаимодействию при этом сохраняется, например, введение кофеина внутримышечно приводит к сокращению мышцы (кофеиновая контрактура). Сле - довательно, сократительная рефрактерность возникает из-за нарушения электромеханического сопряжения при длительной деполяризации. Во зникает разобщение процессов возбуждения и сокращения (электромеханическая диссоциация).
Укорочение и сила сокращения мышц
Укорочение и сила сокращения мышц развиваются как следствие скольжения актиновых и миозиновых филаментов относительно друг др уга. Сила, приложенная к мышце, называется нагрузкой. Сила, развиваемая сокращающейся мышцей в ответ на нагрузку, называется напряжением. Нагрузка и напряжение – противоположные по направлению силы. Движение мышцы (сокращение), зависит от соотношения нагрузки и напряжения, развиваемого мышцей. Чтобы передвигать груз, напряжение должно быть больше нагрузки.
Сила, возникающая при каждом "гребке", трансформируется через сарколемму и сухожилия в работу. Актин и миозин можно рассматривать как сократительные компоненты, а соединительнотканые оболочки, сухожилия и другие дополнительные структуры мышцы представляют собой
систему эластических компонентов (series elastic component) (рис.12).
Изометрическое сокращение. Если мышца развивает напряжение, а длина ее при этом не изменяется, сокращение называется изометрическим. Оно возникает при попытке мышцы поднять груз больший, чем напряжение, которое мышца может развивать, или при фиксации мышцы. Напряжение возрастает за счет выхода Са++ из гладкой ЭПС. Силы, развиваемые "гребковыми движениями", растягивают последовательный эластический компонент. С каждым "гребком" укорачивается саркомер, но на такую же величину удлиняется последовательный эластический компонент, иначе длина мышцы не может оставаться неизменной. Согласно дру-
- 28 -

|
в работу дополнительное количество волокон и сила сокращения увеличи- |
|
гому мнению, при изометрическом |
вается. Если сила раздражения велика и одновременно возбуждает все ней- |
|
сокращении длина саркомера не ме- |
ро-моторные единицы, сила сокращения мышцы максимальна. |
|
няется потому, что поперечные мос- |
2. Растяжением саркомера перед сокращением до lo, примерно |
|
тики оказывают давление на актино- |
равной 2,2 мкм. Сила изометрического сокращения зависит от длины мы- |
|
вые нити, но, хотя напряжение воз- |
шечного волокна до начала сокращения (эта связь называется "соотноше- |
|
растает, взаимного скольжения фи- |
ние длина–напряжение" (length-tension relationship). Перекрывание между |
|
ламентов не происходит. |
толстыми и тонкими нитями определяет количество возможных мостиков |
|
|
между актином и миозином, которые будут работать во время сокращения: |
|
|
|
при длине саркомера lo (в среднем 2,2 мкм) каждая головка миозина |
|
контактирует с актином, работает и мышца развивает максимальную силу |
|
|
сокращений; |
|
|
|
если исходная длина саркомера 170% от lo (в среднем 3,5 мкм), кон- |
|
такта между актином и головками миозина нет, сокращение не развивается |
|
|
ни при какой стимуляции мышцы; |
|
|
|
если длина саркомера перед началом сокращения 40% от lo (в сред- |
|
нем 1,5 |
мкм), Z-линия касается толстых филаментов и сокращение невоз- |
|
можно (рис. 13). |
|
А |
Б |
Рис.12. Сократительный и эластический компоненты в работающей мышце (А) и их активация при одиночном и тетаническом сокращениях (Б) (Sherwood, 1990).
Повысить силу изометрического сокращения можно как минимум тремя путями.
1. Повышением силы раздражения, количества активных нейро - моторных единиц и синхронности их работы. Небольшая сила раздраже-
ния активирует только часть низкопороговых нейро -моторных единиц, которые развивают сокращение. Повышение силы сокращения вовлекает
- 29 -
Рис.13. Зависимость силы сокращения мышцы от длины саркомера перед со-
кращением (Vander et al., 1985).
- 30 -

3. Повышением частоты стимуляции и переводом мышцы в тета-
нический режим сокращения. |
|
Повышение частоты стимуляции увеличивает продолжительность |
и |
силу сокращения мышцы. Так как длительность ПД 2-5 мс, а длительность одиночного сокращения не менее 100 мс, мембрана может генер ировать второй ПД во время первого сокращения. Он вызовет дополнительный выход ионов Са++ из ЭПС и увеличит продолжительность форм ирования гребковых движений и сокращения мышцы. Состояние сокращения поддерживается весь период стимуляции (до наступления утомления) и называется тетанус. При неполном расслаблении наблюдается зубчатый тетанус. При высокой частоте стимуляции сокращения сливаются в гладкий тетанус, амплитуда которого в 3-5 раз больше, чем амплитуда одиночного сокращения (рис.14).
Рис.14. Одиночное и тетанические сокращения в скелетной мышце (Vander et al., 1985).
Повышение амплитуды при тетаническом сокращении зависит не от количества Са++ и числа гребковых движений, а от времени нахождения Са++ в цитоплазме и системы эластических компонентов.
При одиночном сокращении Са++ очень быстро возвращается обратно и максимальное напряжение успевает развить только сократительный ком - понент волокна(внутреннее напряжение). Са++, который выходит в цитоплазму при одиночном ПД, достаточно для максимального укорочения саркомера. Но система эластических компонентов успевает развить максимальное напряжение (внешнее напряжение), при котором развивается
- 31 -
максимально возможная амплитуда сокращения, если поперечные мостики, создающие внутреннее напряжение, сохраняются долгое время, т.е. ис - ключительно в тетаническом режиме (см. рис.12).
Изотоническое сокращение возникает, когда мышца укорачивается. Длина мышцы изменяется. Напряжение остается постоянным.
При изотоническом сокращении:
Начальное сокращение мышцы всегда изометрическое, потому что мышца только тогда начинает укорачиваться, когда сила (напряжение), развиваемая мышцей, станет равной силе, приложенной к мышце извне (нагрузке);
когда мышца укорачивается, сила сокращения остается равной нагрузке и постоянной, поэтому сокращение и называется изотоническим;
скорость укорочения мышцы остается постоянной.
Если нагрузка мышцы возрастает, то продолжительность времени изотонического сокращения увеличивается, потому что эластический ко мпонент должен растягиваться больше, чтобы трансформировать силу, достаточную, чтобы поднять больший вес.
Скорость укорочения мышцы падает, так как продолжительность каждого "гребка" увеличивается. Отношение между скоростью укорочения и нагрузкой – важнейшая характеристика работы мышцы. Наибольшая скорость укорочения мышцы наблюдается тогда, когда нагрузки нет. Если нагрузка больше напряжения, то скорость укорочения мышцы равна нулю (изометрический режим).
Мышечная энергетика
В процессе мышечного сокращения АТФ используется трижды:
1)для активации головки миозина;
2)для отрыва головки миозина от актина и последующего гребка;
3)для возвращения Са++ обратно в гладкую ЭПС.
Кроме того, ни в одной другой клетке не происходит такого быстрого увеличения потребности в АТФ, как в мышечной клетке при переходе от состояния покоя к работе. И, наконец, при сокращении скорость образования АТФ должна быть равна скорости ее распада.
Перед началом сокращения в мышце очень мало АТФ. Она быстро израсходуется и мышца будет находиться в состоянии контрактуры, если АТФ не будет образовываться постоянно.
- 32 -
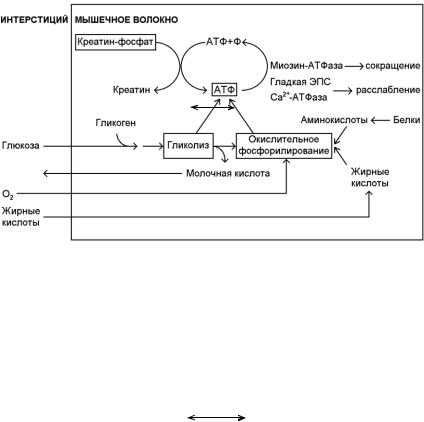
В клетке есть три пути образования АТФ (рис.15):
1)фосфорилирование АДФ при участии креатининфосфата;
2)окислительное фосфорилирование АДФ в митохондриях;
3)фосфорилирование субстрата (гликолиз, окисление аминокислот и жирных кислот).
Рис.15. М етаболические пути образования АТФ, необходимой для мышечного сокращения (Vander et al., 1985).
Наиболее быстрый путь образования энергии – преобразование энергии макроэргической связи креатининфосфата (КФ), запасов которого в клетке в 5 раз больше, чем запасов АТФ, в макроэргические связи АТФ:
креатинкиназа
КФ + AДФ |
К +ATФ. |
Этот путь преобразования энергии возможен только при кратковр е- менной работе, так как запас креатининфосфата ограничен.
При умеренной работе мышца использует энергию окисления жирных кислот и аминокислот. Лимит количества АТФ определяется количеством кислорода, количеством энергоемких молекул, скоростью работы ферментов. Скорость работы ферментов не позволяет быстро восстанавливать АТФ даже при избытке кислорода и органических молекул.
- 33 -
При максимальной работе (от 70 до 100% от возможного) главнейшим фактором восстановления АТФ является гликолиз. Хотя при этом из одной молекулы глюкозы формируется мало молекул АТФ, большое количество АТФ может быть быстро образовано из большого количества молекул глюкозы даже в отсутствие кислорода. Следовательно, мышца должна получать много глюкозы из крови или иметь собственный запас.
При длительной работе запасы креатинина и глюкозы истощаются и требуется их синтез для пополнения запасов. Для этого нужна энергия, поэтому после окончания работы энергозатраты мышц даже выше, чем в период самой работы (например, спортсмен-бегун дышит чаще и глубже после забега, чем во время самого бега).
КПД мышечной работы очень невелик – 20%, остальные 80% энергии преобразуются в тепло.
При длительной работе сила сокращений мышцы постепенно уменьшается. Неспособность мышечного волокна длительное время поддерживать напряжение называется утомлением. Утомление:
1)зависит от интенсивности мышечной нагрузки;
2)чаще всего связано с невозможностью метаболических и сократительных процессов;
3)может быть независимым ни от недостатка АТФ, ни от работы ак- тин-миозиновых филаментов. В таком случае причиной развития утомления является нарушение электро-механического сопряжения, возможно – истощение медиатора.
Физиологическим утомлением называется неспособность головного мозга поддерживать работу мотонейронов, хотя в мышце признаков уто м- ления еще нет. Поражение атлетов на соревнованиях может определяться не только утомлением мышц, но и неспособностью преодолеть волевым усилием физиологическое утомление.
Типы мышечных волокон
Все мышечные волокна можно разделить на быстрые и медленные. Они входят в состав различных мышц тела в разном сочетании. Мышцы, которые сокращаются быстро, состоят главным образом из быстрых волокон. Соответственно мышцы, которые сокращаются медленно, но длительно поддерживают состояние сокращения, включают главным образом медленные мышечные волокна.
- 34 -
Быстрые (фазные) мышечные волокна:
1)более крупные по размеру мышечные волокна;
2)обеспечивают большую силу сокращения;
3)имеют хорошо развитую систему гладкой ЭПС для быстрого выведения большого количества Са++ в начале сокращения;
4)содержат большое количество гликолитических ферментов для быстрого высвобождения большого количества энергии;
5)в них мало кровеносных сосудов и кровоснабжение менее интенсивное, чем в медленных мышцах, так как кислород не имеет большого значения для энергообмена;
6)имеют мало митохондрий, так как окислительный метаболизм вторичен по значению;
7)обладают электровозбудимой мембраной и возбуждение, возникшее в области нервно-мышечного синапса, распространяется далее по мембране в виде потенциала действия;
8)одиночный ПКП максимален по амплитуде (равен потенциалу реверсии) и вызывает сокращение мышечного волокна.
Медленные (тонические)мышечные волокна:
1)меньшие по размеру, чем быстрые;
2)имеют хорошо развитую сеть капилляров и кровоснабжение в них лучше, чем в быстрых волокнах;
3)имеют большое количество митохондрий и высокий уровень окислительных реакций;
4)волокна содержат большое количество миоглобина, железосодержащего белка, который близок по свойствам к белку крови гем оглобину. Миоглобин связывает кислород и отдает его митохондриям при нео бходимости. Он придает мышце более темный, по сравнению с быстрыми воло к- нами, цвет и поэтому такие волокна называются красными (а быстрые, соответственно – белыми) волокнами;
5)волокно не обладает электровозбудимой мембраной и ВПСП передается электротонически;
6)возбуждение волокна обеспечивается множественной иннерваци-
ей;
7)сокращение невозможно при одиночном ВПСП, оно возникает только при суммации многих ВПСП и длительной деполяризации мембра- ны.
Понятно, что мышцы с преимущественным содержанием быстрых во - локон, приспособлены для быстрых и сильных движений, типа прыжков.
-35 -
Мышцы с преобладанием медленных волокон адаптированы для продо лжительных мышечных сокращений, которые поддерживают позу.
Преобразования мышечных волокон. Состояние мышц может посто-
янно меняться (диаметр, длина, растяжимость, капиллярная сеть, кровоснабжение и даже тип мышечного волокна). Иногда такие изменения происходят очень быстро – за несколько недель. Но даже в покое все мышечные белки регулярно обновляются каждые две недели (сами скелетные мышечные волокна, как и нервные клетки или клетки роговицы глаза, не делятся и могут существовать долгие годы).
Увеличение количества актиновых и миозиновых филаментов увеличивает диаметр мышечного волокна и называется гипертрофией мышцы. Гипертрофия развивается в ответ на длительное растяжение мышечных волокон и максимально возможное их увеличение происходит даже при недолгом ежедневном растяжении за 6-10 недель.
Если мышца долгое время остается растянутой сверх ее максимально возможной длины, то на конце мышечных волокон появляются новые саркомеры со скоростью образования несколько саркомеров в минуту.
При очень большой нагрузке развивается мышечная гиперплазия – в добавление к гипертрофии увеличивается, хотя и ненамного, общее количество мышечных волокон путем деления интерстициальных клеток, расположенных под сарколеммой и не теряющих способность к размножению и образованию новых мышечных волокон (предполагается иногда, что образование новых волокон происходит путем продольного расщепления уже имеющихся, но этот механизм маловероятен).
Если мышца долгое время не работает, то скорость распада мышечных белков преобладает над скоростью их восстановления и возникает мышечная атрофия. Атрофия начинает практически мгновенно развиваться при денервации мышцы. Через два месяца дегенеративные изменения проявляются в самих мышечных волокнах. Если восстановить иннервацию, то для восстановление строения и свойств мышцы потребуются уже три месяца. Регенерационные способности мышцы при восстановлении иннервации позже чем через 2 месяца после повреждения уменьшаются и через 1-2 года исчезают полностью. Итогом полной атрофии является замена мышечной ткани жировой и фиброзной тканью. Сохраненные мышечные волокна теряют способность к сокращению и к восстановлению миофиламентов. Фиброзная ткань, которая замещает мышечные волокна, имеет тенденцию к укорочению в течение нескольких месяцев и вызывает состояние контрактуры. Таким обра-
- 36 -
зом, в терапии имеют большое значение меры защиты неподвижных больных от дегенерации и контрактуры мышц, например – ежедневным и непрерывным растяжением.
Восстановление, например при полиомиелите, дегенерированных нервных волокон, подходящих к мышцам, происходит за счет ветвления сохраненных аксонов. Следовательно, возникают очень крупные нейро - моторные единицы (мотонейрон и все иннервированные им мышечные волокна), в пять раз больше обычных. Тонкость работы мышц понижается, но восстанавливается сила их сокращений.
Электромиограмма скелетных мышц
Электромиография скелетных мышц – это метод графической регистрации суммарной электрической активности. Получаемая при этом кр ивая называется электромиограммой (ЭМГ).
Система регистрации ЭМГ состоит из электродов, отводящих потенциалы, и регистрирующего устройства (осциллографа, самописца, компьютера).
При возбуждении каждое мышечное волокно становится элементарным источником электрического тока, подобным электрической батар ейке. Возбужденный (деполяризованный) участок мембраны образует отр ицательный полюс этого источника, а невозбужденный участок – положительный полюс. Электрические поля, создаваемые отдельными волокнами в окружающей среде, суммируются, формируя единое электрическое поле возбужденной мышцы, изменения которого и регистрируются на ЭМГ. ЭМГ не позволяет судить о силе мышечного сокращения, так как отражает только электрическую, но не механическую активность мышцы.
В зависимости от площади поверхности используемых электродов различают локальную и глобальную ЭМГ. Локальная ЭМГ регистрируется игольчатыми электродами, которые вводят в исследуемую мышцу. Этот способ регистрации позволяет измерять активность отдельных нервно - моторных единиц. В локальной ЭМГ выделяют три типа по следующим признакам:
потенциалы отдельных моторных единиц с правильным редким ритмом;
смешанный тип с частыми и редкими колебаниями;
интерференционный (суммарный) тип с асинхронным частыми разрядами многих единиц.
-37 -
Глобальная ЭМГ регистрируется с помощью поверхностных электродов, которые помещают на кожу над исследуемой мышцей. Площадь таких электродов велика, поэтому глобальная ЭМГ является результатом сложения потенциалов очень большого числа мышечных волокон. Ее амплитуда определяется количеством одновременно активирующихся мышечных волокон.
Выделяют три типа глобальных (суммарных, интерференционных) ЭМГ:
1)различные по амплитуде и форме частые (50-100 имп/с) и быстрые (менее 10-15 мс) пики;
2)стабильные ритмы редких (6-40 имп/с) и медленных (до 20-40 мс)
колебаний. Они отражают большую синхронность разряда импульсов в мышце;
3) ритмические появления групп больших низкоамплитудных очень медленных (до 100 мс) колебаний с частотой 4-6 имп/с.
Множественность ритмов ЭМГ объясняется различием свойств м ы- шечных структур, наложением их ритмов друг на друга, возрастанием ч астоты импульсации при усилении силы сокращений, уменьшением частоты импульсации при утомлении.
Электрические показатели работы скелетной мышцы широко используются в распознавании природы различных видов двигательных расстройств: миопатии, полиомиелите, поражениях чувствительных и двигательных нервов и спинного мозга, экстрапирамидных и пирамидных расстройствах. При миопатиях, когда погибают отдельные мышечные волокна и их количество в двигательной единице уменьшается, на локальной ЭМГ р е- гистрируется снижение длительности и амплитуды потенциалов двигательных единиц. При повреждении мотонейрона в мышце происходит компенсаторное укрупнение оставшихся двигательных единиц – увеличение количества входящих в них мышечных волокон. Это приводит к появлению на ЭМГ "гигантских" потенциалов двигательных единиц, имеющих значительно большие, чем в норме, амплитуду и длительность. При денервации мышц вследствие гибели мотонейронов у мышечных волокон может проявиться спонтанная электрическая активность (автоматия), которая проявляется в покое на локальной ЭМГ характерными высокоамплитудными потенциалами (потенциалы фибрилляции).
Для исследования функционального состояния периферических нервов и мионевральных синапсов в клинике широко применяют стимуляционную электромиографию – регистрацию ЭМГ, возникающей в ответ на
- 38 -

электрическое возбуждение периферического нерва. По времени от начала |
ных волн) (рис.17 А,Б) и потенциалы с плато (рис.17 В). В мембране пре- |
действия раздражителя до появления ЭМГ-ответа можно судить о скорости |
обладают потенциалзависимые Са++-каналы и очень мало потенциалзави- |
проведения возбуждения в периферических нервах и синапсах. Путем пр о- |
симых Nа+-каналов. ПД в таких клетках определяется прежде всего входящим |
должительной ритмической стимуляции нерва исследуют скорость развития |
током Са++. Для развития распространяющегося по мышечной мембране |
утомления в синапсе, которое проявляется уменьшением амплитуды ЭМГ- |
ПД необходима одновременная деполяризция минимум 30-40 мышечных |
ответа. При миастении утомление развивается быстрее, чем в норме. |
клеток. Кроме того, входящий Са++ может сразу участвовать в процессе со- |
ЭМГ является единственным индикатором таких форм возбуждения |
кращения, не вызывая ПД. Са++-каналы открываются медленно, но остаются |
мышц, которые не проявляются видимыми движениями, например – идео- |
открытыми в течение длительного времени, поэтому ПД в гладких мышцах |
моторные акты, сопровождающие мысли о движении. Токи действия при |
медленные и длительные. |
этом усиливаются в тех мышечных группах, которые должны были бы со- |
|
вершать движения. Этот эффект использован для решения важной практи- |
|
ческой задачи создания активных протезов, управляемых биотоками. |
|
ГЛАДКИЕ МЫШЦЫ
Гладкие мышцы можно разделить на два типа.
А. Разделенные на отдельные единицы (multi-unit muscle). Это не-
часто встречающийся тип гладкомышечной ткани, у человека она образует глазодвигательные мышцы и мышцы радужной оболочки глаза. Мышцы этого типа имеют клеточную структуру. Каждая клетка снабжена собственным нервным окончанием и может сокращаться независимо от др угих клеток. Контроль сокращения осуществляется главным образом нервным волокном. В мультиунитарных гладкомышечных клетках редко (или никогда) возникают спонтанное возбуждение и сокращение.
Б. Единая гладкомышечная система (unitary smooth muscle) также представлена отдельными мышечными клетками (рис.16), но они образуют функциональное единство, или функциональный синцитий. Клетки объединены в листки или пучки и мембраны образуют щелевые контакты (gap junction, см. Электрические синапсы). Электрический ток при деполяризации мембраны одной из клеток деполяризует мембрану соседней клетки. Ионы тоже легко перемещаются из клетки в клетку. Таким типом мышечной ткани образованы большинство внутренних (висцеральных) органов тела, поэтому у такой ткани есть еще одно название – висцеральная гладкая мышечная ткань.
Мембранный потенциал и ПД в гладкой мышце. Величина мембран-
ного потенциала в висцеральных гладкомышечных волокнах меньше, чем в скелетных, примерно 50-60 мВ. Потенциалы действия могут быть двух типов
–спайки (спайки могут быть множественными на фоне медлен-
-39 -
Рис.16. М икроскопическое строение гладких мышц (Guyton, Hall, 1996).
- 40 -
