
- •Биохимия азотистый обмен в норме и при патологии
- •Глава 1. Классификация и общность ролей азотсодержащих соединений
- •Глава 2. Метаболизм аминокислот
- •2.1. Гидролитическая стадия катаболизма полипептидов
- •Судьба аминокислот в клетке
- •Реакции декарбоксилирования
- •Особенности катаболизма циклических аминокислот
- •Судьба продуктов распада аминокислот
- •Анаболизм аминокислот
- •Глава 3. Метаболизм нуклеотидов
- •Классификация и номенклатура нуклеотидов
- •Особенности строения, биологическая роль нуклеиновых соединений Функции мононуклеотидов
- •Значение динуклеотидов
- •Полинуклеотиды
- •Виды рнк
- •Варианты днк
- •Специфические пути преобразования нуклеотидов
- •Синтез пуриновых нуклеотидов
- •Тесты к главе 3
- •Глава 4. Синтез азотсодержащих биополимеров
- •4.4. Синтез полипептидов
- •Положения генетического кода
- •4.5. Регуляция синтеза азотсодержащих биополимеров
- •4.6. Причины нарушений генеза азотсодержащих биополимеров
- •4.7. Принципы профилактики и терапии наследственных болезней
Судьба аминокислот в клетке
Пул аминокислот в цитоплазме клеток складывается в основном из преодолевших плазмолемму подобных соединений, получившихся при гидролизе экзогенных (пищевых) или эндогенных (тканевых); малая доля может образоваться из других соединений, чаще, из альфа-кетокислот. Клетка использует аминокислоты, в первую очередь, в качестве мономеров в реакциях полимеризации. Из этих азотсодержащих соединений синтезируются дипептиды (карнозин, ансерин — антиоксиданты мышечной ткани), трипептид (глутатион — один из универсальных антиоксидантов). Любой полипептид вследствие уникальности своей первичной структуры в процессе синтеза требует присутствия дополнительного участника — матрицы (иРНК). Олигопептиды, имеющие своеобразную аминокислотную последовательность, получаются путем частичного протеолиза более крупных биополимеров (схема).
Небольшая доля аминокислот может находить применение в специфических путях использования: в синтезе азотистых оснований (этаноламина, холина), пуриновых и пиримидиновых нуклеотидов; из триптофана, вступившего в кинурениновый путь распада, в конечном итоге образуются НАД+ и НАД+Ф; фенилаланин и тирозин в щитовидной железе преобразуются в тироидные гормоны, в меланоцитах из этих аминокислот

получаются защитные пигменты — меланины, а ферменты хромафинных клеток превращают их в катехоламины (дофамин, норадреналин, адреналин); глицин — обязательный участник в синтезе гема, пуриновых оснований, парных жёлчных кислот, креатина и т.д.
Обычно, как замечено выше азотсодержащие соединения не служат в клетках энергоисточниками. Однако при следующих условиях аминокислоты могут использоваться с энергетической целью: а) при переедании белков; б) во время дефицита липидов и углеводов в пище (при частичном или полном голодании); в) при заболеваниях, сопровождающихся нарушениями в использовании с этими целями основных энергоисточников (при сахарном диабете).
Варианты неспецифических преобразований аминокислот
Каждая аминокислота, естественно подвергается специфическому распаду. Но вследствие общности строения для этих соединений характерны неспецифические фазы катаболизма, начало которых имеет альтернативу: каждая аминокислота включает обязательно две функциональные группы, отсюда разрушение может начаться или с декарбоксилирования, или лишения аминогруппы. Небольшой процент циклических аминокислот преобразуется идентично ПВК.
Реакции декарбоксилирования
Схему этой реакции можно представить в следующем виде:
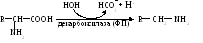
Продукты подобного преобразования — амины (см. Приложение, табл. 2), довольно разнообразны по функциям (табл. 2.1). Большая часть из них обладает высокой биологической активностью, являясь гормонами, нейромедиаторами. Присутствие в исходном субстрате дополнительной функциональной группы (-ОН, -СООН) придает соединению иные свойства. После декарбоксилирования гидроксиаминокислоты серина образуется этаноламин — компонент различных фосфолипидов; аспартат в этом случае дает β-аланин, который включается, например, в НSКоА, карнозин, ансерин.
Биологически активные амины действуют кратковременно и быстро разрушаются специфическими аминооксидазами (МАО, ДАО и т.д.):

Отщепившийся от аминокислоты углекислый газ способен взаимодействовать с водой цитоплазмы с образованием угольной кислоты, которая под влиянием внутриклеточных буферных систем может превратиться в свои соли, также создав подобную бикарбонатную систему.
Таблица 2.1
Происхождение аминов и их функции
|
Аминокислота |
Ее амин |
Роль |
|
Глутаминовая кислота |
Гамма-аминомасляная кислота (ГАМК) |
Медиатор |
|
Аспарагиновая кислота |
бета-аланин |
Компонент карнозина, ансерина — антиоксидантов или НSКоА |
|
Фенилаланин |
Фенилэтиламин |
Нейромедиатор |
|
Тирозин |
Тирамин |
Нейромедиатор |
|
Диоксифенилаланин (ДОФА) |
Дофамин |
Нейромедиатор, гормон |
|
Триптофан |
Триптамин |
Нейромедиатор, гормон |
|
5-окситриптофан |
5-окситриптамин (серотонин) |
Гормон, медиатор |
|
Гистидин |
Гистамин |
Медиатор боли, воспаления |
|
Серин |
Этаноламин |
Компонент глицерофосфатидов - этаноламинфосфатидов |
|
Цистеин |
Цистеамин |
Радиопротектор |
Возможен иной исход декарбоксилирования: углекислый газ связывается с биотином (коферментом декарбоксилазы), образуется карбоксибиотин. В таком виде это соединение служит источником карбоксильной группы, т. е. используется в процессах карбоксилирования (например, в получении из ПВК оксалоацетата; синтез ацилов ВЖК начинается с карбоксилирования ацетил-КоА в малонил-КоА и т.д.).
Варианты лишения аминокислоты аминогруппы
Описано несколько механизмов реакций дезаминирования азотсодержащих соединений (гидролитическое, окислительное, восстановительное, внутримолекулярное и т. д.) (см. Приложение, табл.3). Часть из них не характерна для аминокислот (гидролитическому подвергаются пуриновые и пиримидиновые основания), восстановительное и вышеописанный вариант дезаминирования регистрируются в полости кишечника, где протекают под действием ферментов гнилостной микрофлоры. В окислительном дезаминировании участвует НАД+, отсюда понятно, что редокс–потенциал окисляемого субстрата должен быть более электроотрицательным, т. е. подобной реакции подвергаются, в первую очередь, кислые аминокислоты (глутаминовая и аспарагиновая кислоты).
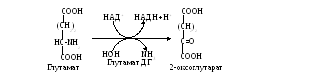
О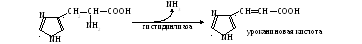 ригинально
лишается аминогруппы гистидин:
ригинально
лишается аминогруппы гистидин:
Подобный способ дезаминирования называется внутримолекулярным. Большинство же аминокислот теряет аминогруппу при взаимодействии с α-кетокислотой. Происходит взаимный обмен функциональными группами: из аминокислоты получается α-кетокислота, а исходная α-кетокислота становится аминокислотой (см. Приложение, табл. 4). Ферменты, катализирующие реакцию, принадлежат к аминотрансферазам, а процесс называется переаминированием, или трансаминированием. В общем виде он выглядит так:

О собая
роль в данной реакции принадлежит
коферменту - активной форме витамина
В6
(фосфопиридоксаль фосфопиридоксамин)
(см. Приложение, табл. 4). Из всех аминофераз
наибольшей
активностью обладают АлАТ и АсАТ,
колебания в скорости катализируемых
ими реакций используются в целях
диагностики, в основном, болезней
миокарда и печени. Если патологический
процесс повреждает мембрану гепатоцитов,
и их содержимое попадает в общий кровоток,
то в первую очередь, регистрируется
рост активности АлАТ. Когда происходят
сходные альтерации в клетках сердечной
мышцы, в крови повышается активность
АсАТ.
собая
роль в данной реакции принадлежит
коферменту - активной форме витамина
В6
(фосфопиридоксаль фосфопиридоксамин)
(см. Приложение, табл. 4). Из всех аминофераз
наибольшей
активностью обладают АлАТ и АсАТ,
колебания в скорости катализируемых
ими реакций используются в целях
диагностики, в основном, болезней
миокарда и печени. Если патологический
процесс повреждает мембрану гепатоцитов,
и их содержимое попадает в общий кровоток,
то в первую очередь, регистрируется
рост активности АлАТ. Когда происходят
сходные альтерации в клетках сердечной
мышцы, в крови повышается активность
АсАТ.
В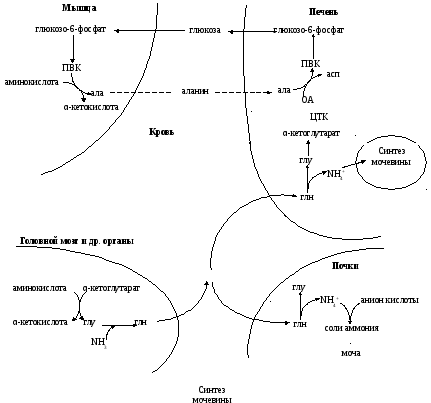 заимоотношения
между переаминированием и дезаминированием
хорошо иллюстрируются глюкозо-аланиновым
циклом (Схема 2),с помощью которого из
мышц переносятся Н2N-группы
в печень, где преобразуются в мочевину,
а миоциты обеспечиваются глюкозой,
получившейся в гепатоцитах путем ГНГ
из аланина.
заимоотношения
между переаминированием и дезаминированием
хорошо иллюстрируются глюкозо-аланиновым
циклом (Схема 2),с помощью которого из
мышц переносятся Н2N-группы
в печень, где преобразуются в мочевину,
а миоциты обеспечиваются глюкозой,
получившейся в гепатоцитах путем ГНГ
из аланина.
