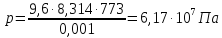- •22. Кг металла вытесняют из кислоты 1,4 л водорода, измеренного при н.У. Эта же масса металла вытесняеткг свинца из растворов его солей. Вычислите эквивалентную массу свинца.
- •97. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях ,,hcooh, .
- •122. Рассчитайте ∆h , если известно, что:
- •147. Определите расчетом, какие из реакций, уравнения которых:
- •197. Водный раствор содержит 577 г в 1 л. Плотность раствора 1,335 г/. Вычислите массовую долюв растворе, а также эквивалентную концентрацию раствора.
- •222. Сколько граммов глюкозы содержится в 200 мл раствора, осмотическое давление которого при 37℃ составляет 8 атм.?
- •247. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями:
- •272. Почему растворы иNaCn имеют щелочную реакцию, а растворы и– кислую? Ответ подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
97. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях ,,hcooh, .
Ответ.
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что оно состоит только из ионов. Степень окисления может принимать отрицательное, положительное и нулевое значение. Сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе – заряду иона.
Запишем структурные формулы указанных в условии соединений:
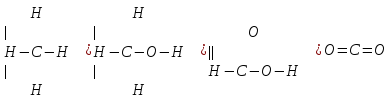
Как видно, во всех указанных соединениях валентность углерода равна 4, так как углерод связан 4 ковалентными связями с другими элементами.
Степень окисления атома углерода в соединениях разная:

В
метане
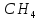 степень окисления углерода равна
степень окисления углерода равна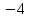 ;
в метаноле
;
в метаноле степень окисления углерода равна
степень окисления углерода равна ;
в муравьиной кислотеHCOOH
степень окисления углерода
;
в муравьиной кислотеHCOOH
степень окисления углерода
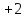 ;
в диоксиде углерода
;
в диоксиде углерода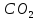 степень окисления углерода
степень окисления углерода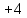 .
.
122. Рассчитайте ∆h , если известно, что:
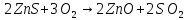 ,
, 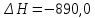 кДж;
кДж;
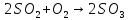 ,
, 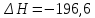 кДж;
кДж;
 ,
,  кДж.
кДж.
Ответ.
Стандартной теплотой образования называется тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию рассматриваемого элемента при температуре 298 К и стандартном давлении.
Так,
теплота образования 1 моль
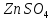 равна тепловому эффекту реакции
образования сульфата цинка в данной
его кристаллической модификации из
металлического цинка, кристаллической
серы и газообразного кислорода:
равна тепловому эффекту реакции
образования сульфата цинка в данной
его кристаллической модификации из
металлического цинка, кристаллической
серы и газообразного кислорода:
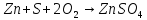
Термохимические расчеты проводят на основании закона Гесса: тепловой эффект реакции не зависит от пути, по которому протекает процесс, а определяется только природой исходных веществ и продуктов реакции и их физическим состоянием. Согласно закону Гесса, при расчетах с термохимическими уравнениями можно производить любые алгебраические действия, то есть переносить члены уравнений из одной части уравнения в другую, складывать, вычитать и т.д.
Имеем:
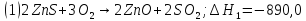 кДж
кДж
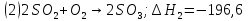 кДж
кДж
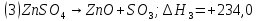 кДж
кДж
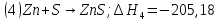 кДж
кДж
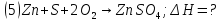
Нетрудно заметить, что для получения уравнения (5) необходимо к уравнению (1) прибавить уравнение (2), вычесть умноженное на 2 уравнение (3) и прибавить умноженное на 2 уравнение (4), а полученный результат разделить на 2. Такие же действия проведем и с энтальпиями этих реакций, то есть теплота образования сульфата цинка будет равна:
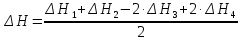
Подставляя значения, получим:
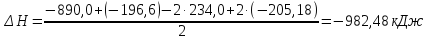
147. Определите расчетом, какие из реакций, уравнения которых:
а)
 ;
;
б)
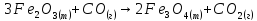 ;
;
г)
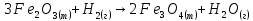 ;
;
будут протекать самопроизвольно в изолированной системе при стандартных условиях. Сделайте вывод о возможности протекания реакции.
Ответ.
В
изолированной системе самопроизвольно
протекают процессы, идущие с ростом
энтропии (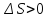 ).
Определяем изменении энтропии реакций
согласно закона Гесса:
).
Определяем изменении энтропии реакций
согласно закона Гесса:

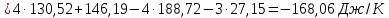
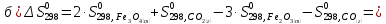

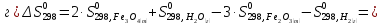
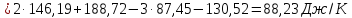
Как
видно из расчетов, самопроизвольно в
изолированной системе при стандартных
условиях могут протекать реакции (б) и
(г), для которых
 .
.
Зная,
что
 есть функция состояния и что
есть функция состояния и что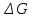 для простых веществ, находящихся в
устойчивых при стандартных условиях
агрегатных состояниях, равны нулю,
находим
для простых веществ, находящихся в
устойчивых при стандартных условиях
агрегатных состояниях, равны нулю,
находим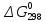 реакций (б) и (г):
реакций (б) и (г):

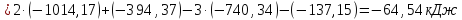
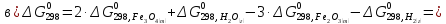
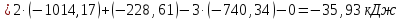
Полученные
значения
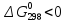 указывают на возможность протекания
реакций.
указывают на возможность протекания
реакций.
172.
Исходные концентрации азота и водорода
в реакции
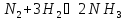 были (моль/л):
были (моль/л): ,
,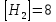 .
К моменту наступления равновесия
прореагировало 10% исходного количества
азота. Вычислить давление газовой смеси
в этот момент, если температура ее была
500°С.
.
К моменту наступления равновесия
прореагировало 10% исходного количества
азота. Вычислить давление газовой смеси
в этот момент, если температура ее была
500°С.
Ответ.
Согласно
условию, к моменту наступления равновесия
прореагировало 10% исходного количества
азота, то есть
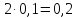 моль. В соответствии с уравнением
реакции, 1 моль взаимодействует с 3 моль
моль. В соответствии с уравнением
реакции, 1 моль взаимодействует с 3 моль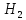 и при этом образуется 2 моль
и при этом образуется 2 моль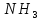 .
Следовательно, 0,2 моль
.
Следовательно, 0,2 моль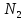 прореагирует с
прореагирует с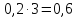 моль
моль с образованием
с образованием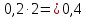 моль
моль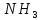 .
.
Таким образом, количества молей каждого газа и общее количество молей газов в 1 л смеси в момент равновесия равно:

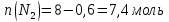
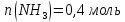
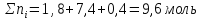
Для
вычисления давление газовой смеси в
этот момент воспользуемся уравнением
Менделеева-Клапейрона
(уравнение состояния идеального газа),
которое устанавливает соотношение
между количеством вещества газа (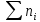 ,
моль), температурой (T,
К), давлением (
,
моль), температурой (T,
К), давлением ( ,
Па) и объемом (V,
,
Па) и объемом (V,
 ):
):

где R – универсальная газовая постоянная, равная 8,314 Дж/(моль∙К).
Отсюда давление газовой смеси определим по уравнению:
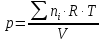
Подставляя
значения и учитывая, что
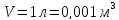 ,
а
,
а ,
получим:
,
получим: