
- •7.Применения интерференции:
- •8. Дифракция – явление отклонения света от прямолинейного направления распространения при прохождении вблизи препятствий.
- •9.Дифракция Фраунгофера на щели:
- •26. Гіпотеза де Бройля та її експериментальне підтвердження. Хвиля де Бройля.
- •27. Співвідношення невизначеностей Гейзенберга
- •28. Хвильова функція та її властивості. Фізичний зміст.
- •29.Рівняння Шредингера для стаціонарного стану
- •30. Частица в одномерной потенциальной яме.
- •31. Прохождение частицы сквозь потенциальный барьер. Туннельный эффект.
- •1) Коэффициент прозрачности
- •2) Коэффициент отражения
- •33. Опыты Штерна и Герлаха. Спин. Спино-орбитальное взаимодействие.
- •35. Спонтанные и вынужденные переходы
- •37.Газові лазери. Властивості лазерного випромінювання.
- •42. Собственная проводимость полупроводников.
- •43. Примесная проводимость полупроводников.
- •44. Фотопроводимость полупроводников. Внутренний фотоэффект.
- •46. Принцип роботи напівпровідникового транзистора.
- •47. Контактна різниця потенціалів.
- •48. Явища Заєбека, Пельтьє, Томсона.
- •19. Явище зовнішнього фотоефекту. Рівняння Енштейна.
1) Коэффициент прозрачности
2) Коэффициент отражения
Коэффициенты связаны между собой соотношением R + D = 1.
32.
Механический и магнитный моменты
электрона в атоме.
![]() l
– орбитальное квантовое число,
l
= 0, 1, 2, … n-1.
Таким образом, момент импульса электрона
принимает дискретные
значения.
Заметим, что при (l
>>1)
l
– орбитальное квантовое число,
l
= 0, 1, 2, … n-1.
Таким образом, момент импульса электрона
принимает дискретные
значения.
Заметим, что при (l
>>1)
![]() .
.
Проекция
момента импульса электрона на какое-либо
заданное направление в пространстве
z
также квантуется
по правилу:![]() m
=
0, ± 1, ± 2, …± l
–магнитное
квантовое число.
m
=
0, ± 1, ± 2, …± l
–магнитное
квантовое число.
Магнитный момент pm . Очевидно, что он пропорционален механическому моменту импульса L. Отношение магнитного момента pmэлектрона к механическому моменту импульса L называется гиромагнитным
отношением.
Для электрона в атоме водорода ("-" показывает, что вектора
противоположны). Отсюдаорбитальный
магнитный момент
электрона:
("-" показывает, что вектора
противоположны). Отсюдаорбитальный
магнитный момент
электрона: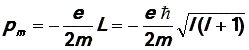
Единица
магнитного момента - это магнетон Бора
(const) mв =
![]()
33. Опыты Штерна и Герлаха. Спин. Спино-орбитальное взаимодействие.
Опыт: пучок атомов Ag пропускали через сильно неоднородное магнитное поле (постоянный магнит). При прохождении атомов через поле на них действовала сила, отклонявшая летящие между магнитами атомы от их первоначального направления движения. Причём, если предположить, что магнитные моменты атомов ориентированы хаотично (непрерывно), то тогда на расположенной далее по направлению движения атомов пластинке должна была проявиться размытая полоса. Однако вместо этого на пластинке образовались две достаточно чёткие узкие полосы, что свидетельствовало в пользу того, что магнитные моменты атомов вдоль выделенного направления принимали лишь два определённых значения, что подтверждало предположение квантово-механической теории о квантовании магнитного момента атомов.

Спин - собственный момент импульса электрона.
Результирующий
полный момент импульса,
![]() в котором
в котором![]()
Так
как спин электрона
![]() ,
то получаем полуцелые значения
,
то получаем полуцелые значения![]()
Спин-орбитальное взаимодействие – взаимодействие магнитного момента электрона с его орбитальным движением, т.е. внешним магнитным полем.
Если
![]() ,
то квантовое число
,
то квантовое число![]() имеет только одно значение, равное
имеет только одно значение, равное![]() .
При
.
При![]() ,
отличном от нуля, возможны два значения
,
отличном от нуля, возможны два значения и
и ,
которые соответствуют двум различным
ориентациям спинового момента
относительно орбитального.
,
которые соответствуют двум различным
ориентациям спинового момента
относительно орбитального.
34.Квантові числа. Принцип Паулі. Періодична система елементів Менделєєва. Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра; оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l =1 - р-орбиталями l = 2 - d-орбиталями l = 3 - f-орбиталями .
Магнитное квантовое число m определяет направление орбитали в пространстве. Его значения изменяются от +l до - l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: px, py, pz.
Принцип Паули В одном и том же атоме или двойной квантовой системе не может быть 2-х элементов имеющих одинаковую совокупность квантовых чисел.

Периоди́ческая систе́ма хими́ческих элеме́нтов(табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра. Система является графическим выражением периодическогозакона, открытого русским учёным-химиком Д. И.Менделеевым в 1869 году.
