
Коллоидные системы
.pdfПонятие агрегатного состояния не применимо к ВМС, для этих целей применяется понятие фазового (в структурном смысле) состояния. По сути, понятие фазового состояния характеризует порядок взаимного расположения молекул. Твердые ВМС могут находиться в кристаллическом, аморфном состояниях. В кристаллическом состоянии все молекулы ВМС находятся в одинаковой конформации, образуют однообразные надмолекулярные структуры - стержни, пластинки и т.д. В случае аморфного состояния различают три варианта: стеклообразное, высокоэластичное и вязкотекучее. Переход из одного состояния в другое всегда протекает не резко, а в некотором интервале температур.
При помещении ВМС в растворитель происходит поглощение растворителя и соответствующее увеличение объема и массы полимера, идет процесс набухания. Степень набухания α рассчитывается по уравнению:
α = (V – V0)/V0 или α = (m – m0)/m0 ,
где V и V0 – объем образца до и после набухания, m и m0 – масса образца ВМС до и после набухания.
Если увеличению объема ВМС при его набухании препятствует что-либо (например, проницаемая для растворителя оболочка), то со стороны ВМС обнаруживается давление набухания.
Процесс набухания ВМС связан с взаимодействием макромолекул с молекулами растворителя, и степень набухания ВМС зависит как от природы ВМС, так и от природы растворителя. Набухание полярного ВМС протекает только в полярном растворителе, а неполярного - только в неполярном.
Набухание ВМС может быть ограниченным (до определенного значения а) или неограниченным (до полного растворения полимера). Так, агар-агар неограниченно набухает в теплой воде, но ограниченно - в холодной. Неограниченно набухают в горячей воде крахмал и желатин. Набухание полимеров обычно происходит очень медленно.
Причина набухания кроется в межмолекулярном взаимодействии ВМС и растворителя, реализуемом путем сольватирования макромолекул полимера молекулами растворителя, что приводит к разрушению связей между отдельными макромолекулами. Разделение клубка макромолекул, в котором они связаны ван-дер-ваальсовыми силами, возможно в процессе набухания ВМС в том случае, если работа разделения молекул оказывается меньше энергии их сольватации. Тогда процесс набухания ВМС приводит к самопроизвольному растворению полимера ( G < 0).
Для набухания полимера важную роль играет энтропийный фактор ( S>0).
Рассмотренные положения не распространяются на полимеры, структура которых представляет собой пространственную молекулярную сетку. Для их растворения требуется затратить значительно большую энергию, чем энергия сольватации, т. к. в этом случае для полного растворения необходимо разорвать в сетке химические связи.
Набухание ВМС сопровождается выделением теплоты набухания. Происходит также и уменьшение общего объема системы, т. к. молекулы растворителя упорядоченно располагаются вокруг сольватируемых макромолекул.
Добавление электролита к раствору ВМС уменьшает сольватирующую способность растворителя и система в итоге может быть нарушена, т. е. может произойти выделение ВМС из раствора и полимер как бы отделится от растворителя (появляются волокна, хлопья, творожистые осадки). Этот процесс называется высаливанием.
Механизм высаливания состоит в том, что сольватирующие ВМС молекулы растворителя начинают взаимодействовать с электролитом, сольватная оболочка около макромолекулы разрушается, происходит десольватация макромолекулы и, как следствие, резко снижается растворимость ВМС, т.е. происходит его «высаливание». Способность ВМС «высаливаться» из растворителя возрастает с увеличением молярной массы полимера. На этом основано фракционирование полидисперсного ВМС по молярной массе, которое используется для разделения смеси белков различной молярной массы.

Процесс «высаливания» может привести к появлению в системе другой жидкой студнеобразной фазы в виде мельчайших капель, концентрация ВМС в них выше, чем в исходном растворе. Это явление называется коацервацией. И оно характерно для растворов белков. Коацервация может происходить в растворе ВМС и при других воздействиях на систему, например, при увеличении концентрации раствора, изменении температуры, pH и др. В этом случае происходит объединение отдельных макромолекул в ассоциаты за счет проявления межмолекулярных сил. Получившаяся структура является динамической, и ассоциаты в ней постоянно образуются и распадаются. Когда ассоциаты становятся крупными и прочными, в системе наблюдается расслаивание, характеризующееся появлением капельной фазы (коацервация).
Растворы ВМС проявляют осмотическое давление, обладают диффузионной способностью. Многие ВМС содержат ионогенные (т. е. способные образовывать ионы) группы и поэтому
представляют собой полиэлектролиты (полимерные электролиты), склонные к ионизации в растворе. Так, растворимый крахмал содержит в макромолекуле кислотные - COOH-группы, агарагар –SO2-группы, которые в растворе могут диссоциировать с отщеплением иона водорода. Некоторые ВМС имеют в своем составе основные -NH2 или, при присоединении молекулы воды, - NH3OH-группы. Таким образом, длинная молекула высокомолекулярного электролита, продиссоциировавшая в воде, представляет собой один полиион с жестко закрепленными, фиксированными -COO-, -NH3+ или другими ионами, а около этой полимерной цепочки располагаются подвижные противоионы, заряды которых эквивалентны заряду полииона. Обычно на одно элементарное звено макромолекулы ионогенного полимера приходится одна ионогенная группа. Две ионогенные группы (-COOH и -NH3OH) в своем составе имеют белки. Молекулу белка можно схематично изобразить в виде
HOH3N - R - COOH,
где R - длинная углеводородная цепь. Ионогенные группы кислотной и основной природы могут располагаться не только по краям, но и внутри молекулы белка. Полипептидная цепь белков состоит из многих десятков и сотен аминокислот в различных сочетаниях. Амино- и карбоксильные группы полипептидных цепей могут взаимодействовать между собой, образуя водородные связи.
В зависимости от pH раствора кислотная и основная группы проявляют различную склонность к диссоциации. В кислых растворах больше диссоциирована основная группа, в щелочной среде - кислотная. Когда в молекуле белка диссоциированы в основном кислотные группы, макромолекула имеет отрицательный заряд и при электрофорезе будет передвигаться в сторону положительного электрода. Диссоциация основных и кислотных групп происходит в одинаковой степени в белке только при определенном значении pH раствора и это значение pH<7
называется изоэлектрической точкой (ИЭТ).
|
[ NH3+ - R – COO- ] 0 |
pH > 7 [ OH- ] |
7 > pH [ H+ ] |
[ NH2 - R – COO- ]- |
[ NH3+ - R – COOH]+ |
Таким образом, изоэлектрическая точка – это значение рН, при котором молекула белка электронейтральна. При достижении изоэлектрической точки, когда кулоновское взаимодействие групп разного заряда происходит уже по всей длине цепи, молекула белка сворачивается в клубок.
Значение ИЭТ для конкретного белка определяется соотношением основных и кислотных групп в макромолекуле. Для белков различного вида эта величина не одинакова и для большинства белков меньше 7: для желатина ИЭТ равна 4,7, для казеина
– 4,6, для глобулина – 5,4. В ИЭТ белок характеризуется минимальной степенью набухания и растворимостью и, кроме того, минимальной вязкостью образующихся растворов. Это связано с изменением эффективного размера макромолекул белка. В ИЭТ разноименно заряженные звенья притягиваются и сжимают молекулу. Напротив, вне ИЭТ

в макромолекуле белка появляется больше одноименных за рядов, которые, отталкиваясь, распрямляют молекулу.
Денатурация - необратимая коагуляция белка, вызываемая, например, его нагреванием, добавлением спирта, действием световой энергии и др. Этот вид коагуляции из лиофильных коллоидов характерен только для белковых веществ. Так, необратимое изменение свойств яичного белка при его термической обработке (60 - 65 °C) происходит в присутствии воды, тогда как сухой яичный белок не денатурируется при 100°C и даже выше.
Процесс термической денатурации белка, который характерен для белков глобулярного типа, обусловлен разрывом слабых водородных связей внутри глобулы и последующим распрямлением и вытягиванием макромолекулы. При этом вследствие изменения структуры белка изменяются и его свойства, в частности, повышается вязкость раствора и понижается растворимость полимера.
Процесс денатурации белков происходит при засолке и варке мяса и рыбы, при хлебопечении, при взбивании яичного белка со сливками и превращении его в пену, при скисании молока.
Цель работы: Определить степень набухания желатина в растворах с различными значениями рН. По минимуму степени набухания найти изоэлектрическую точку.
Оборудование: Штатив для пробирок, градуированные пробирки (8 шт), цилиндр на 10 мл, стеклянные палочки.
Реактивы: Желатин сухой, 0,1 М растворы уксусной кислоты и ацетата натрия.
Порядок работы:
В семь градуированных пробирок насыпают 1 см3 растертого желатина. Наливают в пробирки ацетатные буферные растворы (см. приложение к работе) в соотношениях, указанных в таблице 1. Измеряют значения рН с помощью рН-метра. Вычисляют теоретические значения рН. Через 1- 1,5 часа определяют объѐм желатина и рассчитывают степень набухания по формуле
|
V V0 |
|
|
V 0 |
(4.8) |
||
|
где V0 и V – объем желатина до и после набухания.
Таблица 1.
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
0,1 |
М СН3СООН, мл |
1 |
2 |
4 |
5 |
6 |
8 |
9 |
0,1 |
М СН3СООNa, мл |
9 |
8 |
6 |
5 |
4 |
2 |
1 |
рН вычисленное |
|
|
|
|
|
|
|
|
рН измеренное |
|
|
|
|
|
|
|
|
Объем желатина после |
|
|
|
|
|
|
|
|
набухания, мл |
|
|
|
|
|
|
|
|
Степень набухания, |
|
|
|
|
|
|
|
|
Строят график зависимости степени набухания от рН раствора. По минимуму кривой определяют ИЭТ.
Приложение к работе 6а.
Буферным называют раствор, способный поддерживать определенное значение рН при добавлении некоторого количества сильной кислоты или основания, а также при разбавлении.
Буферным действием обладают смеси слабых кислот и их солей с сильным основанием, слабых оснований и их солей с сильной кислотой. Значение рН буферных растворов рассчитывают по формуле:
рН рКкислоты lg |
Cкислоты |
(4.9) |
|
Ссоли |
|||
|
|
где рКкисл = -lgKкисл – показатель константы диссоциации слабой кислоты, Cкисл и Cсоли – молярные концентрации кислоты и соли в буферном растворе. Понятно, что значение рН
зависит от соотношения концентраций компонентов раствора и не зависит от разбавления. Если концентрации компонентов буферной смеси одинаковы, а рН изменяют соотношением объѐмов, то рН можно вычислить по формуле:
рН рК |
|
lg |
Vкислоты |
(4.10) |
|
кислоты |
Vсоли |
||||
|
|
|
|||
|
|
|
|
При расчетах рН примите, что значение константы диссоциации уксусной кислоты К = 1,85∙10-5 (Т=250С)
Лабораторная работа 6б
Определение молекулярной массы полимера методом вискозиметрии
Краткая теория:
Многие свойства ВМС, в частности способность к набуханию и растворению, прочность и эластичность зависят от молекулярной массы полимера. Высокомолекулярные соединения часто состоят из макромолекул различной молекулярной массы. Поэтому говорят о средней молекулярной массе того или иного полимера. Одним из наиболее распространенных методов определения молекулярной массы ВМС является вискозиметрический метод, основанный на измерении вязкости растворов ВМС различных концентраций.
Вязкость характеризует силы внутреннего трения жидкостей, то есть способность жидкости сопротивляться силе, вызывающей еѐ течение. Она обусловлена взаимодействием молекул жидкости друг с другом и проявляется при течении жидкости.
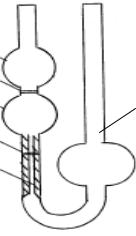
|
Для измерения вязкости разбавленных растворов ВМС |
|
|
используют метод капиллярного истечения жидкости с |
|
|
помощью вискозиметра Оствальда капил-лярные |
|
|
вискозиметры представляют собой U – образные |
|
А |
трубки, в одном из колен которых помещен капилляр. |
|
1 |
Исследуемую жидкость заливают в вискозиметр через |
|
|
широкую трубку 1, затем еѐ засасывают через |
|
В |
капилляр 2 выше метки А. Измеряют время истечения, |
|
|
||
2 |
за которое жидкость опуститься от метки А до метки |
|
В. |
||
|
Рис 11. Вискозиметр
Оствальда
Определение вязкости с помощью капиллярного вискозиметра основано на законе Пуазейля, согласно которому объем жидкости V, проходящий через капилляр, прямо пропорционален времени истечения t, давлению столба жидкости р и радиусу капилляра r. Кроме того, объѐм жидкости обратно пропорционален длине капилляра l и вязкости жидкости η:
V |
4 r 4 pt |
(4.11) |
|
8l |
|||
|
|
Отсюда абсолютная вязкость равна:
|
4 r 4 pt |
(4.12) |
|
8lV |
|||
|
|
При исследовании разбавленных растворов полимеров определяют обычно не абсолютную вязкость, а относительную, то есть отношение вязкости раствора полимера η к вязкости чистого растворителя η0, которое при условии, что плотности раствора и растворителя практически совпадают, равно
|
|
|
|
|
t |
(4.13) |
отн |
|
|
||||
|
0 |
|
t0 |
|
||
|
|
|
|
|||
где t и t0 – время истечения раствора и чистого растворителя.
Величина (ηотн – 1) = ηуд показывает относительный прирост вязкости из-за введения в растворитель полимера и называется удельной вязкостью.
Отношение удельной вязкости к концентрации раствора полимера ηуд/С называют приведѐнной вязкостью ηпр. Приведенная вязкость увеличивается при увеличении концентрации.
Приведенная вязкость бесконечно разбавленного раствора называется характеристической вязкостью [η]:
[η] = lim ηпр, C→0
Характеристическую вязкость можно определить методом графической экстраполяции значений приведенной вязкости при разных концентрациях к концентрации, равной нулю.
Характеристическая вязкость зависит от размеров макромолекул в растворе, природы растворителя и температуры.
Зная [η] можно вычислить среднюю молекулярную массу ВМС по уравнению
Марка – Куна – Хаувинка:
[η] = KMα
где К – константа, характерная для полимеров одного гомологического ряда; α – константа, характеризующая гибкость макромолекул и их взаимодействие с растворителем. Для гибких макромолекул в хороших растворителях в зависимости от плотности клубков α может меняться от 0,6 до 0,8; для жестких макромолекул α = 1,0 – 1,5.
Цель работы: По результатам измерения времени течения растворов полимера различной концентрации, определить характеристическую вязкость и рассчитать молекулярную массу полимера.
Оборудование: Вискозиметр Оствальда, секундомер, цилиндр на 10 мл, стеклянные палочки.
Реактивы: Насыщенный раствор полимера, растворитель.
Внимание! Все растворы, используемые в данной работе, следует сливать в специальный слив для органических веществ.
Порядок работы:
1. В чистый вискозиметр Оствальда наливают растворитель объемом 6 мл. С помощью груши засасывают растворитель в верхний шарик до верхнего капилляра. Определяют время истечения растворителя от верхнего до нижнего капилляра – t0. Измерения проводят не менее трех раз и берут среднее из полученных значений.
2. Заменяют растворитель на раствор наименьшей концентрации и проводят измерение времени истечения раствора – t. Подобным образом определяют t для всех растворов полимера в порядке возрастания их концентрации.
|
|
|
|
|
|
|
|
|
Таблица 2. |
|
|
|
|
|
|
|
|
|
|
|
|
№ |
Vр-ля, |
Vполимера, |
С, % |
t, с |
отн |
уд |
привед |
[ ] |
M |
|
|
|
мл |
|
|
|
|
|
|
|
|
|
мл |
|
|
|
|
|
|
|
|
|
1 |
6 |
0 |
|
|
|
|
|
|
|
|
2 |
4 |
2 |
|
|
|
|
|
|
|
|
3 |
3 |
3 |
|
|
|
|
|
|
|
|
4 |
2 |
4 |
|
|
|
|
|
|
|
|
5 |
0 |
6 |
|
|
|
|
|
|
|
|
3. Результаты записывают в таблицу, рассчитывают относительную, удельную и приведенную вязкость.
4.Строят график зависимости приведенной вязкости от концентрации полимера. Экстраполяцией прямой на ось ординат определяют характеристическую вязкость.
5.По уравнению Марка-Куна-Хаувинка находят молекулярную массу полимера:
[η] = KMα
6. После окончания работы вискозиметр 2 – 3 раза промывают растворителем.
Вопросы к работе 6:
1.Сравните свойства растворов ВМС и лиофобных коллоидных растворов.
2.Для лиофобных коллоидов характерно наличие мицелл. А каково строение частиц растворов ВМС?
3.Каковы особенности растворения ВМС? Какой процесс называют набуханием?
4.Какие факторы и как влияют на набухание ВМС?
5.Какова роль набухания в физиологии животных и растений?
6.Какие факторы вызывают денатурацию белка? Каков механизм денатурации?
7.Что называют изоэлектрической точкой белка? Какие свойства белка резко меняются в изоэлектрическом состоянии и почему?
8.В каком из растворителей – вода, спирт, толуол, физиологический раствор – желатин будет набухать, а в каком – нет? Почему?
9.Изоэлектрическая точка миозина мышц равна 5. При каких значениях рН: 2, 5 или 7 набухание будет наименьшим?
10.При рН = 6 инсулин при электрофорезе не движется. К какому электроду инсулин будет перемещаться в растворе НСl с концентрацией 0,1 моль/л?
11.В чѐм заключается сущность вискозиметрического метода определения молекулярной массы полимера?

12.Какое уравнение лежит в основе вискозиметрического метода определения молекулярной массы полимеров? Проанализируйте это уравнение.
13.чем объясняется аномально высокая вязкость растворов ВМС?
14.Время истечения из вискозиметра 0,8%-ого раствора полимера (С5Н5Сl-)n равно 53 с, а время истечения растворителя 40 с. Рассчитайте относительную, удельную
и приведенную вязкости.
Глава I ЭЛЕКТРОХИМИЯ
Лабораторная работа 1а
Определение константы диссоциации уксусной кислоты
Краткая теория:
Проводники I рода – металлы и их расплавы в которых электричество переносится электронами.
Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости. Электролиты – вещества, которые в растворе или расплаве распадаются на ионы –
электрически заряженные частицы, способные к самостоятельному существованию в этих средах. Сильные электролиты – вещества, практически полностью диссоциирующие при
растворении в воде (NaCl, HCl, HNO3 и т. д.).
Слабые электролиты диссоциируют на ионы частично (органические кислоты, вода, аммиак, сероводород). Полнота диссоциации слабого электролита количественно характеризуется степенью диссоциации α – отношение числа молекул, распавшихся на ионы (Nр), к общему числу молекул этого электролита, введенных в раствор (Nо):
α =Np/No |
(1.1) |
Степень диссоциации α выражают в долях единицы или в процентах. Степень диссоциации |
|
электролита зависит от концентрации, температуры раствора, характера растворителя, присутствия в растворе одноименных ионов.
Зависимость между степенью диссоциации α, концентрацией С и константой диссоциации
КД электролита выражается законом разведения Оствальда: |
|
||||||||||
K |
|
|
С |
0 |
C |
0 |
|
2 C |
0 |
(1.2) |
|
Д |
|
|
|
|
|||||||
|
|
C0 |
1 |
|
1 |
|
|
||||
|
|
|
|
|
|
||||||
где Со – концентрация кислоты до диссоциации, α – степень диссоциации кислоты в растворе. Для уксусной кислоты при температуре 250С КД = 1,85∙10-5.
Для очень слабого электролита α<<1, и тогда величиной α в знаменателе можно пренебречь
(закон разбавления Оствальда):
КД ≈ Со α2 или |
|
|
K Д |
|
(1.3) |
|
C0 |
||||||
|
|
|
|
|
Электрический ток есть упорядоченное перемещение заряженных частиц.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
R |
l |
(1.4) |
|
S |
|||
|
|
где ρ – удельное сопротивление, (Ом∙м).
Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток и зависит от геометрических параметров проводника:
W |
1 |
|
S |
æ |
S |
(1.5) |
|
R |
l |
l |
|||||
|
|
|
|

где æ – удельная электропроводность, количественная характеристика способности проводников проводить электрический ток (Ом-1∙см-1) или (См∙м-1) (См – сименс). При l = 1 см и S = 1 см2 æ = W. Физический смысл удельной электропроводности – это электропроводность проводника длиной 1 см с площадью поперечного сечения 1 см2.
Зависимости удельной электропроводности от концентрации водных растворов некоторых электролитов представлены на рис.1.
Рис.1. Зависимости удельной электропроводности от концентрации водных растворов некоторых электролитов.
При c 0 величина æ стремится к удельной электропроводности чистой воды, которая составляет приблизительно 10-5 См/м и обусловлена присутствием ионов Н3О+ и ОН-, возникающих при частичной диссоциации воды. С ростом концентрации электролита удельная электропроводность æ сначала увеличивается, что объясняется увеличением числа ионов (носителей заряда) в растворе. Однако, чем больше ионов в растворе, тем сильнее проявляется ион-ионное взаимодействие, приводящее к замедлению движения ионов, а также к их ассоциации. Поэтому почти всегда зависимость удельной электропроводности от концентрации электролита проходит через максимум.
Мольная электропроводность (эквивалентная электропроводность) λ – это электропроводность объема раствора, содержащего 1 моль (или 1 грамм-эквивалент) растворенного вещества и заключенного между электродами, находящимися на расстоянии 1см. В реальных системах мольная электропроводность всегда зависит от концентрации (рис.2).
Рис.2. Зависимости эквивалентной электропроводности от концентрации водных растворов некоторых электролитов.
Размерность λ – (Ом-1∙см2∙моль-1) или (Ом-1∙см2∙г-экв-1). |
|
λ = æ∙υ |
(1.6) |
где υ – разведение раствора, величина обратная концентрации, |
|
(см3 ∙моль-1): |
|
υ =1000/C |
(1.7) |
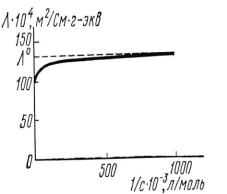
При с 0 (или v ) величина стремится к своему предельному значению о, отвечающему отсутствию ион-ионных взаимодействий. Для иллюстрации этого часто используют графическое представление в координатах =f(1/c) (рис.3) В растворах слабых электролитов, где ион-ионные взаимодействия приводят к образованию нейтральных молекул уже при очень низких концентрациях ионов, выход на предел экспериментально наблюдать не удается.
Рис.3. Зависимость эквивалентной электропроводности раствора KCl от разбавления.
Разведение, при котором достигается максимальное значение молярной электропроводности, условно называется бесконечным, а соответствующая ему электропроводность λ∞ называется
молярной электропроводностью при бесконечном разведении. Величину λ∞ рассчитывают по значениям λ∞ для сильных электролитов, содержащих соответствующие ионы:
λ∞(CH3COOH) = λ∞(CH3COONa) + λ∞(HCl) - λ∞(NaCl) |
(1.8) |
Электропроводность электролита складывается из электропроводности катиона и аниона. Поэтому
можно рассматривать λ∞, как свойство суммарное (аддитивное): |
|
λ∞ = λ+ + λ- |
(1.9) |
Уравнение (1.9) является выражением закона Кольрауша: мольная электропроводность раствора электролита при бесконечном разведении равна сумме подвижностей ионов:
λ+ = Fu+ – подвижность катиона, (м2 ∙Ом-1 ∙моль-1); λ- = Fu- – подвижность аниона, (м2 ∙Ом-1 ∙моль-1); F – число Фарадея 96487 (Кл/моль),
u+ и u- – абсолютные подвижности катиона и аниона,(м2∙В-1∙с-1).
Зная значения молярной электропроводности при данном и при бесконечном разведениях можно вычислить степень диссоциации по формуле Аррениуса:
α = λ/λ∞ |
(1.10) |
Цель работы: С помощью измерения удельной электропроводности растворов уксусной кислоты в интервале концентраций 0,0125 М 0,1 М, рассчитать мольную электропроводность, степень и константу диссоциации уксусной кислоты. Сделать заключение о применимости законов, справедливых для разбавленных растворов, для описания свойств раствора изученного слабого электролита уксусной кислоты.
Оборудование: Портативный измеритель электропроводности и температуры для стандартных измерений, мерные цилиндры и стаканы для растворов уксусной кислоты и дистиллированной воды.
Реактивы: 0,1 M СН3СООН, дистиллированная вода.
Порядок работы:
1.Измерить температуру воздуха в лаборатории и записать в тетрадь.
2.Промыть электрод с ячейкой дистиллированной водой и раствором уксусной кислоты концентрации 0,1 моль л–1.
3.С помощью мерного цилиндра налить в стакан 50 мл раствора уксусной кислоты концентрации 0,1 моль л–1.
4.Опустить электрод с ячейкой в стакан с уксусной кислотой и измерить удельную электропроводность раствора.
5.Отлить из стакана 25 мл раствора кислоты и добавить в стакан 25 мл дистиллированной воды (получили раствор с концентрацией 0,05 моль/л). Тщательно перемешать раствор, измерить его удельную электропроводность.
6.Отлить из стакана 25 мл раствора, добавить 25 мл дистиллированной воды (получили раствор
сконцентрацией 0,025 моль л-1). Вновь измерить удельную электропроводность раствора.
7.Отлить из стакана 25 мл раствора, добавить 25 мл дистиллированной воды (получили раствор
сконцентрацией 0,0125 моль л-1). Вновь измерить удельную электропроводность раствора
8.Результаты измерений и расчетов записать в рабочую тетрадь.
|
|
|
|
Таблица 1. |
|
|
|
|
t = |
°С |
|
|
|
|
|
|
|
|
C |
V |
æ |
|
|
|
|
__ |
|
|
|
К |
К |
||||
|
моль л 1 |
см3 моль 1 |
Ом 1 см 1 |
Ом 1 см2 моль 1 |
|
|||
|
|
|
|
|
||||
|
0,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,05 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,025 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,0125 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.Рассчитать значения разведения, молной электропроводности, степени и константы диссоциации по формулам, приведенным в рабочей тетради.
Величину рассчитать, используя подвижности анионов и катионов при измеренной температуре. (Приложение 5).
10. Результаты работы представить в виде графиков зависимостей: а) удельной электропроводности от разведения æ = f (С); б) мольной электропроводности от разведения = f (V);
в) степени диссоциации от разведения = f (V).
Вопросы и задачи к работе 1
1.Привести примеры проводников первого и второго рода. Причина диссоциации электролитов на ионы в дипольном растворителе. Что является носителем заряда в этих проводниках?
2.Понятия: электропроводность, удельная электропроводность, молярная электропроводность. Дайте размерности этих величин.
3.Как изменяется степень диссоциации слабого электролита с ростом концентрации его раствора?
4.От каких факторов зависит электропроводность растворов электролитов?
5.Объяснить причины изменения удельной электропроводности растворов сильных и слабых электролитов при изменении их концентрации.
6.Объяснить причины изменения мольной электропроводности растворов сильных и слабых электролитов при изменении их концентрации.
7.Сформулировать закон Кольрауша о независимой подвижности ионов. Записать математическое выражение этого закона и указать его практическое значение.
8.Сформулируйте закон разведения Оствальда и запишите математическое выражение этого закона.
9.В чем заключается физический смысл разведения?
10.Что называется степенью диссоциации? Какие факторы влияют на степень диссоциации?
11.Что называется константой диссоциации? Написать выражения для констант диссоциации для НCOOH, H2CO3 по первой и второй ступеням.
12.Какая взаимосвязь существует между степенью и константой диссоциации слабых электролитов?
13.Каково соотношение между абсолютной скоростью движения ионов и подвижностью?
14.Рассчитать мольную электропроводность CH3COOK при бесконечном разведении, если подвижности ионов CH3COO и К+ равны 40,9 Ом 1 см2 моль 1 и 75,3 Ом 1 см2 моль 1, соответственно.
15.Вычислить предельную молярную электрическую проводимость CaCl2 при 25°С, если подвижности ионов Ca+2 и Cl- соответственно равны 1 см2 моль 1 и119 Ом
