
Коллоидные системы
.pdf76,3 Ом 1 см2 моль 1.
16.Рассчитать концентрацию раствора электролита, если его разведение 50000 см3 моль 1.
17.Показать расчетом, какой из растворов электролитов KOH, KBr, HBr одинаковой концентрации имеет наибольшую мольную электропроводность.
18.Рассчитать степень диссоциации раствора муравьиной кислоты концентрации 0,05 М, если константа ее диссоциации равна 1,810 4. Считать, что степень диссоциации много меньше единицы.
19.Степень диссоциации муравьиной кислоты равна 0,3. Рассчитать мольную электропроводность муравьиной кислоты, если подвижности ионов НСОО и Н+ равны
56,4 Ом 1 см2 моль 1и 350 Ом 1 см2 моль 1, соответственно.
20. Абсолютные скорости движения ионов К+ и ОН при 298 К равны 7,6210 4 см2 В 1 с 1 и 20,5 10 4 см2 В 1 с 1, соответственно. Рассчитать мольную электропроводность гидроксида калия при бесконечном разведении.
21.Рассчитать удельную электрическую проводимость в 0,001 М растворе HCl, если абсолютные скорости H+ и Cl- равны 32,410 4 см2 В 1 с 1 и 6,810 4 см2 В 1 с 1.
22.Молярная электрическая проводимость 0,1 М раствора AgNO3 равна 94,3 См см2/моль. Определите удельную электрическую проводимость этого же раствора, если расстояние между электродами равно 3 см и поверхность каждого электрода 7 см2.
23.Для предельно разбавленных растворов KBr, K2SO4 и Li2SO4 молярная электрическая проводимость соответственно равна 151,6; 307,7; 237,2 См см2/моль. Вычислите молярную электрическую проводимость для предельно разбавленного раствора LiBr.
24.Эквивалентная электропроводность бесконечно разбавленных растворов KCl, KNO3, и AgNO3 при 25°С равна, соответственно, 149,9, 145,0 и 133,4 См см2/моль. Какова эквивалентная электропроводность бесконечно разбавленного раствора AgCl при 25°С?
25.Рассчитайте удельную электрическую проводимость 0,16 М раствора пропионовой кислоты при 298 К, если Кд(С2Н5СООН)=1,34 10-5.
26.Вычислите предельную молярную электрическую проводимость бензойной кислоты, если
предельная молярная электрическая проводимость электролитов NaBr, HBr, и C6H5COONa соответственно равны: 128,5 Ом 1 см2 моль 1, 428,2 Ом 1 см2 моль 1 и 82,5 Ом 1 см2 моль 1.
27.Молярная электрическая проводимость раствора муравьиной кислоты при 25°С и разведении
1024 л/моль равна 143,5 Ом 1 см2 моль 1, а при бесконечном разведении – 406,5 Ом 1 см2 моль 1. Определите константу диссоциации кислоты.
28.Вычислите степень и константу диссоциации масляной кислоты, если удельная электрическая проводимость раствора масляной кислоты с концентрацией 0,0156 моль/л равна 1,8110-4 Ом-
1 см-1.
29.Вычислите молярную электрическую проводимость хлорида бария в 10%-ном водном растворе (плотность 1,092 г/мл). Удельная электрическая проводимость этого раствора равна
0,0073 Ом-1 см-1.
30.Удельная электрическая проводимость раствора, в 1,5 л которого находится 4,43 г хлоруксусной кислоты, равна 2,4110-3 См/см. Определите степень и константу диссоциации хлоруксусной кислоты в данном растворе.
31.Водный раствор, содержащий массовую долю CaCl2, равную 5%, имеет при 298 К плотность ρ=1,039 г/см3 и удельную электрическую проводимость 6,4310-2 См/см. Определите молярную
электрическую проводимость. |
|
|
32. Молярная электрическая |
проводимость раствора с массовой долей 38% |
H2SO4 равна |
140 Ом 1 см2 моль 1 при |
293 К. Определить удельную электрическую |
проводимость |
указанного раствора, если его плотность 1,286 г/см.
33.При 295 К удельная электрическая проводимость раствора, содержащего 10% SrCl2, равна 8,86 10-2 См/см, а плотность раствора равна 1,0925 г/см3. Определите молярную электрическую проводимость данного раствора.
34.Удельная электропроводность 5%-го раствора Mg(NO3)2 при 18°С равна 4,38 См/м, а его плотность – 1,038 г/см3. Рассчитайте эквивалентную электропроводность раствора и
кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg+2 и NO3- при 18°С равна 44,6 и 62,6 Ом 1 см2 моль 1.
35.Удельная электропроводность 4%-го водного раствора H2SO4 при 18°С равна 0,168 См/см, а плотность раствора – 1,026 г/см3. Рассчитайте эквивалентную электропроводность раствора.

36. Эквивалентная электропроводность водного раствора сильного электролита при 25°С равна
109,9 См см2 |
моль 1 при концентрации |
6,210-3 моль/л |
и 106,1 См см2 моль 1 |
при |
концентрации |
1,510-2 моль/л. Какова эквивалентная электропроводность раствора |
при |
||
бесконечном разбавлении? |
|
|
|
|
37.Эквивалентная электропроводность водного раствора слабой одноосновной кислоты при 25°С равна 16,0 См см2 моль 1 при концентрации 1,010-2 моль/л и 48,4 См см2 моль 1 при концентрации 1,010-3 моль/л. Рассчитайте эквивалентную электропроводность раствора при бесконечном разбавлении и константу диссоциации кислоты.
38.Константа диссоциации гидроксида аммония равна 1,7910-5. Рассчитайте концентрацию
NH4OH, при которой степень диссоциации равна 0,01, и эквивалентную электропроводность раствора при этой концентрации.
39.Константа диссоциации масляной кислоты C3H7COOH равна 1,7410-5. Эквивалентная электропроводность раствора при разведении 1024 л/моль равна 41,3 См см2 моль 1. Рассчитайте степень диссоциации кислоты и концентрацию ионов водорода в этом растворе, а также эквивалентную электропроводность раствора при бесконечном разведении.
40.Эквивалентная электропроводность раствора гидроксида этиламмония C2H5NH3OH при бесконечном разведении равна 232,6 См см2 моль 1. Рассчитайте константу диссоциации гидроксида этиламмония раствора, степень диссоциации и концентрацию ионов гидроксила в растворе при разведении 16 л/моль, если удельная электропроводность раствора при данном разведении равна 1,31210-5 См см-1.
Лабораторная работа 1б
Кондуктометрическое титрование
Краткая теория:
Измерение электропроводности растворов называют кондуктометрией или кондуктометрическим титрованием. Кондуктометрию используют не только для определения степени и константы диссоциации электролитов, но и для определения концентрации электролитов в растворах, их растворимости, основности кислот. Кондуктометрическое титрование применяется при исследовании мутных или окрашенных растворов, исключающих возможность применения индикаторов. Сущность кондуктометрического титрования заключается в измерении электропроводности раствора, меняющейся в ходе химической реакции после добавления очередной порции титранта. По полученным данным строят графическую зависмость электропроводности раствора от количества (мл) добавленного реагента. Подобные зависимости называются кривыми кондуктометрического титрования (рис.4). Для кондуктометрического определения вещества пригодны реакции, на кондуктометрических кривых титрования которых имеется четкий излом в точке эквивалентности. Если титруется смесь веществ, то число изломов на кривой будет соответствовать числу компонентов титруемой смеси.
Метод основан на присутствии в растворах кислот (или оснований) высокоподвижных ионов Н+ (или ОН-), что обуславливает хорошую электропроводность. Аномально высокие подвижности гидроксония и гидроксила объясняются особым механизмом переноса электрического заряда этими ионами, называемым эстафетным:
.. |
|
|
|
|
+ |
.. |
|||||
H++ O |
|
H |
|
H |
O H |
|
H |
|
O + H+ |
||
|
|
|
|
|
|
|
|
|
|
||
H |
|
|
H |
|
|
|
H |
||||
При титровании происходит реакция нейтрализации, и вместо этих ионов в растворе накапливаются ионы солей, обладающие меньшей подвижностью. В тот момент, когда вся кислота (или основание) будет нейтрализована эквивалентным количеством основания (или кислоты), электропроводность раствора будет минимальной. Добавление избытка основания (или кислоты) приводит вновь к появлению высокоподвижных ионов ОН- (или Н+), и электропроводность начинает резко возрастать.
На кривой кондуктометрического титрования точке эквивалентности соответствует излом, и
выполняется закон эквивалентных отношений: |
|
Ск ∙Vк = Cщ ∙Vэ |
(1.11) |
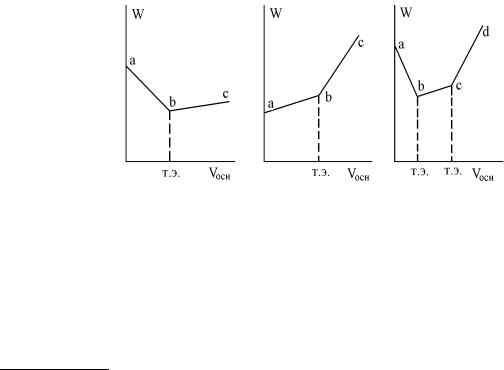
где Ск и Cщ – концентрации кислоты и щелочи, Vк – объем кислоты, взятый для титрования, а Vэ – эквивалентный объем щелочи, найденный из графика.
а) |
б) |
в) |
Рис.4. |
Кривые кондуктометрического титрования: |
|
сильной кислоты (а) сильным основанием, |
|
|
|
слабой кислоты (б) сильным основанием |
|
смеси сильной и слабой кислот (в) сильным основанием
Кондуктометрия находит широкое применение в биохимических, физиологических, санитарногигиенических и клинических исследованиях. Этот метод используют для определения общего содержания и состояния электролитов в различных биологических объектах: плазме и сыворотке крови, желудочном соке, а также в водах минеральных источников и в продуктах питания.
Цель работы: Определить концентрацию раствора сильной кислоты методом кондуктометрического титрования.
Оборудование: Портативный измеритель электропроводности и температуры для стандартных измерений, штатив с бюреткой, мерный цилиндр, стакан.
Реактивы: Раствор гидроксида калия концентрации 0,05 М, раствор соляной кислоты неизвестной концентрации, дистиллированная вода.
Порядок работы:
1.Промыть стакан и электрод с ячейкой дистиллированной водой.
2.С помощью мерного цилиндра налить в стакан 50 мл раствора соляной кислоты неизвестной концентрации.
3.Опустить в стакан электрод с ячейкой и поместить стакан под слив бюретки с раствором щелочи.
4.Измерить электропроводность раствора соляной кислоты в стакане, результат записать в таблицу 2.
5.Добавить в стакан 1 мл раствора щелочи, перемешать раствор и измерить его электропроводность. Добавление по 1 мл щелочи и измерение электропроводности раствора проводить до тех пор, пока не получите 4–5 возрастающих значений электропроводности раствора. Все результаты записать в рабочую тетрадь.
6.По окончании работы выключить прибор и привести в порядок рабочее место.
Таблица 2.
Vщ |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
мл |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
æ, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ом 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7.По результатам измерений построить кривую кондуктометрического титрования зависимость электропроводности раствора æ от объема добавленной щелочи Vщ.
8.По графику определить точку эквивалентности Vэ, опустив перпендикуляр на ось абсцисс из точки пересечения двух ветвей кривой кондуктометрического титрования.
9.Рассчитать концентрацию соляной кислоты по формуле:
Ск = Cщ (Vэ / Vк),
где Cк – искомая концентрация соляной кислоты;
Cщ – концентрация щелочи (0,05 М);
Vк – объем взятого для титрования раствора кислоты (50 мл);
Vэ – эквивалентный объем щелочи, найденный по графику.
Вопросы и задачи к работе 2
1.В чем заключается сущность кондуктометрии? Для каких целей используют этот метод в медико-биологических исследованиях?
2.Как определяют точку эквивалентности при кондуктометрическом титровании?
3.Когда заканчивают кондуктометрическое титрование?
4.Начертить кривую кондуктометрического титрования раствора пропионовой кислоты раствором щѐлочи. Объяснить ход кривой и указать ионы, которые участвуют в электропроводности на всех участках этой кривой.
5.Изобразить на графике зависимость электропроводности раствора едкого натра при титровании его раствором азотной кислоты. Указать ионы, которые участвуют в электропроводности на всех участках этой зависимости.
6.Начертить кривую кондуктометрического титрования раствора соляной и уксусной кислот раствором щелочи. Объяснить ход кривой.
7.Начертить кривую кондуктометрического титрования раствора соляной кислоты раствором щѐлочи. Указать ионы, которые участвуют в электропроводности на всех участках этой кривой.
8.Начертить кривую кондуктометрического титрования смеси NH3 и KOH раствором сильной кислоты.
9.Почему электропроводность сильных кислот и щелочей значительно выше, чем электропроводность их солей?
10.Чем объясняется аномально высокая подвижность ионов Н+ и ОН ?
11.Записать закон эквивалентных соотношений.
12.В чем заключается преимущество кондуктометрического титрования по сравнению с титрованием с индикаторами?
Глава II ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ.
Лабораторная работа 2а
Измерение ЭДС медно-цинкового гальванического элемента и концентрационного элемента
Краткая теория:
При соприкосновении двух химически или физически разнородных материалов (металл 1 (проводник I рода) — металл 2 (проводник I рода), металл (проводник I рода) — раствор соли металла (проводник II рода), раствор электролита 1 (проводник II рода) — раствор электролита 2 (проводник II рода) и т.д.) между ними возникает двойной электрический слой (ДЭС). ДЭС является результатом упорядоченного распределения противоположно заряженных частиц на границе раздела фаз. Образование ДЭС приводит к скачку потенциала , который в условиях

термодинамического равновесия металл (проводник I рода) — раствор соли металла (проводник II
рода), называется гальвани-потенциалом.
Система, состоящая из металла, погруженного в раствор соли, содержащей катионы этого металла, называется электродом или полуэлементом.
Схему электрода можно представить следующим образом:
Меn+│Ме
φ>0, если на электроде протекает реакция восстановления
Меn+ + ne– Ме0,
φ<0, если на электроде протекает реакция окисления
Me0 Меn+ + ne–
Электродным потенциалом металла EMen Me называется равновесная разность
потенциалов, возникающая на границе фаз проводник I рода/проводник II рода и измеренная относительно стандартного водородного электрода. Зависимость электродного потенциала металла от его природы, концентрации металла в растворе и температуры выражается уравнением Нернста, которое для электродной реакции имеет вид (электродная реакция записывается как реакция восстановления):
|
|
|
|
|
E |
|
|
E 0 |
|
|
|
R T |
ln C |
|
|
(2.1) |
|
|
|
|
||
|
|
|
|
|
n |
Me |
n |
/ Me |
|
n |
|
|
|
|
|
|||||||
|
|
|
|
|
|
Me |
|
Me |
|
n F |
|
M |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
E0 n |
/ Me |
|
стандартный |
|
электродный |
потенциал |
металла (равновесная |
разность |
|||||||||||||
|
Me |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
потенциалов |
|
между металлом |
и |
|
раствором при активности катионов металла в растворе |
|||||||||||||||||
1 моль л 1); |
F |
число |
Фарадея |
|
(96500 Кл моль 1); |
R универсальная газовая постоянная |
||||||||||||||||
(8,31 Дж моль 1град 1); |
n |
число |
|
электронов, |
участвующих |
в электродной реакции; |
C |
n |
|
- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
концентрации металла в растворе. Последовательность стандартных электродных потенциалов, представленных в порядке возрастания (или убывания), называется электрохимическим рядом напряжения металлов (приложение 4). В паре электродов окислителем будет тот электрод, значение стандартного электродного потенциала которого больше, и наоборот.
Гальванический элемент – устройство, состоящее из двух или более электродов, в котором химическая энергия окислительно-восстановительной реакции (ОВР) переходит в полезную электрическую энергию (например, в виде свечения лампы накаливания) при условии пространственного разделения процессов окисления и восстановления. Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом.
Э.Д.С. (Е) – это электродвижущая сила, которая численно равна максимальной работе по перемещению заряда по замкнутой цепи.
E = Еправ Елев |
(2.2) |
Правила ИЮПАК для записи гальванических элементов и реакций, протекающих в них.
1.В гальваническом элементе работа производится, поэтому ЭДС элемента считается величиной положительной.
2.Величина ЭДС гальванической цепи Е определяется алгебраической суммой скачков потенциала на границах раздела всех фаз, но так как на аноде протекает окисление, то ЭДС рассчитывают, вычитая из числового значения потенциала катода (правого электрода) значение потенциала анода (левого электрода) – правило правого полюса. Поэтому, схему
элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительный (протекает процесс восстановления).
3.Границу раздела между проводником I рода и проводником II рода обозначают одной чертой.
4.Границу между двумя проводниками II рода изображают пунктирной чертой.
5.Электролитный мостик на границе двух проводников II рода обозначают двумя пунктирными чертами.
6.Компоненты одной фазы записывают через запятую.
7.Уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме (Ox), а справа – в восстановленной (Red).
Схема медно-цинкового электрохимического элемента (элемента Даниэля - Якоби) (рис.5):

|
|
|
|
|
|
|
|
|
|
Рис.5. Гальванический элемент |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
( ) Cu│Zn│ZnSO4 ¦ KCl ¦ СuSO4 │Cu (+) |
|
|
|
|
|
|
|
|
||||||||||||||
На поверхности медного электрода протекает восстановление ионов меди |
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
Cu2+ + 2e Cu, |
|
Е0=0,337В |
|
|
|
|
|
|
|
|
|
||||||||||
а на поверхности цинкового окисление металлического цинка: |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
Zn 2e Zn2+, |
|
Е0=-0,76В |
|
|
|
|
|
|
|
|
|
|
||||||||
Складывая, получим суммарное химическое превращение: |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Zn + Cu+ Zn2+ + Cu. |
|
|
|
|
|
|
|
|
|
|
||||||||
Согласно (2.2) и (2.1) Э.Д.С. медно-цинкового гальванического элемента равна |
|
|
|
|
|
||||||||||||||||||||||||
E Е |
|
Е |
|
E |
|
|
E |
|
|
|
|
|
|
0 |
|
|
|
R T |
|
|
|
|
0 |
|
|
R T |
|
|
|
прав |
лев |
2 |
Cu |
2 |
|
|
E E |
2 |
|
|
|
ln C |
2 |
|
E |
2 |
|
|
|
ln C |
2 |
|
|||||||
|
|
n F |
|
|
n T |
||||||||||||||||||||||||
|
|
|
Cu |
|
Zn |
Zn |
|
|
|
Cu |
/ Cu |
|
|
Cu |
|
|
Zn |
/ Zn |
|
|
Zn |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E E o |
R T |
ln |
CCu 2 |
|
, |
|
|
|
|
|
(2.3) |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
n F C |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гальванический элемент, составленный из двух полуэлементов, отличающихся друг от друга только концентрацией электролитов, называется концентрационным гальваническим элементом. Например, медный концентрационный элемент
( ) Cu│CuSO4 ¦ KCl ¦ СuSO4 │Cu (+)
C1 |
C2 |
Э.Д.С. такого концентрационного гальванического элемента равна:
E = Еправ Елев. |
E |
R T |
ln |
C2 |
, где С2 С1 (2.4) |
|
n F |
C |
|||||
|
|
|
|
|||
|
|
|
|
1 |
|
Для измерения электродных потенциалов используют два основных вида электродов: электроды сравнения и электроды для определения рН растворов электролитов.
1.Электроды сравнения имеют хорошо воспроизводимый и сохраняющийся на протяжении всего опыта скачок потенциала. К ним относятся стандартный водородный и хлорсеребряный электроды.
а) Электродный потенциал стандартного водородного электрода описывается уравнением Нернста:
E E 0 |
R T |
ln |
C |
H |
|
(2.5) |
||
|
|
|
|
|||||
F |
P1 2 |
|||||||
|
|
|
||||||
где Eo стандартный потенциал |
водородного электрода; P давление газообразного |
|||||||
водорода, равное 1 атм; СН+ концентрация Н+ в растворе, равная 1 моль л 1. |
||||||||
б) Электродный потенциал хлорсеребряного электрода равен: |
|
|||||||
ЕAgCl = 0,2224 0,00065 (t 25) [В] |
(2.6) |
|||||||
2.Для измерения рН растворов чаще всего используют стеклянный электрод.
а) Стеклянный электрод используют для определения концентрации ионов водорода в кислой среде. Его электродный потенциал рассчитывают по формуле:
E |
|
Eo |
2,3 |
R T |
lg C |
|
Eo |
2,3 |
R T |
pH (2.7) |
ст. |
|
H |
|
|||||||
|
ст. |
|
F |
ст. |
|
F |
|
|||
|
|
|
|
|
|
|
|
|||
Цель работы: Измерить |
ЭДС |
медно-цинкового |
гальванического |
элемента с помощью |
||||||

потенциометра (иономера). Полученные значения ЭДС сопоставить с величинами, рассчитанными по формулам (2.3) и (2.4).
Оборудование: Электрохимическая (гальваническая) ячейка, электроды медный и цинковый, потенциометр (иономер) для стандартных измерений.
Реактивы: Растворы: CuSO4 концентраций 0,01, 0,1 и 0,5 М; ZnSO4 концентраций 0,01, 0,1 и 0,5 М; насыщенный раствор KCl, дистиллированная вода.
Порядок работы:
Измерение ЭДС медно-цинкового гальванического элемента потенциометром.
1. Составить медно-цинковый гальванический элемент (рис.5): ( ) Zn ZnSO4 CuSO4 Cu (+)
Концентрации растворов электролитов указываются преподавателем.
Подключить медно-цинковый элемент к потенциометру (иономеру): медный электрод гальванического элемента подключить к клемме "+" потенциометра, цинковый к " ".
2.Измерить ЭДС элемента потенциометром (иономером), пользуясь инструкцией к прибору. Результаты измерений записать в таблицу в рабочую тетрадь.
3.Рассчитать значение ЭДС медно-цинкового элемента.
4.Повторить измерения с п.1 по п. 4 для растворов электролитов с другими концентрациями.
Таблица 3.
|
Номера |
Электроды |
Электролиты |
С, |
Еизмер., |
Ерасчѐт., |
||
|
опытов |
моль л 1 |
В |
В |
||||
|
|
|
|
|||||
|
|
а |
Cu |
|
CuSO4 |
|
|
|
|
1 |
Zn |
|
ZnSO4 |
|
|
|
|
|
|
|
|
|
|
|||
|
б |
Cu |
|
CuSO4 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
Zn |
|
ZnSO4 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
а |
Cu |
|
CuSO4 |
|
|
|
|
2 |
Cu |
|
CuSO4 |
|
|
|
|
|
|
|
|
|
|
|||
|
б |
Zn |
|
ZnSO4 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
Zn |
|
ZnSO4 |
|
|
|
|
|
|
|
|
|
|
|
||
Измерение ЭДС концентрационного элемента. |
|
|
|
|||||
1. Составить одну из указанных цепей: |
|
|
|
|
||||
|
( ) Zn ZnSO4 ZnSO4 Zn (+) |
или ( ) Cu CuSO4 CuSO4 Cu (+) |
||||||
|
С1 |
С2 |
|
|
С1 |
С2 |
|
|
Концентрации электролитов указываются преподавателем.
Подключить концентрационный элемент к потенциометру (иономеру) и измерить его ЭДС. Результаты измерений записать в таблицу.
2.Сравнить полученное значение с ЭДС концентрационного элемента, рассчитанной по уравнению (2.4).
Вопросы и задачи к работе 3
1.Механизм возникновения скачка потенциала на границе раздела металл жидкость. Запишите какие скачки потенциалов возникают на всех границах раздела фаз.
2.Что называется гальвани-потенциалом? Мерой чего служит его величина?
3.Гальвани-потенциал, электродный потенциал, стандартный электродный потенциал. Факторы, влияющие на величину электродного потенциала.
4.Устройство гальванического элемента. Показать, какие скачки потенциалов возникают на границах раздела фаз в медно-цинковом гальваническом элементе. Какие из них дают максимальный вклад в величину ЭДС элемента?
5.Уравнение Нернста, понятие стандартного электродного потенциала.
6.От чего зависит величина стандартной ЭДС электрохимического элемента?
7.Водородный электрод: схема, строение, уравнение реакции, особенности.
8.Стандартные электродные потенциалы литиевого Li и серебряного Ag электродов соответственно равны –3,02 В и +0,799 В. Определить стандартную ЭДС элемента, составленного из этих электродов.
9.Составьте схему гальванического элемента из медного и цинкового электродов, погружѐнных
в1 М растворы солей этих металлов. Рассчитайте ЭДС этого элемента. Напишите уравнения электродных процессов. Изменится ли ЭДС, если взять 0,001 М растворы солей?
10.От каких параметров зависит ЭДС концентрационного элемента?
11.ЭДС двух концентрационных элементов равны 0,75 В и 0,30 В, соответственно. Показать расчетом, в каком из элементов больше отношение концентраций растворов?
12.Для гальванического элемента
Pt | Сr3+,Сr2+ || Со3+,Со2+ | Pt
вычислить стандартную ЭДС Е°, если Е°(Cr3+,Сr2+|Pt)=-0,41 В, Е°(Co3+,Сo2+|Pt)=1,82 В. Написать уравнение реакции, протекающей в элементе. Рассчитать электродные потенциалы и величину ЭДС элемента, если С(Cr3+)=0,005; С(Cr2+)=0,05; С(Со2+)=0,1; С(Co3+)=0,1.
13. Гальванический элемент представлен схемой:
( ) Mg Mg2+ Co2+ Co (+)
Mg2+ Mg Ео = 2,363 В
Co2+ Co Ео = 0,277 В
Рассчитать стандартное значение ЭДС этого элемента. Написать электродные реакции.
14.Концентрации растворов в концентрационном элементе 0,150 и 0,005 моль л 1. Рассчитать ЭДС элемента. Т = 300 К, F = 96500 Кл моль 1, n = 2, R = 8.31 Дж моль 1град 1.
15.Вычислите ЭДС элемента:
Pt /Ti+4, Ti+3 // Sn+4, Sn+2/ Pt
C1 C2 C3 C4
C1=C2=C3=C4=1. Значения стандартных потенциалов для электродов Ti+4, Ti+3 и Sn+4, Sn+2 соответственно равны 0,04 и 0,15 В.
16. |
Определите ЭДС при 298К для элемента: |
|
|
|
Pt,H2 / H+ // C6H4(OH)2, C6H4O, H+/Pt |
||
|
Стандартный электродный потенциал хингидронного электрода равен 0,6994 В. |
||
17. |
Стандартные электродные потенциалы некоторых металлов приведены ниже: |
||
|
Са2+ |
+ 2е Са0 |
Е0 = 2,870 В |
|
Сu2+ |
+ 2е Cu0 |
Е0 = 0,337 В |
|
Mn2+ + 2e Mn0 |
Е0 = 1,180 В |
|
Какой из перечисленных металлов легче переходит в раствор?
18.Рассчитайте, чему равен потенциал цинкового электрода, опущенного в раствор с концентрацией ZnSO4, равной 0,001 М, Т=298 К.
19.Потенциал медного электрода, помещѐнного в раствор его соли, составил +0,32 В. Вычислить концентрацию ионов меди.
20.Потенциал марганцевого электрода, помещѐнного в раствор его соли, составил -1,2 В. Вычислить концентрацию ионов марганца.
21.Вычислите концентрацию ионов водорода в растворе, в котором потенциал водородного электрода равен -82 мВ.
22.Вычислить концентрацию ионов Со2+ в растворе CoCl2 при 298 К, если потенциал кобальтового электрода в указанном растворе равен -0,308 В относительно стандартного водородного электрода, а стандартный потенциал этого электрода равен -0,277 В.
23.Вычислить концентрацию ионов Hg2+ в растворе, при котором потенциал электрода Hg2+/Hg+
по отношению к стандартному водородному электроду равен нулю. Стандартный электродный потенциал Hg2+/Hg+ равен 0,796 В.
24.Вычислите ЭДС серебряно-кадмиевого гальванического элемента, в котором концентрации ионов Ag+ и Cd2+ соответственно равны 0,1 и 0,005 моль/л. Составьте схему гальванического элемента и напишите уравнения реакции, протекающей при его работе.
25.Гальванический элемент составлен из двух водородных электродов, погружѐнных в растворы ацетата натрия и хлорида аммония с концентрациями по 1,0 моль/л. Вычислите ЭДС цепи при
298 К.
Лабораторная работа 2б
Определение редокс-потенциала
Краткая теория:
Система, содержащая в одной фазе окисленную и восстановленную форму одного и того же вещества или нескольких веществ, называется окислительно-восстановительной или редокс системой.
В момент динамического равновесия на поверхности электрода из инертного металла, помещенного в редокс-систему, возникнет равновесный потенциал, который называют
окислительно-восстановительным (ОВ) или редокс – потенциалом Еr, который для реакции
Ox+ne→Red рассчитывается по уравнению Нернста:
E |
|
E o |
R T |
ln |
COx |
(2.9) |
r |
|
|
||||
|
r |
n F |
|
CRe d |
|
|
|
|
|
|
|
где Er стандартный редокс-потенциал; n число электронов, передаваемых с донора (Red) на акцептор (Ох) в элементарном акте; CОх и CRed концентрации окисленной (Ox) и восстановленной (Red) форм, соответственно.
Инертный металл принимает лишь косвенное участие в потенциалопределяющей реакции, являясь посредником в передаче электронов от восстановленной формы вещества к окисленной и наоборот.
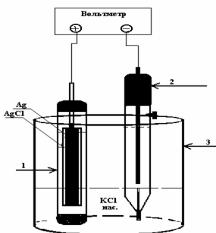
Окислительно-восстановительные |
реакции |
Рис.6. |
Гальваническая цепь |
||
играют важную |
роль в биологических процессах. |
для |
измерения |
redox- |
|
Например, почва представляет собой сложную |
потенциала |
|
|||
естественную |
окислительно-восстановительную |
|
|
|
|
систему. Редокс-процессы в почве чаще всего |
|
|
|
||
являются |
необратимыми. |
Важнейшим |
|
|
|
окислительным агентом в почвах является кислород. |
|
|
|
||
Любые причины ухудшающие аэрацию (напр., |
|
|
|
||
заболачивание) приводят к уменьшению редокс- |
|
|
|
||
потенциала с 300-650 до 100-200 мВ, что в свою |
|
|
|
||
очередь, влияет на подвижность таких элементов |
|
|
|
||
питания растений как железо, марганец, азот и пр. |
|
|
|
||
При разложении органических соединений в |
|
|
|
||
условиях высоких значений Еr сера переходит |
|
|
|
||
преимущественно в сульфаты, а при низких |
|
|
|
||
значениях (анаэробные условия) – в сульфиды. Для |
|
|
|
||
измерения Еr |
почвы используются |
платиновые |
|
|
|
электроды, а в качестве электродов сравнения используется хлорсеребряный электрод (Рис.6).
Цель работы: Измерить редокс-потенциал нескольких смесей различного состава, приготовленных из растворов солей K3[Fe(CN)6] (красная кровяная соль) и K4[Fe(CN)6] (жѐлтая кровяная соль). Построить график зависимости редокс-потенциала этой системы от логарифма соотношений концентраций окисленной и восстановленной форм железа.
Оборудование: Штатив с бюретками, потенциометр (иономер), электроды: платиновый (измерительный) и хлорсеребряный (сравнения), химические стаканы.
Реактивы: Растворы красной K3[Fe(CN)6] и желтой K4[Fe(CN)6] кровяных солей одинаковой концентрации 0,01 моль л 1, раствор KCl (2 моль л 1), дистиллированная вода, бумажные фильтры.
Порядок работы:
1.Составить смеси растворов красной и желтой кровяных солей в соответствии с таблицей 4.
2.Измерить потенциометром ЭДС элемента:
( ) Ag AgCl, КClнасыщ K3[Fe(CN)6], K4[Fe(CN)6] Pt (+)
для каждого соотношения концентраций окисленной и восстановленной форм железа. 3. Рассчитать величину редокс-потенциала Еr по формуле:
Еr = E + ECl¯, Ag /Ag,
где Еr редокс-потенциал, В,
Е измеренное потенциометром значение ЭДС, В,
ECl¯, Ag /Ag |
потенциал насыщенного хлорсеребряного электрода, величина которого для |
|||||||
данной температуры (в °С) рассчитывается по формуле: |
|
|
|
|||||
|
|
ECl¯, Ag /Ag = 0.2224 – 0.00065 (t – 25). |
|
|
|
|||
|
|
|
|
|
|
|
Таблица 4. |
|
|
|
|
|
|
|
|
|
|
|
|
Объем, мл |
|
Cох /Cred |
|
lg (Cох /Cred) |
E, B |
Er, B |
K3[Fe(CN)6] |
|
K4[Fe(CN)6] |
КС1 |
|
||||
|
|
|
|
|
|
|||
20 |
|
2 |
10 |
|
|
|
|
|
16 |
|
6 |
10 |
|
|
|
|
|
11 |
|
11 |
10 |
|
|
|
|
|
6 |
|
16 |
10 |
|
|
|
|
|
2 |
|
20 |
10 |
|
|
|
|
|
4.Построить график зависимости Еr от lg (Cox/Cгеd). По оси ординат отложить значения Еr, начиная с 0,3 В (масштаб: 0.1 В – 2 см), а по оси абсцисс – значения lg (Cox/Cгеd), (масштаб: 1
ед. – 5 см).
5.Рассчитать из графика:
а) тангенс угла наклона построенной прямой, б) величину Еоr.
6.Сравнить полученные значения с теоретическими:
а) с тангенсом угла наклона, рассчитанным по уравнению: RТ/nF = 0,059/n, б) со стандартным редокс-потенциалом Еоr=0,36 В.
7.Объяснить расхождения между практическими и теоретическими значениями этих величин.
Вопросы и задачи к работе 4
1.Привести примеры окислительно-восстановительных систем; написать уравнения электрохимических реакций.
2.Что представляет собой окислительно-восстановительный электрод?
3.Какие электроды используют в качестве электродов сравнения?
4.Хлорсеребряный электрод: схема, строение, уравнение реакции, особенности.
5.Зависит ли потенциал редокс-электрода от температуры?
6.С какой целью во все исследуемые редокс-системы вводится раствор хлорида калия?
7.Каким металлом можно заменить платину в редокс-электроде?
8.Привести примеры редокс-систем. Какова функция платинового электрода в этих системах?
9.Потенциал редокс-электрода в системе Cr2O72-/Cr3+ равен 1,96 В, Ео (Cr2O72-/Cr3+) = 1,33 В. Определить отношение концентраций окисленной и восстановленной форм ионов хрома в этой системе.
10.Рассчитайте величину потенциала окислительно-восстановительного электрода Pt/Fe3+,Fe2+, если концентрации FeCl3 и FeCl2 соответственно равны 0,05 М и 0,85 М.
11.В какой из приведѐнных ниже систем возникает окислительно-восстановительный потенциал:
а) Cu/Cu+2; б) Ag,AgCl/HCl; в) Pt/Cu+2,Cu+; г) Pt,H2/HCl. Рассчитайте Red-Ox потенциал этой системы при 25°С, если отношение концентраций окисленной и восстановленных форм равно
3?
12.Какие электроды можно использовать для измерения рН? Какой из приведѐнных ниже процессов протекает на поверхности стеклянного электрода?
Н+ + ē = 1/2Н2, |
Н+ + ОН- = Н2О |
Н+р-р ↔ Н+пов-сть, |
Н+р-р + ē = Нпов-сть |
13.Дан электрод Pt/Sn4+,Sn2+. Концентрации равны С(SnCl4)=0,01 М, C(SnCl2)=0,001 М. Определите тип электрода и его потенциал.
14.Чему равно отношение концентраций ионов Tl3+ и Tl+, если потенциал электрода Tl3+,Tl+/Pt равен нулю, а стандартный потенциал этого электрода по отношению к стандартному водородному электроду равен +1,25 В.
15.Вычислите теоретическое значение редокс-потенциала для системы, содержащей по 10 мл
гексацианоферрата (III) и гексацианоферрата (II) калия с концентрациями 0,01 моль/л и 0,05 моль/л.
16.В растворе концентрация гексацинохромат (III)-ионов в 3 раза превышает концентрацию гексацинохромат (II)-ионов. Чему равен редокс-потенциал этой системы?
