
- •1. Тепловое излучение и его характеристики. Абсолютно черное тело 2. Тепловое излучение. Закон Кирхгофа
- •3. Тепловое излучение. Законы Стефана-Больцмана и смещения Вина 4. Тепловое излучение. Формула Планка 5. Виды фотоэффекта. Законы внешнего фотоэффекта
- •6. Уравнение Эйнштейна для внешнего фотоэффекта
- •7. Эффект Комптона
- •8. Масса и импульс фотона. Давление света
- •9. Единство корпускулярных и волновых свойств электромагнитного излучения
- •10. Линейчатый спектр атома водорода
- •Серия Брэкета
10. Линейчатый спектр атома водорода
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода.
Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:

где R'=1,10•107 м-1 — постоянная Ридберга
В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:

В инфракрасной области спектра были также обнаружены: серия Пашена

Серия Брэкета
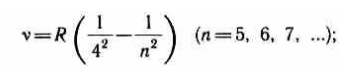
11. Постулаты
Бора. Теория атома водородоподобного
атома по Бору.



12. Корпускулярно-волновой дуализм свойств вещества




13. Свойства волн де Бройля


14. Соотношение неопределенностей Гейзенберга




-
Волновая функция и ее статистический смысл


-
Общее уравнение Шредингера

17. Уравнение Щредингера для стационарных состояний


18. Атом водорода в квантовой механике
19 и 20. Спин электрона. Спиновое квантовое число. Принцип Паули.

21. Распределение электронов в атоме по состояниям





22. Периодическая система элементов Менделеева
Периодический закон Д.И. Менделеева:
Первоначальная формулировка:
"Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса".
Современная формулировка:
"Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Слева направо усиливаются окислительные свойства, а при движении сверху вниз – восстановительные свойства элементов.
Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У "тяжелых" благородных газов криптона и ксенона, которые находятся в нижней части группы, удается "отобрать" электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для "легких" гелия, неона и аргона это осуществить не удается.
В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу - самый активный металл-восстановитель цезий (Cs). Цезий настолько активен, что самовозгорается на воздухе (посмотрите опыт из "Единой коллекции цифровых образовательных ресурсов"). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада.
Электроотрицательность возрастает тоже слева направо, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
При перемещении сверху вниз по группам электроотрицательность уменьшается. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
