Кристаллизация. Теория образования зародышей
Равновесное состояние системы при постоянной температуре и объеме можно
охарактеризовать минимумом свободной
энергии Гельмгольца
![]() где
где
![]() −
внутренняя энергия, равная сумме энергии
связи частиц
−
внутренняя энергия, равная сумме энергии
связи частиц
![]() и
тепловой энергии, определяемой
температурой T и
теплоемкостью
и
тепловой энергии, определяемой
температурой T и
теплоемкостью
![]() .
.
 –
энтропия системы.
–
энтропия системы.
Внутренняя энергия U
и энтропия S с повышением
температуры растут и при температуре
плавления
![]() ,
испытывают скачки, обусловленные
теплотой плавления Q.
Ее наличие показывает, что речь идет о
фазовом переходе I рода.
,
испытывают скачки, обусловленные
теплотой плавления Q.
Ее наличие показывает, что речь идет о
фазовом переходе I рода.
Кривые солидуса s и ликвидуса l (рис. 13.12) для свободной энергии твердого тела и жидкой фазы убывают из-за влияния энтропийного члена. Для жидкой фазы скорость убывания больше, чем для твердой, за счет того, что степень неупорядоченности жидкости больше, чем у твердого тела. Поэтому ниже точки пересечения кривых s и l устойчива твердая фаза, а выше – жидкая. Точка пересечения не является особой точкой, поэтому возможны переохлаждение расплава и перегрев кристалла.
|
|
|
Рис. 13.12. Вид зависимости свободной энергии от температуры для твердой – S и жидкой – l фаз |
При температуре
![]() в
равновесии находятся две фазы: расплав
и кристалл. При температуре
в
равновесии находятся две фазы: расплав
и кристалл. При температуре
![]() идет
фазовое превращение расплава в кристалл.
Переохлаждение на величину
идет
фазовое превращение расплава в кристалл.
Переохлаждение на величину
![]() (степень
переохлаждения) приводит к тому, что
расплав (или фаза β) становится
метастабильной по отношению к кристаллу
(фаза α). Для начала спонтанного
процесса кристаллизации необходимо
возникновение центра кристаллизации,
или кристаллического зародыша.
(степень
переохлаждения) приводит к тому, что
расплав (или фаза β) становится
метастабильной по отношению к кристаллу
(фаза α). Для начала спонтанного
процесса кристаллизации необходимо
возникновение центра кристаллизации,
или кристаллического зародыша.
Пусть ΔF – увеличение
свободной энергии при образовании новой
фазы (твердой). При этом полное превращение
энергии системы определяется двумя
факторами: уменьшением свободной энергии
при росте объема, занимаемого новой
фазой
![]() (V
– объем новой фазы, Δf
– свободная энергия единицы объема), и
(V
– объем новой фазы, Δf
– свободная энергия единицы объема), и
![]() –
доля, обусловленная ростом поверхности
раздела двух фаз (
– свободная энергия единицы
поверхности;
–
доля, обусловленная ростом поверхности
раздела двух фаз (
– свободная энергия единицы
поверхности;
![]() –
площадь этой поверхности)
–
площадь этой поверхности)
|
|
(13.45) |
Площадь поверхности и объем вновь
образовавшегося кристаллического
зародыша соответственно
![]() и
и
![]() ,
где R – радиус зародыша.
Тогда для зародыша радиусом R
находим
,
где R – радиус зародыша.
Тогда для зародыша радиусом R
находим
|
|
(13.46) |
Первый член в уравнении (13.46) равен
уменьшению внутренней объемной энергии
зародыша за счет выделения теплоты
кристаллизации q,
приходящейся на один зародыш, второй −
обусловлен работой образования
поверхности зародыша площадью
![]() ,
совершаемой за счет внутренней энергии
системы. Второй член в уравнении (13.46)
пропорционален поверхностному натяжению
на границе
раздела фаз. Объем зародыша v
мал по сравнению с объемом всего расплава
V. Это позволяет
пренебречь изменением объема системы
при образовании зародыша. В этом случае
процесс кристаллизации является
изотермическим и изохорным, и равновесие
системы определяется минимумом свободной
энергии. Изменение свободной энергии
Гельмгольца при образовании зародыша
,
совершаемой за счет внутренней энергии
системы. Второй член в уравнении (13.46)
пропорционален поверхностному натяжению
на границе
раздела фаз. Объем зародыша v
мал по сравнению с объемом всего расплава
V. Это позволяет
пренебречь изменением объема системы
при образовании зародыша. В этом случае
процесс кристаллизации является
изотермическим и изохорным, и равновесие
системы определяется минимумом свободной
энергии. Изменение свободной энергии
Гельмгольца при образовании зародыша
|
|
(13.47) |
Для зародыша радиуса R находим
|
|
(13.48) |
Формула (13.48) показывает, что равновесие «кристалл–расплав» является неустойчивым.
Зависимость изменения свободной энергии
зародыша от его радиуса ΔF(R)
имеет максимум при критическом значении
радиуса зародыша
![]() (рис.
13.13), который определяется равенством
(рис.
13.13), который определяется равенством
|
|
(13.49) |
где
![]() –
критический размер зародыша.
–
критический размер зародыша.
|
|
|
Рис. 13.13. Изменение свободной энергии при возникновении кристаллического зародыша имеет максимум, отвечающий критическому размеру зародыша |
Все центры кристаллизации с размерами
меньше критического
![]() неустойчивы,
т. к. при их росте свободная энергия
должна увеличиваться. Все кристаллические
зародыши с размерами больше
неустойчивы,
т. к. при их росте свободная энергия
должна увеличиваться. Все кристаллические
зародыши с размерами больше
![]() будут
расти, поскольку при этом свободная
энергия системы уменьшается.
будут
расти, поскольку при этом свободная
энергия системы уменьшается.
Максимум кривой определяет работу образования зародыша
|
|
(13.50) |
Она равна 1/3 поверхностной энергии зародыша.
Работа образования зародышей новой фазы значительно уменьшается при их возникновении на стенках сосуда или поверхностях частичек примесей.
Рассмотрим образование из пара (фаза I) сферического зародыша жидкости АВС (фаза II) на плоской поверхности фазы III, граничащей с фазой I (рис. 13.14).
|
|
|
Рис. 13.14. Образование сферического зародыша жидкой фазы на границе раздела двух сред [55] |
Работа образования зародыша в случае
его возникновения на стенке равна
![]()
|
|
(13.51) |
где
![]() –
поверхностное натяжение на границе
«зародыш – питающая фаза I»,
–
поверхностное натяжение на границе
«зародыш – питающая фаза I»,
![]() –
поверхностное натяжение на границе
«зародыш – стенка»,
–
поверхностное натяжение на границе
«зародыш – стенка»,
![]() –
то же на границе «стенка – питающая
фаза I». В условиях
равновесия силы поверхностного натяжения
уравновешивают друг друга, т. е.
–
то же на границе «стенка – питающая
фаза I». В условиях
равновесия силы поверхностного натяжения
уравновешивают друг друга, т. е.
|
|
(13.52) |
где
![]() –
краевой угол.
–
краевой угол.
Площадь
![]() сферического
сегмента АВС и
сферического
сегмента АВС и
![]() –
площадь основания сегмента, соответственно
равны
–
площадь основания сегмента, соответственно
равны
|
|
(13.53) |
Отсюда работа образования зародыша
|
|
(13.54) |
При отсутствии смачивания угол
![]() равен
(ртуть на поверхности стекла) и работа
по образованию свободного сферического
зародыша
равен
(ртуть на поверхности стекла) и работа
по образованию свободного сферического
зародыша
![]() ,
т. е. равна 1/3 поверхностной энергии
капли. При частичном смачивании (
,
т. е. равна 1/3 поверхностной энергии
капли. При частичном смачивании (
![]() )
работа уменьшается, а при полном
смачивании (
)
работа уменьшается, а при полном
смачивании (
![]() )
равна нулю. Последние два фактора в
сравнении с первым говорят о том, что
работа образования зародыша на поверхности
раздела меньше работы образования
свободного зародыша. Эти выводы
справедливы и для случая образования
кристаллических зародышей, что объясняет
большую роль стенок и частичек примесей
в ускорении процесса кристаллизации.
)
равна нулю. Последние два фактора в
сравнении с первым говорят о том, что
работа образования зародыша на поверхности
раздела меньше работы образования
свободного зародыша. Эти выводы
справедливы и для случая образования
кристаллических зародышей, что объясняет
большую роль стенок и частичек примесей
в ускорении процесса кристаллизации.
Работа образования зародыша особенно сильно снижается в присутствии частиц изоморфных примесей или кристаллов, имеющих с образующимся сходное строение по каким-либо граням. Это используется, например, при выращивании кристаллических пленок на подложках из тех же или сходных по структуре кристаллов.
Флуктуации и образование зародышей
Возникает вопрос, откуда в замкнутой системе берется энергия для образования зародыша?
В отсутствие примесей возможно самопроизвольное образование зародыша за счет энергии тепловых флуктуаций. В этом случае вероятность образования зародыша определяется формулой Больцмана:
|
|
(13.55) |
где
![]() ,
,
![]() −
температура равновесия,
−
температура равновесия,
![]() −
степень переохлаждения. Эта вероятность
растет с увеличением степени переохлаждения.
Но здесь присутствует и противоположный
эффект. При снижении температуры
уменьшается и скорость диффузии,
коэффициент которой
−
степень переохлаждения. Эта вероятность
растет с увеличением степени переохлаждения.
Но здесь присутствует и противоположный
эффект. При снижении температуры
уменьшается и скорость диффузии,
коэффициент которой
|
|
(13.56) |
где
![]() –
энергия активации диффузии. Уменьшение
скорости диффузии эквивалентно
возрастанию вязкости расплава. С учетом
вязкости вероятность образования
зародышей будет
–
энергия активации диффузии. Уменьшение
скорости диффузии эквивалентно
возрастанию вязкости расплава. С учетом
вязкости вероятность образования
зародышей будет
|
|
(13.57) |
Поскольку вероятность образования
зародышей
![]() обусловлена
действием двух противоположных факторов,
то она имеет экстремумы, определяемые
уравнением
обусловлена
действием двух противоположных факторов,
то она имеет экстремумы, определяемые
уравнением
|
|
(13.58) |
где
![]() .
.
Кинетика кристаллизации
Наблюдения показывают, что при охлаждении расплава до температуры кристаллизации переход в твердое состояние происходит не мгновенно и не одновременно во всем объеме. Кристаллизация развивается из одного или нескольких центров и распространяется с конечной скоростью, захватывая постепенно весь объем неустойчивой фазы. Кинетика процесса кристаллизации описывается двумя величинами:
• скоростью образования центров кристаллизации С в единице объема за единицу времени;
• линейной
скоростью роста
![]() кристалла,
равной скорости перемещения растущей
грани кристалла по нормали к этой
грани.
кристалла,
равной скорости перемещения растущей
грани кристалла по нормали к этой
грани.
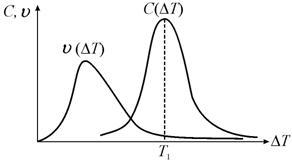
Кривые
![]() и
и
![]() имеют
максимумы, что объясняется тем, что при
малых степенях переохлаждения Т
наблюдается возрастание скорости роста
кристалла
имеют
максимумы, что объясняется тем, что при
малых степенях переохлаждения Т
наблюдается возрастание скорости роста
кристалла
![]() и
скорости образования центров кристаллизации
С, а при больших степенях переохлаждения
Т, в результате
роста вязкости, – их падение.
и
скорости образования центров кристаллизации
С, а при больших степенях переохлаждения
Т, в результате
роста вязкости, – их падение.
Часто максимумы
![]() и
С довольно сильно сдвинуты относительно
друг друга по шкале температур (рис.
13.15). При этом центры кристаллизации в
области максимума скорости роста еще
не образуются, а в области максимума
скорости образования центров кристаллизации
линейная скорость роста уже мала. Это
тормозит суммарную скорость кристаллизации,
и полное время этого процесса растет.
Кристаллизация идет только за счет
пересечения ветвей. Ее можно ускорить,
если, охладив расплав до температуры
максимума кривой С(Т),
выждать некоторое время, пока не
образуются центры кристаллизации, а
затем, нагрев систему, вернуть ее в
область максимума скорости роста.
и
С довольно сильно сдвинуты относительно
друг друга по шкале температур (рис.
13.15). При этом центры кристаллизации в
области максимума скорости роста еще
не образуются, а в области максимума
скорости образования центров кристаллизации
линейная скорость роста уже мала. Это
тормозит суммарную скорость кристаллизации,
и полное время этого процесса растет.
Кристаллизация идет только за счет
пересечения ветвей. Ее можно ускорить,
если, охладив расплав до температуры
максимума кривой С(Т),
выждать некоторое время, пока не
образуются центры кристаллизации, а
затем, нагрев систему, вернуть ее в
область максимума скорости роста.
|
|
|
Рис. 13.15. Кривые линейной скорости роста и скорости образования центров кристаллизации |
Инверсия в химии, 1) изменение конформации циклической молекулы, в результате чего меняется ориентация заместителя относительно кольца. Например, метилциклогексан существует в виде равновесной смеси двух конформаций с преобладанием формы II:

Частота инверсии зависит от характера заместителей и температуры. См. Стереохимия, Конформационный анализ.
2) Переход конфигурации молекулы, содержащей трёхвалентный «пирамидальный» атом (например, азота или мышьяка), в зеркально противоположную. Так, для молекулы с трёхвалентным азотом формы I и II — антиподы оптические:

где а, b, с — различные атомы или группы атомов. Энергетический барьер инверсии обычно невысок и зависит от температуры и характера а, b, с. По отношению к атому углерода («тетраэдрический» атом) обычно употребляется термин «обращение конфигурации» (см. Изомерия).
3) Инверсия сахаров — гидролиз сахарозы (например, свекловичного сахара), сопровождающийся изменением направления вращения плоскости поляризованного луча света раствором сахара. См. Сахара.
Б. Л. Дяткин.
ПИРАМИДАЛЬНАЯ ИНВЕРСИЯ, внутримол. переход конфигурации молекулы, содержащей. трехкоординац. пирамидальный атом, напр. N, P, As, С-, Si- , из одной энантиомерной формы в другую. Осуществляется через промежут. форму с плоской конфигурацией (т.е. путем политопной перегруппировки):

Высота энергетич. барьера П. и DV(см. рис.) зависит от природы пирамидального атома и заместителей. Так, энергетич. барьер П. и. NH3 ~ 24,7 кДж/моль (время жизни пирамидальной конфигурации т = 2,5· 10 -11 с). Он мало меняется при замещении атомов H на группы с близкой электроотрицательностью [ ~ 9,6 кДж/моль для CH3NH2, 18,4 кДж/моль для (CH3)2NH], резко уменьшается в случае более электроположит. лигандов (напр., LiNH2) и повышается в случае более электроотрицат. заместителей (-251,4 кДж/моль для NF3).
С увеличением порядкового номера элемента в одной подгруппе барьеры П. и. однотипных соед. (а следовательно, и устойчивость пирамидальной конфигурации) резко возрастают, что позволяет препаративно разделять энантиомеры, напр. в случае CH3(C3H7)PC6H5. Для пирамидальной конфигурации PH3 t = 2,3·10-6 с, для (СН3)3Р-2 ч, для AsH3-1,4 ч. Синтезированы также оптически активные соед. As(III), сульфониевые соли, сульфоксиды, эфиры суль-финовой к-ты и сульфиниламины.

Электронные факторы, стабилизирующие переходное состояние 11. и., могут изменить геометрию молекулы от пирамидальной до плоской. Напр., барьер П. и. H2NCHO (плоская конфигурация) ~4,6 кДж/моль, что объясняется p-p-сопряжением в плоском переходном состоянии. Этот эффе-кт обусловливает также плоскую геометрию пиррол лов и соед., содержащих связи Si—N или P-N.
При включении атома Э в малый цикл (азиридины) или пятичленный цикл (пирролидины) барьер П. и. повышается из-за дестабилизирующих плоское переходное состояние угловых напряжений (напр., в N-метилазириди-не барьер П. и. ~89,2 кДж/моль). Тот же эффект отмечен для изопропилоксираниевого иона и циклопропилид-аниона.
Впервые соед. с пирамидальной конфигурацией молекул в оптически активной форме - основание Трегера (ф-ла I)-получил В. Прелог в 1944.

Лит.. Вейлстеке А., Основы теории квантовых усилителей и генераторов, пер. с англ., M., 1963; Зефиров H. С., "Ж. Всес. хим. об-ва им. Д. И. Менделеева" 1977, т 22, № 3, с. 261-74; Потапов В. M., Стереохимия, 2 изд., M., 1988. М.Е.Клецкий.
Эвтектика это нонвариантная (при постоянном давлении) точка в системе из n компонентов, в которой находятся в равновесии n твердых фаз и жидкая фаза. Эвтектическая композиция представляет собой мелкодисперсную механическую смесь фаз, плавящихся и кристаллизующихся одновременно при минимальной температуре существования жидкой фазы для данной системы.

Рис. . Бинарная фазовая диаграмма с эвтектическим превращением
Добавляя или отводя тепло, можно изменить пропорцию между кристаллическими фазами и расплавом в эвтектической точке без изменения температуры. После кристаллизации эвтектика становится механической смесью фаз — твёрдой эвтектикой.
Эвтектика является пересечением поверхностей насыщения участвующих кристаллических фаз, находящихся в равновесии с расплавом при минимальной температуре плавления. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в равновесных условиях в точке эвтектики даст все кристаллические фазы, участвующие в системе. Если же при сохранении эвтектической температуры в достаточном количестве подводится тепло, то смесь фаз, отвечающая эвтектическому составу, в равновесных условиях полностью расплавится.


 .
. .
.

 ,
,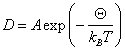 ,
, .
.