
- •Міністерство освіти і науки україни херсонський національний технічний університет Кафедра фізичної та неорганічної хімії
- •Конспект лекцій
- •Лекція № 1. Вступ
- •Предмет вивчення клінічної біохімії. Розділи дисципліни
- •Розділи сучасної біохімії
- •Аналітичні параметри
- •Контроль якості біохімічних досліджень
- •Матеріали заводського виробництва:
- •Контроль на відтворювання ділиться на 4 етапи:
- •3S похибки
- •Лекція 2. Фізико-хімічні методи аналізу, які застосовують в медицині
- •Оптичні методи аналізу
- •Правила проведення фотометрії та розрахунок результатів досліджень
- •Лекція № 3. Обмін речовин. Обмін білків
- •Властивості білків
- •Розміри білкових молекул
- •Класифікація білків
- •Прості білки
- •Складні білки
- •Структура білків
- •Біологічна роль білків
- •Травлення білків в шлунково-кишковому тракті (шкт)
- •Небілкові азотисті компоненти крові
- •Характеристика сечовини як азотистої небілкової речовини
- •Клінічне значення визначення сечовини. Показник u.R.- urea ratio.
- •Креатин і креатинін
- •Характеристика індикану, як небілкової азотистої речовини
- •Поліпептиди і амінокислоти
- •Лекція 4. Білки плазми крові. Методи дослідження білків План
- •Загальна характеристика методів дослідження білків. Традиційні методи виділення й очищення білків
- •Лекція 5. Ферменти. Обмін вуглеводів
- •2. Клінічна ферментологія.
- •Характеристика ферментів як біологічних каталізаторів
- •Властивості й будова ферментів
- •Механізм ферментативного каталізу
- •Класифікація ферментів
- •Метаболізм ферментів
- •Одиниці позначення активності ферментів
- •Клінічна ферментологія
- •Основні напрямки клінічної ферментології
- •Обмін вуглеводів
- •Лекція 6. Обмін вуглеводів та ліпідів
- •Патологія обміну вуглеводів
- •Тести толерантності до глюкози (ттг)
- •Лекція 7. Водно-солевий обмін
- •Обмін води й мінеральних речовин у нормі й патології
- •Мінеральний обмін
- •Лекція 8. Вітаміни. Біологічне окиснення. Сеча
- •Жиророзчинні вітаміни
- •Сутність біологічного окислювання.
- •Фізико-хімічні властивості сечі
- •Хімічне дослідження
- •Патологічні процеси
- •Лекція 9. Рідини внутрішнього середовища організму. Гормони. Обмін речовин у нервовій тканині
- •Обмін речовин у нервовій тканині
- •Література
Правила проведення фотометрії та розрахунок результатів досліджень
В роботі з фотометричною апаратурою слід дотримуватись умов вимірювання, що рекомендуються методикою виконання досліджень. Таких умов, як правило, три: товщина робочого шару кювети, довжина світлової хвилі і спосіб розрахунку результатів аналізу. Для вимірювання за допомогою фотоколориметрії застосовують оптичні кювети з товщиною робочого шару 5 мм або 10 мм, рідше 3 мм.
Довжина світлової хвилі, яка зазначається в методиках, визначається фізико-хімічними властивостями розчинів. Візуальними проявами таких властивостей може бути прозорість і забарвлення розчинів.
Якщо в методиці не вказані товщина робочого шару кювети і довжина світлової хвилі, то можливо підібрати їх самостійно. Для вибору довжини світлової хвилі проводять вимірювання на всіх довжинах хвиль, що можливо встановити у приладі. Зупиняються на тій довжині, що дає найбільшу екстинкцію. Чим вище значення екстинкції, тим менше буде ціна однієї позначки шкали екстинкції та величина можливих випадкових помилок в самому процесі вимірювання. Існують наступні способи розрахунків результатів досліджень в клінічній біохімії: 1) використання умовних одиниць; 2) розрахунки за стандартними (еталонними) розчинами; 3) розрахунки за калібрувальним графіком; 4) розрахунки за коефіцієнтом перерахунку (за фактором).
Умовні одиниці (у.о.) – це примітивний варіант визначення результатів аналізу. Найчастіше це безпосередньо одиниці екстинкції розчинів. В деяких лабораторних методиках екстинкцію, одержану при вимірюванні, множать на 100, 1000 або інший коефіцієнт. Після перетворення отримують показники, які більш зручні для роботи або для порівняння. Використовують умовні одиниці в методиках, що найдавніше використовують у лабораторіях, наприклад, для визначення сіромукоїдів, сіалових кислот, ліпопротеїдів.
Розрахунки результатів досліджень за стандартними (еталонними) розчинами. Стандартні розчини обробляють паралельно з серією досліджуваного біологічного матеріалу в тих же умовах, що й досліджуваний матеріал. Їх використовують в тих випадках, коли мова йде про складні методики, що дають значні похибки. Стандартні розчини нівелюють всі можливі відхилення, але недоліком їх використання є підвищений розхід реактивів і робочого часу, що пов'язано з необхідністю регулярної постановки стандартних проб.
Стандартні розчини мають строго визначену концентрацію певної речовини. Готують їх з реактивів кваліфікації чистоти "х.ч." Зазвичай в біохімічних наборах разом з реактивами знаходиться і стандартний розчин речовини, що визначають. Наприклад, стандартні розчини є в наборах для визначення глюкози, сечовини, холестерину. Концентрація речовини в стандартному розчині повинна бути близька до фізіологічно нормальних значень відповідного компоненту в біологічних рідинах. Наприклад, концентрація стандартного розчину холестерину 5,2 ммоль/л, що знаходиться в межах фізіологічної норми холестерину в крові.
Розрахунок результатів досліджень, що виконується за стандартними розчинами, проводять за простою арифметичною пропорцією:
Ест – Сст
Ед – Сд Сд = Сст · Ед/Ест,
де Ест – екстинкція стандартного розчину, Ед – екстинкція діагностичної проби, Сст – концентрація стандартного розчину, Сд – концентрація діагностичної проби.
Розрахунки результатів досліджень за калібрувальним графіком є зручним варіантом розрахунків, що не потребує зайвих витрат робочого часу та реактивів, як при постановці стандартних проб. Використання калібрувальних графіків доцільно тільки в методиках зі стабільними умовами проведення та добрим підпорядкуванням результатів вимірювання основному закону фотометрії. Калібрувальні графіки будують для кожного фотометру окремо і неприпустимим є їх використання для іншого приладу, навіть у випадку використання однотипних приладів. Періодично, звичайно не рідше одного разу на рік, калібрувальні графіки слід перевіряти, а при необхідності – будувати заново.
Вимоги до оформлення калібрувальних графіків.
Е 1. Вказується
точна назва метода дослідження заводський
номер приладу, до якого побудовано
графік; 2. Вказується довжина світлової
хвилі, товщина робочого шару (товщина
кювети), вихідні дані для побудови
графіку і дата його побудови. 3. Графік
підписує спеціаліст, який його виконав.
1. Вказується
точна назва метода дослідження заводський
номер приладу, до якого побудовано
графік; 2. Вказується довжина світлової
хвилі, товщина робочого шару (товщина
кювети), вихідні дані для побудови
графіку і дата його побудови. 3. Графік
підписує спеціаліст, який його виконав.
С
Будують калібрувальні графіки одноразово при дослідженні серії калібрувальних розчинів певного складу. Серія складається з 3-5 стандартних розчинів, які відрізняються між собою концентрацією у порядку пропорційного збільшення її величини. Діапазон концентрацій повинен охоплювати, як значення фізіологічної норми, так і найбільш імовірні межі патології для досліджуваного компоненту біологічних рідин. З кожного стандартного розчину проби беруть у паралелях для запобігання можливих неточностей піпетування. Для кожної концентрації треба одержати не менше трьох результатів значень екстинкції. Для побудови графіку розраховують середнє арифметичне значення екстинкції. Будують калібрувальний графік на міліметровому папері. Вибирають масштаб значень концентрації й екстинкції таким чином, щоб калібрувальна крива проходила під кутом 45о або наближалась до цього значення.
Розрахунки результатів досліджень за допомогою коефіцієнту перерахунку (фактора перерахунку). Даний варіант розрахунку найбільш простий і швидкий. Розрахунки виконують за формулою: Сд = F · Ед, де Сд – концентрація досліджуваного компоненту, F – коефіцієнт перерахунку, Ед – екстинкція досліджуваної реакційної суміші.
Застосування
коефіцієнту перерахунку, як і
калібрувального графіка, обмежується
методикам з добрим підпорядкуванням
результатів вимірювань основному закону
фотометрії. Коефіцієнт перерахунку є
специфічною величиною для кожного
окремого тесту. Як правило, коефіцієнт
перерахунку вказується в методиці, але
краще його розрахувати самостійно. При
цьому враховуються особливості проведення
реакції та технічні можливості
вимірювальної апаратури лабораторії.
Щоб вивести коефіцієнт перерахунку,
проводять дослідження стандартних
розчинів необхідної речовини у
відповідності з методичними вимогами,
аналогічними для біологічного матеріалу,
або використовують побудований
калібрувальний графік. Коефіцієнт
перерахунку обчислюють за формулою: F
=
![]() .
.
Коефіцієнти перерахунку вимагають періодичної перевірки, звичайно, не рідше одного разу на рік, при необхідності виводять заново. Сьогодні актуальність розрахунків даного типу зростає. Це пов'язано з комп'ютеризацією сучасних фотометрів, а також з використанням у роботі КДЛ біохімічних автоаналізаторів. В апаратурі такого рівня коефіцієнт перерахунку вводиться у пам'ять комп'ютера і при вимірюванні екстинкції досліджуваного розчину концентрація компоненту розраховується і видається автоматично.
Поляриметрія – метод аналізу, заснований на вимірі кута обертання площини поляризації оптично-активними прозорими розчинами чи однорідними рідинами, який дозволяє кількісно визначати в біологічних рідинах вуглеводи.
Поляриметр. Складовими частинами портативного поляриметра П–161М є: джерело світла 1; світлофільтр 2; поляризатори 3, 4; 5 – трубка з розчином оптично-активної речовини, аналізатор 6; шкала 7; окуляр 8 (рис. 4).
1 2 3 4 5 6 7 8

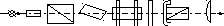
Рис. 4. Схема портативного поляриметра П–161М
Поляризатор і аналізатор (3, 6) – призми Ніколя, що найкраще пропускають світло, яке поляризоване у площині, перпендикулярної до площини головного перетину призми. Звичайно поляризатор складається із двох призм Ніколя. Одна з них показує усе поле зору, що спостерігається через окуляр (8), а друга його половину. Головний перетин цієї призми встановлено під малим кутом стосовно головного перетину великої призми. При обертанні призми навколо оптичної осі приладу змінюється освітленість поля зору. При положенні головного перетину призми аналізатора перпендикулярно до головного перетину великої призми поляризатора ліва половина поля, що відповідає схрещеним призмам, стає темною. Якщо продовжити обертання аналізатора, то затемнюється права сторона поля. Можна домогтися і проміжної освітленості всього поля. Це положення аналізатора вважають нульовим. Невеличкий поворот аналізатора в ту або іншу сторону утворить у полі зору півтінь (звідси і побічна назва поляриметра цього типу – напівтіньовий, рис. 5).

Рис. 5. Схема напівтіньового поля зору в окулярі поляриметра
Якщо після встановлення нульового положення помістити між поляризатором і аналізатором трубку (5) із розчином оптично-активної речовини, що повертає площину поляризатора на кут α, то з’явиться півтінь. Щоб повернутися до нульового положення, треба повернути аналізатор на такий же кут α, що відраховується ноніусом приладу з точністю до 0,1 за шкалою (7). Джерело світла (1) повинно бути монохроматичним. При використанні білого світла використовують світлофільтр (2 рис. 4), що звичайно є складовою частиною поляриметра.
Рефрактометрія – метод визначення концентрації речовини шляхом виміру показника заломлення проміню світла, що проходить крізь розчин (h). Величина показника залежить від природи речовини, її концентрації, довжини хвилі світла, що падає, температури та тиску. Звичайно виміри при визначенні концентрації речовини проводяться при 20 0С і тиску 760 мм рт. ст. за допомогою приладів – рефрактометрів. У клінічних лабораторіях частіше використовують рефрактометри типу УРЛ, РЛ–2, ИРФ–22, які розраховані на безпосереднє визначення сахарози чи білків у водних розчинах.
Рефрактометр ИРФ–22 складається з двох частин – корпуса і основи. Всередині корпуса змонтована шкала і регулятор настроювання приладу. До корпуса примикає призмений блок із двох призм – нерухомої (вимірювальної) і рухомої (освітлювальної). Прилад має спеціальну освітлювальну систему – візирний пристрій, який складається із ручки з окуляром і настроювальним механізмом для сполучення межі світлотіні і перехрестя сітки. Через окуляр видна подвійна шкала (у показниках заломлення світла й відсотках вмісту речовини) і поле зору з перехрестям. Поле зору поділено на світлу і темну частини. Межа світлотіні повинна бути чіткою; різкість настроюється за допомогою окуляру. Кольорову аберацію усувають обертанням ручки компенсатора дисперсії.
Серед електрохімічних методів аналізу в КДЛ застосовують потенціометричний метод, а саме рН-метрію.
рН-метрія – метод аналізу, який базується на залежності потенціалу індикаторного скляного електрода від концентрації іонів Гідрогену (Н+), що визначають у розчинах. рН – водневий показник, що застосовується для позначення реакції середовища (кислої, лужної або нейтральної). рН = –lg С (Н+), де С – концентрація іонів Гідрогену. Визначення рН середовища має важливе практичне значення, по-перше, як один із показників гомеостазу – сталості внутрішнього середовища організму. По-друге – рН має значення при виконанні біохімічного аналізу ряду компонентів живого організму. Наприклад, ферментів, біологічна активність яких безпосередньо залежить від величини рН.
Як прилади для потенціометричного аналізу застосовують рН-метри та йономіри.
